废铅酸蓄电池铅膏中各成分含量的测定方法研究
陈梅,柯昌美,邱德芬,张松山,杨柯
(武汉科技大学化学工程与技术学院,湖北武汉430081)
化工分析与测试
废铅酸蓄电池铅膏中各成分含量的测定方法研究
陈梅,柯昌美,邱德芬,张松山,杨柯
(武汉科技大学化学工程与技术学院,湖北武汉430081)
废铅酸蓄电池铅膏是再生铅的主要来源,其主要成分为PbSO4、PbO2、PbO和Pb,此外还含有少量的Fe、Cu、Sn、Cd等金属元素。主要介绍了铅膏中各成分含量的测定方法,包括化学试剂测定法及仪器分析方法,重点阐述了各种测定方法的基本原理和检测步骤。详细综述了近年来国内外对铅膏中各成分测定方法的研究进展,并对铅膏回收工艺做了展望。
废铅蓄电池;铅膏成分;测定方法
随着交通工具与移动通信等行业的快速发展,中国的铅需求量将持续增加,预计2015年中国铅需求量将达600万t。而在铅的消耗结构中,铅蓄电池的耗铅量占铅总消耗量的85%左右,其中中国铅蓄电池产量占世界产量的1/3[1]。所以对废铅蓄电池的回收处理不仅可以解决铅资源紧张的问题,还可以避免废铅蓄电池对环境的污染。回收废铅蓄电池主要难点是对铅膏的处理,因此对铅膏成分及含量的研究将成为处理铅膏过程中不可缺少的一步。
废铅蓄电池铅膏主要是两极板上活性物质经过多次充放电使用后形成的浆状物质,其主要成分有PbSO4(约50%,质量分数,下同)、PbO2(约28%)、PbO(约9%)、Pb(约4%),还可能有少量Fe、Cu、Sb、Cd、Sn等金属物质[2]。PbO、PbO2、Pb中只含氧和铅2种元素,根据氧元素来确定其含量比较困难,所以只能根据铅元素来确定其含量,这样就要排除铅膏中其他铅化合物的干扰[3]。
1 化学试剂络合滴定法
Pb2+与乙二胺四乙酸(EDTA)络合原理:Pb2+能与二甲酚橙在pH为5~6时形成紫红色络合物,但是该络合物并不稳定,当向溶液中加入EDTA时,Pb2+能与EDTA形成无色稳定络合物(物质的量比为1∶1),从而使溶液中的紫色消失,当用EDTA标准溶液滴定至溶液由紫红色突变为亮黄色时,即为滴定终点,根据EDTA用量计算溶液中Pb2+的含量。
1.1铅膏中氧化铅含量的测定
1.1.1原理
测定铅膏中氧化铅含量的方法在于将固体中的铅转化为溶液中的Pb2+。由于原铅膏中只有Fe与PbO和CH3COOH反应生成Pb2+和Fe2+,将试样溶解于稀醋酸溶液中,所生成的Pb2+在pH为5~6的溶液中,以醋酸钠和六亚甲基四胺溶液作缓冲剂、二甲酚橙为指示剂,通过EDTA络合滴定[4]。
1.1.2实验步骤
准确称取3 g(精确到0.000 1 g)过筛试样(≤122 μm)于干燥洁净的烧杯中,加入60 mL 5%(质量分数,下同)醋酸搅拌溶解30 min,缓慢过滤,并用5%的醋酸溶液洗净烧杯和残渣中的铅离子,将滤液和洗涤液全部移入250 mL容量瓶中,向容量瓶中加蒸馏水至刻度处,摇匀。残渣保留用来测剩余成分含量。用移液管吸取25 mL滤液于250 mL三角杯中,加水稀释至80~100 mL,用1+1氨水调节溶液pH为3~6,加5 mL抗坏血酸掩蔽铁离子,3 mL 20%六亚甲基四胺溶液、5 mL 20%醋酸钠溶液、3滴0.5%二甲酚橙指示剂,用0.05 mol/L EDTA标准溶液滴定至溶液由紫红色变为亮黄色[4]。
1.1.3分析结果
氧化铅质量分数(w)按下式计算:
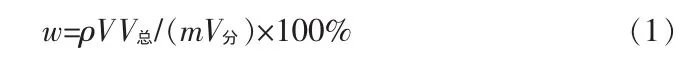
式中,ρ为EDTA标准溶液对氧化铅的滴定度,g/mL;V为EDTA标准溶液的用量,mL;V总为试液总体积,mL;V分为分取试液的体积,mL;m为试样质量,g。
1.2铅膏中金属铅、铜和锡含量的测定[4-6]
1.2.1原理
测定氧化铅含量实验的残渣中,金属Pb、Cu、Sn与硝酸反应生成二价离子,将溶液分为3份调节pH为5~6,先以二甲酚橙为指示剂,用EDTA标准溶液滴定,在第2份试液中加入硫脲掩蔽铜离子,再用EDTA标准溶液滴定得到铅离子和锡离子含量,根据差减法即可计算铜的含量。在第3份试液中加入氟化氨掩蔽锡,根据差减法可测得金属锡含量[3]。
1.2.2实验步骤
取1.1节测定氧化铅实验的残渣于烧杯中,向其中加入1+1硝酸溶液连续搅拌溶解30 min,快速过滤,用1+1 HNO3洗液洗涤烧杯及残渣,将滤液和洗涤液移入250 mL容量瓶中,加蒸馏水至刻度,摇匀,得到分离的滤液,用移液管吸取3份50 mL溶液于250 mL三角杯中,加水稀释至100 mL,用1+1氨水调节pH为3~6,加入5 mL 20%醋酸钠溶液、3 mL 20%六亚甲基四胺溶液、3滴0.5%二甲酚橙指示剂,在第2份试液中加入3 mL硫脲,第3份中加入3 mL氟化氨,用0.05 mol/L EDTA标准溶液滴定至溶液由紫红色变为亮黄色。
1.2.3分析结果
金属铅(w1)、铜(w2)、锡(w3)的质量分数按下式计算:
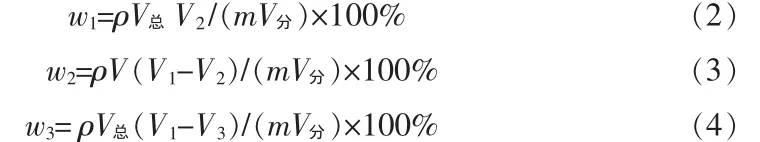
式中,V1、V2、V3为3份EDTA标准溶液的用量,mL。
1.3二氧化铅含量的测定
1.3.1原理
在硝酸溶液中,二氧化铅可与过氧化氢发生氧化还原反应,而剩余的过氧化氢可以用高锰酸钾准确滴定。根据滴定高锰酸钾溶液的体积,计算出二氧化氢剩余量,从而计算二氧化铅的含量[4]。或用EDTA标定生成的Pb2+计算出二氧化铅含量。
1.3.2实验步骤
方法1:取1.2节测定金属铅含量实验的残渣于烧杯中,加入1+1硝酸15 mL,用移液管准确加入5 mL 1+40过氧化氢溶液,搅拌溶解30 min,使试样溶解完全,缓慢过滤,用5%的醋酸溶液洗净烧杯和残渣中的铅离子,将滤液和洗涤液移入烧杯中,用0.1 mol/L高锰酸钾标准溶液滴定至呈浅红色(30 s不变),记录高锰酸钾溶液用量(VKMnO4),按以上方法同时同条件做试剂空白实验并记录下高锰酸钾溶液用量(V0)。
方法2:用1+1氨水调节溶液pH为3~6,加5 mL 20%醋酸钠溶液、3 mL 20%六亚甲基四胺溶液、3滴0.5%二甲酚橙指示剂,用0.05 mol/L EDTA标准溶液滴定至溶液由紫红色变为亮黄色。
1.3.3分析结果
1.3.2节2种方法的二氧化铅质量分数(w4、w4′)按下式计算:
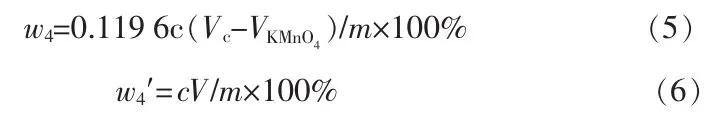
式中,c为高锰酸钾标准溶液的实际浓度,mol/L;V0为空白高锰酸钾标准溶液的用量,mL;VKMnO4为试样高锰酸钾标准溶液的用量,mL;0.119 6是与1 mL、1mol/L高锰酸钾标准溶液相当的二氧化铅的质量,g;ρ为EDTA标准溶液对二氧化铅的滴定度,g/mL。
1.4硫酸铅含量测定
1.4.1原理
硫酸铅含量的测定主要通过铅和硫含量来计算。
1)用HCl-NaCl-CaCl体系将硫酸铅中的铅转化为铅离子,齐美富等[7]确定浸出过程最佳工艺:温度为95℃、时间为90 min、搅拌速度为500 r/min。
2)由脱硫工艺得到启发,将1.2节测定氧化铅实验中的残渣溶于Na2CO3等碳酸盐溶液中,PbSO4转化为PbCO3,再加CH3COOH溶液转化为Pb2+。Pb2+采用EDTA络合滴定,反应方程式:

3)利用盐酸-氯化钠体系溶解铅膏,再加入氯化钡使硫酸根沉淀,煅烧后由硫酸钡的质量来确定硫酸铅的含量。
1.4.2实验步骤
1)在烧杯中加入一定浓度的盐酸、NaCl溶液及一定量的CaCl,开启搅拌并加热,达到预定温度95℃后将1.3节测定二氧化铅的残渣倒入烧杯中,搅拌速度为500 r/min,连续搅拌溶解90 min后快速过滤,用10%的热氯化钠洗液洗涤烧杯、残渣至无铅离子,将滤液和洗涤液全部移入250 mL容量瓶中,加入氯化钠溶液至刻度,摇匀。用移液管吸取25 mL试液,于250 mL三角杯中,加水稀释至80~100 mL,继续加热至90℃,用1+1氨水调节溶液pH为5~6,加5 mL 20%乙酸钠溶液、3 mL 20%六亚甲基四胺溶液、3 mL饱和硫脲、0.1 g抗坏血酸、3滴0.5%二甲酚橙指示剂,用EDTA标准溶液滴定至溶液变为亮黄色[4]。硫酸铅的质量分数(w5)按下式计算:

式中,ρ为EDTA标准溶液对硫酸铅的滴定度,g/mL。
2)将测定氧化铅时的残渣收集于烧杯中,加150 mL 25%的碳酸钠溶液,连续搅拌溶解1 h,快速过滤,加5 mL冰醋酸,用10%的碳酸钠洗液洗涤烧杯、残渣至无铅离子,将滤液和洗涤液全部移入250 mL容量瓶中,向容量瓶中加蒸馏水至刻度,摇匀。用移液管吸取25 mL试液于250 mL三角杯中,加水稀释至80~100 mL,用1+1氨水调节溶液pH为5~6,加5 mL 20%乙酸钠溶液、3 mL 20%六亚甲基四胺溶液、3 mL饱和硫脲、0.1 g抗坏血酸、3滴0.5%二甲酚橙指示剂,用0.05 mol/L EDTA标准溶液滴定至溶液变为亮黄色。硫酸铅含量按式(9)计算。
3)在烧杯中加入50mL 1mol/L的盐酸和25%氯化钠溶液,开启搅拌并加热至95℃,准确称取3.000 g铅膏加入烧杯中,充分搅拌溶解并加入20 mL(1+40)过氧化氢,待溶解完全后快速过滤,用10%的热氯化钠洗液洗涤烧杯及残渣,将滤液和洗涤液移入250 mL烧杯中,继续加热,向溶液中加入20 mL 1 mol/L氯化钡,待沉淀完全后过滤,并用蒸馏水洗涤沉淀,将沉淀移入坩埚中煅烧12 h,最后称量沉淀质量。硫酸铅按下式计算:

式中,m为试样质量;m1为坩埚的质量;m2为煅烧后坩埚和沉淀总质量;MPbSO4和MBaSO4为硫酸铅和硫酸钡的摩尔质量。
1.5铁含量的测定
1.5.1方法原理
在pH为4~6溶液中的Fe2+可与邻菲罗啉生成橙红色络合物,测定吸光度,在标准曲线上查得对应的铁含量,铅及其他干扰素用EDTA酒石酸掩蔽。
1.5.2分析步骤
配制不同浓度铁的标准溶液,以不含铁的空白溶液为参比,在510 nm波长处,分别测定不同浓度铁的标准溶液的吸光度,以溶液中铁含量为横座标、吸光度为纵座标绘制标准曲线。准确称取0.5 g试样,于100 mL烧坏中,加10 mL 1+4硝酸溶液、2mL 20%酒石酸溶液,加热溶解,使溶液沸腾10 min以去除溶液中的氮氧化物。加5 mL 30%EDTA溶液、5 mL 30%柠檬酸钠溶液、3 mL 10%盐酸羟胺溶液,用1+1氨水调节溶液pH为4~6,加5 mL 0.1%邻菲罗啉溶液,待溶液反应完全,在510 nm处测定试样的吸光度,以空白试剂为参比,测得的吸光度在标准曲线上查得相应的铁含量。
1.5.3分析结果
铁的质量分数(w6)按下式计算:

式中,mFe为试样在准曲线上对应的铁含量,g;m总为试样的总质量,g。
1.6锑含量的测定
1.6.1原理
用硫酸、硫酸钾、二水合氟化钾混合液来分解试样,并加入硫酸联胺还原试样中的锑离子,调整溶液pH,以甲基橙和亚甲基蓝混合液作为指示剂,用硫酸铈标准溶液快速滴定试样中的锑。经过长期实验证明,符永际等[8]测定锑的方法具有快速准确、选择性好、易操作等优点,在生产实践中应用广泛[7]。
1.6.2实验方法
准确称取0.300 0 g试样置于锥形瓶中,加入1 g硫酸钾和1 g二水合氟化钾,再加入30 mL 50%的硫酸溶液,加热分解试样40 min,始终保持溶液微沸溶解,向锥形瓶中加入1g硫酸联胺,继续加热10min后停止加热,待溶液冷却后加入40 mL水和30 mL盐酸,摇匀,再加入5 mL磷酸,继续加热至80~90℃,滴加2滴0.1%亚甲基蓝和2滴0.1%甲基橙作为指示剂,用硫酸铈溶液滴定至溶液刚好变为蓝绿色,即为终点,同时做空白实验。
1.6.3分析结果
锑的质量分数(w7)按下式计算:

式中,ρ为滴定系数,表示l mL硫酸铈标准溶液相当于锑的质量,g/mL;V硫酸铈为滴加硫酸铈标准溶液的体积,mL。
2 仪器分析方法
根据铅元素含量来推算铅膏中含铅化合物的含量是比较简单的方法,该方法需和化学试剂滴定法相结合,并按前文中的测定顺序依次测定,PbSO4含量还可以根据硫元素来确定。
2.1铅含量的测定方法
2.1.1ICP-AES法
电感耦合等离子体发射光谱(ICP-AES)法利用铅元素的原子或离子激发后跃迁回低能级(或基态)时发射的电磁辐射(线光谱)的波长及其强度对铅膏中的铅进行定量分析。王蕾等[9]通过对标准样品进行测定和对谱线干扰元素及谱线发射强度的综合考虑,选择谱线2 169 nm为最佳测定谱线。随着电感耦合等离子体质谱仪的不断改进和更新,其测定时间短、灵敏度高、检出限低、线性范围宽等优点,已被更多分析工作者认可。
2.1.2原子吸收光谱法
原子吸收光谱法是利用光谱仪从光源辐射出具有待测元素特征谱线的光,通过试样蒸气时被蒸气中待测元素基态原子所吸收,根据辐射特征光线被减弱的程度来测定试样中待测元素的含量。陶健等[10]和邹志翔等[11]均研究了石墨炉原子吸收光谱法测铅含量的方法,工作波长为283.3 nm。结果表明,石墨炉原子吸收光谱法能够准确、可靠地测定茶样品中的铅含量。车弟强等[12]的研究表明,火焰原子吸收光谱法测定磷矿石和磷石膏中铅含量具有较高的灵敏度,其检测时间短,操作简便。
2.1.3X射线荧光光谱技术(XRF)
用高速电子激发产生的X射线作为激发源去轰击其他原子的内层电子,X射线元素受激发射出来的特征X射线荧光的强度则取决于该元素的含量,这是定量分析的依据。黄启厅等[13]利用便携式XRF仪测定试样中的铅含量,结果与原子吸收分光光度法的测定结果比较接近,并且测定的准确度和精确度随着样品中铅含量的升高而提高。
2.2硫含量的测定方法
2.2.1ICP-AES法
ICP-AES法原理同2.1.1节。
2.2.2高频红外吸收法[14-15]
高频红外碳硫分析仪实质上就是高频感应燃烧炉与红外碳硫分析仪组合而成的一种测试分析仪器,二氧化碳的最大吸收位于4.26 μm,二氧化硫的最大吸收位于7.40 μm,与红外区非常接近,所以该方法可以准确、快速地测定出样品当中碳和硫元素的质量分数。在整个实验过程中,助熔剂对样品燃烧过程中是否能完全释放出碳和硫有直接影响,因此助熔剂的选择至关重要。
2.2.3Vario-EL元素分析仪测定法[16]
元素分析仪是由独特的吸附-解析原理,在高温下充分燃烧分解样品中各元素并分别转化为氧化物的形式,这些混合气体在载气(氦气)的推动作用下进入吸附柱中,通过吸附和解吸附作用将气体组分分离。分离后的气体随载气一起进入热导池检测器中检测,其测量精度高,可同时测量几种元素。
2.3金属元素Fe、Cu、Cd、Sn、Sb含量测定
金属元素Fe、Cu、Cd、Sn、Sb的仪器测定方法基本与铅类似,主要为ICP-AES法、原子吸收光谱法和X射线荧光光谱技术,但在一些细节上有些改进。
姜宪娟等[9]研究了聚苯胺修饰电极-电化学氢化物发生原子荧光光谱法测定锡含量的方法。利用VISTA-MPX等离子体发射光谱仪测定锡含量,首先在电化学氢化物发生池中使锡生成相应的氢化物,电化学氢化物发生池是以铂片电极为阳极,聚苯胺修饰的石墨电极作为阴极,在阴极区电极表面电解产生的原子态氢与样品中的Sn反应,生成的氢化物随电解液一起流出阴极区与外部的载气和补充的氢离子混合,经气液分离器分离后送入原子化区进行原子荧光测定,从而测得样品中的锡含量。
秦淑琪等[6]根据硫脲和铜生成稳定的配合物,氟化铵则与锡生成稳定的配合物,利用铅在交流极谱的示波器上产生敏锐切口的性质,研究了交流极谱示波器法测定铜、锡含量,结合上述络合滴定方法,用示波器判断反应终点更加准确。
3 结束语
随着地球自然资源逐渐减少,对固体废弃物的资源化、无害化的研究将更加深入,而了解其组成和含量是回收利用的第一步。对铅膏的各成分含量的测定是回收铅膏必不可少的过程,通过综合比较各种方法的利弊,最好是将试剂法和仪器法相结合,准确测定铅膏的组成,为回收利用提供依据。
[1]李卫峰,蒋丽华,湛晶,等.废铅酸蓄电池再生技术现状及进展[J].中国有色冶金,2011(6):53-56.
[2]杨家宽,朱新峰,刘万超,等.废铅酸电池铅膏回收技术的研究进展[J].现代化工,2009,29(3):32-37.
[3]王瑞斌,薛成虎,王玉春.硫脲掩蔽-EDTA减量滴定法测定原油中微量铜[J].冶金分析,2009,29(1):755-758.
[4]朱新峰.废铅膏有机酸浸出及低温焙烧制备超细铅粉的基础研究[D].武汉:华中科技大学,2012.
[5]姜宪娟,淦五.聚苯胺修饰电极-电化学氢化物发生原子荧光光谱法测定食品中锡含量[J].分析实验室,2012,31(3):101-104.
[6]秦淑琪,何英.锡合金电镀液中铜、锡含量的测定[J].电镀与涂饰,2004,23(6):28-30.
[7]齐美富,郑园芳,桂双林.废铅酸蓄电池中铅膏氯盐体系浸取铅的动力学研究[J].矿冶工程,2010,30(6):61-64.
[8]符永际,王满桂,李兵.鼓风炉渣中锑含量测定方法改进[J].湖南有色金属,2013,29(3):74-76.
[9]王蕾,温宏利,马新荣,等.电感耦合等离子体发射光谱法测定硫化物矿中的高含量铅[J].岩矿测试,2011,30(3):305-309.
[10]陶健,蒋炜丽,王晖,等.石墨炉原子吸收光谱法测定茶叶中铅含量的方法学研究[J].中国食品学报,2010,10(6):208-212.
[11]邹士翔,王静.石墨炉原子吸收光谱法测定土壤铅含量初探[J].科学论坛,2009(29):30.
[12]车弟强,杜舜贤,林继英,等.火焰原子吸收光谱法测定磷矿石和磷石膏中铅含量[J].磷肥与复肥,2010,25(6):73.
[13]黄启厅,周炼清,史舟,等.FPXRF——偏最小二乘法定量分析土壤中的铅含量[J].光谱学与光谱分析,2009,29(5):1434-1438.
[14]曾宪跃.应用高频红外碳硫分析仪测定地质样品中碳、硫成分[J].中国高新技术企业,2014(16):55-56.
[15]史万利,刘宪彬,李奇特,等.高频燃烧红外吸收法测定火法镍基体料中的碳和硫//2012国际冶金及材料分析测试学术报告会(CCATM2012)论文集[C].北京:中国金属学会,中国机械工程学会,2012:898-901.
[16]应卫.Vario EL元素分析仪测定含硫配合物的改进方案及应用[J].实验室科学,2011,14(1):164-167.
——————
联系方式:296795101@qq.com
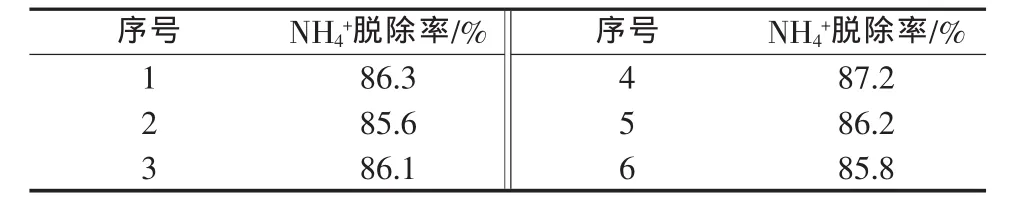
表8 最佳脱铵反应条件实验
3 总结
1)碳酸钠可以有效脱除磷矿选矿废水中的钙离子;综合考虑选矿废水中钙离子的脱除情况、反应效率及反应能耗,选定碳酸钠脱除磷矿选矿废水中钙离子的最佳反应条件:碳酸钠的加入量为理论量的105%、反应时间为1 h、搅拌速度为200 r/min,在此条件下,磷矿选矿废水中的钙离子的脱除率为96%左右。2)氧化镁可以有效脱除磷肥废水中的铵离子;综合考虑磷肥废水中铵离子的脱除情况、反应效率及反应能耗,选定氧化镁脱除磷矿选矿废水中铵离子的最佳反应条件:氧化镁的加入量为理论量的90%、反应时间为10 min、搅拌速度为200 r/min,在此条件下,磷矿选矿废水中的铵离子的脱除率为86%左右。
参考文献:
[1]谭明,魏明安.磷矿选矿技术进展[J].矿冶,2010,19(4):1-6.
[2]谷守玉,王光龙.硫酸分解磷矿第一阶段反应动力学研究[J].化工矿物与加工,2005,34(7):15-17.
[3]邓耀杰,李平,朱凡,等.以回用为目标的污水深度处理组合工艺及其发展[J].环境工程,2005,23(3):10-14.
[4]阙仁江,赵升和.工业磷酸一铵生产工艺的优化[J].磷肥与复肥,2012,27(2):20-22.
[5]刘军.磷酸镁铵沉淀(MAP)法处理氨氮废水影响因素分析[J].北方环境,2013,25(11):171-173.
[6]秦继军,郭雅晖.磷酸镁铵沉淀法处理高浓度氨氮废水工艺探究[J].资源节约与环保,2013(10):83.
[7]雷武.以过磷酸钙为原料生产磷酸镁铵的研究[J].磷肥与复肥,2006,21(6):21-22.
[8]程芳琴,贺春宝.磷酸镁铵的性质、制备方法及应用[J].磷肥与复肥,2004,19(4):53-54.
——————
收稿日期:2015-05-21
作者简介:史连军(1967—),男,高级工程师,主要研究方向为水处理和伴生热资源的综合利用,已公开发表文章7篇。
联系方式:chemostar@126.com
Determination method of each component content of lead paste in waste lead-acid battery
Chen Mei,Ke Changmei,Qiu Defen,Zhang Songshan,Yang Ke
(College of Chemical Engineering and Technology,Wuhan University of Science and Technology,Wuhan 430081,China)
Lead paste in the waste lead-acid battery is the main source of secondary lead,and its composition was mainly made up of PbSO4,PbO2,PbO,and Pb,moreover it also contained a small amount of metallic elements,such as Fe,Cu,Sn,and Cd.The determination methods of each component in the lead paste,including chemical reagent method and instrument analysis method,were mainly introduced.The basic principles and test steps for each determination method were expounded. The research progress of the determination methods of each component in recent years at home and abroad was also reviewed in detail and a prospect for the recycling process of lead paste was made.
waste lead-acid battery;lead paste composition;determination method
TQ134.33
A
1006-4990(2015)11-0070-05
2015-05-16
陈梅(1992—),女,硕士,主要研究方向为固体废弃物的回收与利用以及湿法回收利用废铅蓄电池铅膏。
解田

