磁性γ-Bi2MoO6/Fe3O4复合材料的制备及其光催化性能*
左广玲,叶红勇,李入林
(南阳理工学院生物与化学工程学院,河南南阳473004)
磁性γ-Bi2MoO6/Fe3O4复合材料的制备及其光催化性能*
左广玲,叶红勇,李入林
(南阳理工学院生物与化学工程学院,河南南阳473004)
采用共沉淀及微波溶剂热法制备出具有核壳结构的磁性γ-Bi2MoO6/Fe3O4复合可见光催化剂。利用X射线衍射(XRD)、透射电子显微镜(TEM)、紫外可见漫反射光谱(UV-Vis)和振动样品磁强计(VSM)等测试手段表征了试样的结构和性能。结果表明:制备的γ-Bi2MoO6/Fe3O4复合材料具有良好的顺磁性,在外加磁场的作用下,可与液相迅速分离。γ-Bi2MoO6包覆在Fe3O4表面形成的核壳结构使催化剂吸收带边红移,在可见光区的吸收增强;以罗丹明B为目标降解物考察了催化剂的可见光催化降解性能。结果显示:磁性γ-Bi2MoO6/Fe3O4的可见光催化活性优于纯γ-Bi2MoO6。当Fe3O4的质量分数为10%时,光催化活性最好,重复使用3次,对罗丹明B的降解率仍能达到85%。
γ-Bi2MoO6;Fe3O4;磁性;可见光催化降解
钼酸铋是一类具有层状结构的化合物,有α-Bi2Mo3O12、β-Bi2Mo2O9和γ-Bi2MoO63种晶型[1]。其中,γ-Bi2MoO6是简单的Aurivillius类化合物,属钙钛矿型复合氧化物,以共角、畸变的MoO6八面体钙钛矿片层镶嵌在(Bi2O2)2+片层当中,拥有特殊的层状结构[2]。由于γ-Bi2MoO6的禁带宽度约为2.7 eV,能被可见光激发,因此被认为是一种具有可见光响应的新型复合氧化物,受到了国内外学者的广泛关注[3]。但是,目前γ-Bi2MoO6对有机废水的处理并未能实现工业化应用,主要原因是γ-Bi2MoO6在降解有机污染物时,多以粉末形式悬浮于水体中进行,由于其颗粒细小,造成回收困难,并且易随水流失造成浪费及环境二次污染[4]。因此,在保证γ-Bi2MoO6光催化效率的前提下,解决回收再利用问题成为实现其工业化应用的关键。
近年来,关于磁载新型催化剂的研究已成为国内外热点,这类复合材料是将光催化剂固定在磁性载体上,使其既具有较好的光催化活性,又能利用磁性分离,多次循环利用,应用前景十分广阔[5]。陈金媛等[6]采用溶胶-凝胶法,制备出便于回收、可重复使用的磁性TiO2/Fe3O4光催化剂。叶林静等[7]利用共沉淀及退火处理法,合成出的磁性Fe3O4/ZnO纳米材料,具有高催化活性且能回收循环使用。刘坤杰等[8]则采用水相沉淀法,以Fe3O4粒子为核心,制备出更易于从溶液中分离的磁性BiVO4可见光催化材料。但是,目前还未见有关对γ-Bi2MoO6进行磁载处理的报道。
笔者采用共沉淀及微波溶剂热法,制备出一种具有核壳结构的磁性γ-Bi2MoO6/Fe3O4复合可见光催化剂,探讨了γ-Bi2MoO6/Fe3O4的晶体结构和光吸收性质。并以罗丹明B为目标降解物,对γ-Bi2MoO6/Fe3O4的光催化性能及循环使用情况做了研究。
1 实验部分
1.1试剂与仪器
试剂:Bi(NO3)3·5H2O、(NH4)6Mo7O24·4H2O、FeCl3· 6H2O、FeSO4·7H2O、十二烷基硫酸钠(SDS)、乙二醇甲醚(EM)、硝酸、氢氧化钠、无水乙醇、罗丹明B,均为分析纯。
仪器:XRD-6000型X射线衍射仪、JEM-3010型透射电子显微镜、UV-2550型紫外可见分光光度计、VSM-7310型振动样品磁强计、MKG-M1UC型微波常压水热合成仪、JY92-Ⅱ型超声波细胞粉碎机。
1.2光催化剂的制备
1.2.1磁性Fe3O4的制备
分别取2 mmol FeCl3·6H2O和12 mmol FeSO4· 7H2O加入适量去离子水溶解,配制成总铁浓度为0.2 mol/L的溶液。在超声振荡下加入0.1 g SDS,待SDS溶解完全,用2 mol/L NaOH溶液调节pH=10,继续超声振荡反应1 h。反应结束后,利用钕铁硼永磁铁分离反应液,得到黑色粉状的Fe3O4,经水洗、无水乙醇洗涤后,60℃下干燥12 h,备用。
1.2.2γ-Bi2MoO6/Fe3O4的制备
称取1 mmol(NH4)6Mo7O24·4H2O,溶于80 mL水与EM的混合溶液(水与EM体积比为2∶3)中,加入适量的Fe3O4粉体,超声振荡分散均匀。再取5 mmol Bi(NO3)3·5H2O溶于20 mL 1.5 mol/L的硝酸溶液。在超声振荡作用下,将硝酸铋溶液逐滴加入钼酸铵混合溶液中,用2 mol/L NaOH溶液调节pH= 9。将混合溶液转入反应釜,置于装有回流管的微波常压水热合成仪中,控制温度为160℃,反应12 h。自然冷却,经离心分离,去离子水多次洗涤和无水乙醇洗涤后,60℃下干燥24 h,得到磁性γ-Bi2MoO6/Fe3O4复合材料。所得样品记为BMO/ Fe3O4(w),其中w代表复合材料中Fe3O4的质量分数,分别为8%、10%和12%。
1.3光催化降解实验
光催化降解实验在自制的光催化反应装置(光源为碘钨灯,工作波长为325~800 nm,紫外红外滤光片,通带为420~700nm)中进行,以罗丹明B为目标降解物。催化剂最佳用量为1 g/L,暗室中与100 mL 10mg/L的罗丹明B溶液混合,超声振荡处理60 min至吸附-脱附平衡,置于光催化反应器中。每隔30min取样5 mL,经高速离心分离,取上清液测定罗丹明B的吸光度(检测波长为554 nm),根据下式计算罗丹明B的降解率(D)。
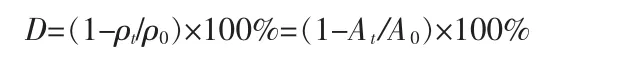
式中,ρ0和ρt分别是降解前后罗丹明B溶液的质量浓度,mg/L;A0和At分别是降解前后罗丹明B溶液的吸光度。
2 结果与讨论
2.1光催化剂的表征
2.1.1XRD分析
图1为不同样品的XRD谱图。从图1可以看出,Fe3O4特征峰的峰值和峰位均与JCPDS标准卡片(79-0417)对应,且没有杂峰出现,说明所得产物为纯相尖晶石结构的Fe3O4[9]。纯γ-Bi2MoO6和BMO/Fe3O4(w),均在28.7、32.9、33.4、36.4、48.5、54.7、58.5°处出现了明显的衍射峰,分别对应正交晶系的(131)、(200)、(060)、(151)、(062)、(133)和(262)晶面的衍射峰,与JCPDS卡片(21-0102)对照可知[10],制备的γ-Bi2MoO6和BMO/Fe3O4(w)的晶型都属于正交钙钛矿结构,Fe3O4并未进入其晶格内部。只是γ-Bi2MoO6包覆Fe3O4后,在30.1、35.4、43.5、56.9、62.5°处出现了Fe3O4的衍射峰,且峰强度随Fe3O4含量的增加而增强。
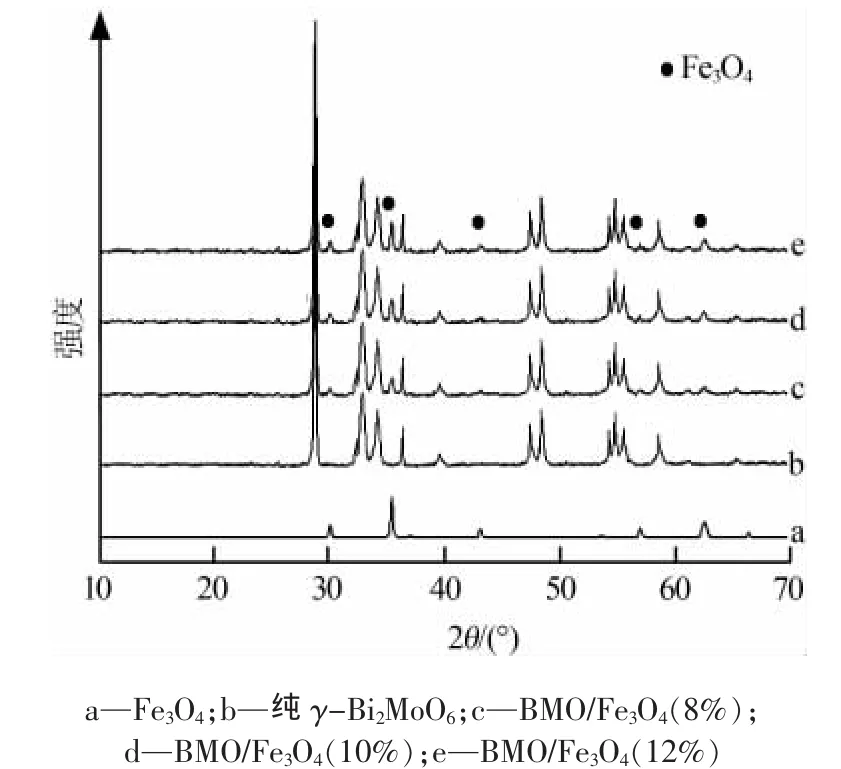
图1 不同样品的XRD谱图
2.1.2TEM分析
图2是纯Fe3O4和BMO/Fe3O4(10%)样品的TEM照片。从图2a可以看出,纯Fe3O4颗粒呈球形,有部分团聚发生,平均粒径为50 nm左右;从图2b可以看出,γ-Bi2MoO6包覆在Fe3O4表面,样品明显具有核-壳结构。由于Fe3O4是磁性材料,对电子的吸收能力远大于γ-Bi2MoO6,因此位于核部分的Fe3O4呈深色[11],而壳层的γ-Bi2MoO6则呈浅色。

图2 Fe3O4(a)和BMO/Fe3O4(10%)(b)样品的TEM照片
2.1.3UV-Vis分析
图3为不同样品的UV-Vis吸收光谱图。从图3可以看出,纯γ-Bi2MoO6的吸收带边(即光吸收阈值λg)在476 nm附近,根据禁带宽度(Eg)计算公式:Eg= 1 240/λg,算出其禁带宽度Eg=2.61 eV;Fe3O4的加入使γ-Bi2MoO6的吸收边向长波方向移动,且随Fe3O4加入量的增加,红移和禁带宽度减小越明显。其中BMO/Fe3O4(12%)的吸收带边为546 nm,禁带宽度Eg=2.27 eV,较纯γ-Bi2MoO6窄了0.34 eV,说明Fe3O4的加入能增强γ-Bi2MoO6的可见光吸收能力。这是因为γ-Bi2MoO6与Fe3O4形成的核壳结构改变了单组分的性质,根据文献[12]的报道,核壳间的晶格差异使核物质受应力挤压,而壳物质则发生拉伸应变,这种应变效应可以使禁带宽度变窄。当Fe3O4含量增加时,应变效应增强,使γ-Bi2MoO6禁带宽度变的更窄,进一步拓宽了其对可见光的吸收。
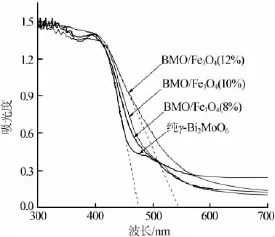
图3 不同样品的UV-Vis吸收光谱图
2.1.4VSM分析
图4为不同样品在室温条件下的磁滞回线。从图4可以看出,所有样品的磁滞回线均为S型曲线,矫顽力几乎为零,因而呈现出超顺磁性。Fe3O4和BMO/Fe3O4(8%)、BMO/Fe3O4(10%)、BMO/Fe3O4(12%)样品的饱和磁化强度(σs)分别为77.8、21.1、28.2、35.1 emu/g,均显示出很强的铁磁性。Fe3O4包覆γ-Bi2MoO6后,其饱和磁化强度有所减少,原因是磁性Fe3O4所占比例降低以及包覆层阻碍磁化效应所致。磁性γ-Bi2MoO6/Fe3O4催化剂所具有的强铁磁性,使其在外磁场作用下很容易分离、回收和循环使用。
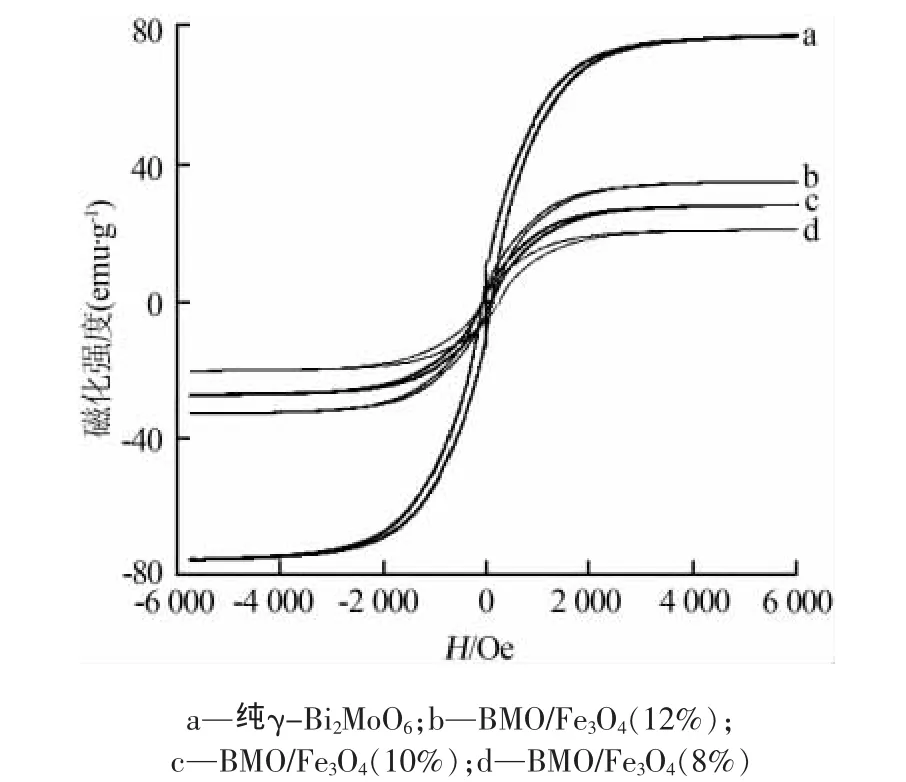
图4 不同样品的磁滞回线
2.2可见光催化活性
图5为不同样品对甲基橙的光催化效果。从图5可以看出,加入纯Fe3O4后,吸附和降解过程中,罗丹明B的浓度几乎没有变化,说明纯Fe3O4对罗丹明B既无吸附作用,又无光催化降解性能。纯γ-Bi2MoO6和磁性γ-Bi2MoO6/Fe3O4复合光催化剂,在最初1 h的暗环境下,罗丹明B浓度均先快速降低后变化趋于平缓,说明1 h以内,罗丹明B在光催化剂表面基本达到吸附-脱附平衡。但是,不同样品对罗丹明B的吸附量却随Fe3O4加入量的增加而减小。这可能是由于在γ-Bi2MoO6晶体生长过程中,加入的Fe3O4起到异相晶种的作用,诱导γ-Bi2MoO6在其表面生长,最终致使磁性γ-Bi2MoO6/Fe3O4复合材料颗粒较大,比表面积降低,吸附性能下降;在可见光照射后,各催化剂对罗丹明B均表现出良好的可见光催化性能,且降解率随Fe3O4加入量的增加而升高。在Fe3O4加入量(质量分数,下同)为10%时,3 h时降解率最大,达到93.76%;继续增加Fe3O4加入量至12%时,催化剂对罗丹明B的光催化降解效率反而下降,3 h时降解率仅为88.72%。这是因为虽然Fe3O4含量增加有利于增强催化剂的可见光吸收能力,但却降低了γ-Bi2MoO6的含量,致使光催化活性中心减少,影响降解率的提高[8]。因此,实验确定磁性γ-Bi2MoO6/Fe3O4复合光催化剂中Fe3O4的最佳加入量为10%。
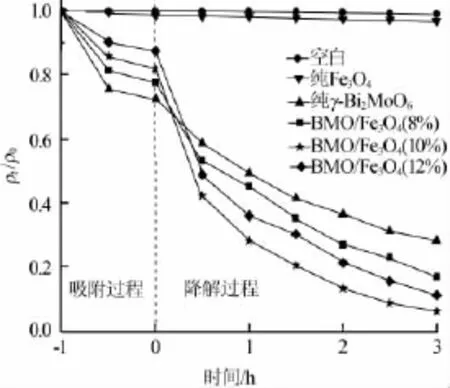
图5 不同样品对甲基橙的光催化效果
2.3回收率及重复使用情况
光催化降解实验结束后,利用钕铁硼永磁铁磁性分离收集所有的光催化剂,经水洗、无水乙醇洗涤、干燥后,称重计算磁性γ-Bi2MoO6/Fe3O4复合光催化剂的回收率,结果见表1。从表1可以看出,催化剂的磁分离回收效果很好,且回收率随Fe3O4加入量的增加而升高。为了考察磁性γ-Bi2MoO6/Fe3O4复合光催化剂的循环利用情况,选取对罗丹明B光催化效果最好的BMO/Fe3O4(10%)样品,在相同的光催化条件下进行重复降解实验。结果显示,该样品在重复使用3次时,对罗丹明B的降解率仍能达到85%,说明磁性γ-Bi2MoO6/Fe3O4复合光催化剂具有较好的催化稳定性。
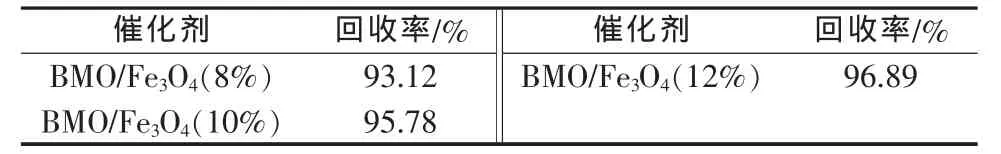
表1 不同样品的磁分离回收率
3 结论
1)利用共沉淀及微波溶剂热法,合成了具有核壳结构的磁性γ-Bi2MoO6/Fe3O4复合可见光催化剂。UV-Vis分析显示,磁性γ-Bi2MoO6/Fe3O4的核壳结构使γ-Bi2MoO6吸收带边红移,禁带宽度变窄,在可见光区的吸收增强。2)与纯γ-Bi2MoO6相比,磁性γ-Bi2MoO6/Fe3O4复合可见光催化剂的催化活性大幅提高,在Fe3O4加入量为10%(质量分数)时,光催化活性最好。3)制备的γ-Bi2MoO6/Fe3O4复合可见光催化剂具有很强的铁磁性,在外磁场作用下很容易实现磁分离、收集、回收,且具有较高的催化稳定性,重复循环使用效率高。
[1]Zhang Mingyi,Shao Changlu,Mu Jingbo,et al.Hierarchical heterostructures of Bi2MoO6on carbon nanofibers:Controllable solvothermal fabrication and enhanced visible photocatalytic properties[J]. J.Mater.Chem.,2012,22(2):577-584.
[2]Zhou Lin,Wang Wenzhong,Zhang Lisha.Ultrasonic-assisted synthesis of visible-light-induced Bi2MO6(M=W,Mo)photocatalysts[J].J.Mol.Catal.A:Chem.,2007,268(1/2):195-200.
[3]陈渊,杨家添,谢祖芳,等.乙二胺四乙酸辅助水热法制备钼酸铋及其可见光催化活性[J].硅酸盐学报,2014,42(1):80-88.
[4]He Qinghang,Zhang Zhenxi,Xiong Jianwen,et al.A novel biomaterial—Fe3O4:TiO2core-shell nano particle with magnetic performance and high visible light photocatalytic activity[J].Optical Mater.,2008,31(2):380-384.
[5]李燕,徐海燕,徐玲,等.ZnS/镍锌铁氧体磁性光催化剂的制备与光催化活性[J].人工晶体学报,2011,40(4):995-999.
[6]陈金媛,彭图治.磁性纳米TiO2/Fe3O4光催化复合材料的制备及性能[J].化学学报,2004,62(20):2093-2097.
[7]叶林静,关卫省,宋优男,等.磁性Fe3O4/ZnO核壳材料的制备及降解四环素类抗生素[J].应用化学,2013,30(9):1023-1029.
[8]刘坤杰,常志东,李文军,等.磁性BiVO4可见光催化材料的制备及光催化性能[J].无机化学学报,2011,27(8):1465-1470.
[9]Ghandoor H E,Zidan H M,Khalil M M H.Synthesis and some physical properties of magnetite(Fe3O4)nanoparticles[J].Int.J. Electrochem.Sci.,2012,7(6):5734-5745.
[10]Chanapa K,Rachel C,Sylvain C,et al.A comprehensive scenario of the crystal growth of γ-Bi2MoO6catalyst during hydrothermal synthesis[J].Cryst.Growth Des.,2012,12(12):5994-6003.
[11]左显维,费鹏,胡常林,等.磁性TiO2/CoFe2O4纳米复合光催化材料的制备[J].无机化学学报,2009,25(7):1233-1237.
[12]Maki H,Sato T,Ishibashi K.Direct observation of the deformation and the band gap change from an individual single-walled carbon nanotube under uniaxial strain[J].Nano.Lett.,2007,7(4):890-895.
——————
Preparation and photocatalytic properties of magnetic γ-Bi2MoO6/Fe3O4composite materials
Zuo Guangling,Ye Hongyong,Li Rulin
(School of Biochemical Engineering,Nanyang Institute of Technology,Nanyang 473004,China)
Magnetic γ-Bi2MoO6/Fe3O4composite materials with core-shell structure were successfully prepared by co-precipitation process and microwave solvothermal technique.The structure and properties of as-prepared samples were characterized by X-ray diffraction(XRD),transmission electron microscopy(TEM),UV-Vis diffuse reflectance spectra(UV-Vis),and vibrating sample magnetometer(VSM).Results showed that γ-Bi2MoO6/Fe3O4is of good paramagnetism,which makes it can be dispersed in aqueous solution easily.The core-shell structure with Fe3O4as the core and γ-Bi2MoO6as the shell can increase the visible-light absorption of γ-Bi2MoO6.The photocatalytic activities of samples were examined by monitoring the degradation of rhodamine B in an aqueous solution under solar light radiation.Results showed that the photocatalytic activity of magnetic γ-Bi2MoO6/Fe3O4composite photocatalysts was much better than that of pure γ-Bi2MoO6.The catalyst showed the highest photocatalytic activity when the mass fraction of Fe3O4was 10%,and the degradation of rhodamine B could still reach 85%after 3 cycles.
γ-Bi2MoO6;Fe3O4;magnetic property;visible-light catalytic degradation
TQ132.35
A
1006-4990(2015)11-0079-04
2015-05-10
左广玲(1979—),女,硕士,讲师,主要从事无机纳米功能材料研究,已公开发表文章10余篇。
河南省科技厅重点科技攻关项目(142102210026)。
联系方式:zuoguangling2009@163.com

