人多巴胺D2基因启动子区—350A/G多态位点荧光素酶表达载体的构建与鉴定及活性检测
段朝霞 张洁元 陈魁君等

[摘要] 目的 探讨人多巴胺D2(DRD2)基因启动子区-350 bp位点单核苷酸多态性(rs1799978)对DRD2基因转录活性的影响,为进一步揭示DRD2基因启动子区单核苷酸多态性的功能及其对创伤应激障碍综合征易患性的分子机制奠定基础。 方法 以人全血基因组DNA为模板,分别扩增DRD2基因启动子区-350 bp处分别为A或G的目的片段(-1000 bp~+168 bp),与经过改建的报告基因空载体pmirGlo-promoter相连接,构建启动子区-350 bp处分别为A和G的重组荧光素酶报告基因表达载体,并通过限制性内切酶双酶切及测序进行鉴定,然后将构建好并经过鉴定的表达载体pmirGlo-promoter-A和pmirGlo-promoter-G分别与pRL-CMV瞬时共转染人胚肾癌细胞株HEK293,48 h后检测细胞中荧光素酶的相对表达量。 结果 双酶切及测序结果证实,成功构建了重组荧光素酶表达载体pmirGlo-promoter-A和pmirGlo-promoter-G;荧光素酶活性检测结果显示,pmirGlo-promoter-G的荧光素酶基因表达量显著高于pmirGlo-promoter-A,差异有高度统计学意义(P < 0.01)。 结论 成功构建了pmirGlo-promoter-A/pmirGlo-promoter-G荧光素酶报告基因重组质粒,DRD2基因启动子区-350 bp为G时,基因转录活性较高,为A时,基因转录活性较低,说明rs1799978多态位点由A突变为G后,可能增强基因转录活性,该结果为进一步深入研究DRD2基因启动子区-350 bp单核苷酸多态性的生物学功能奠定了实验基础。
[关键词] 多巴胺受体D2;启动子区;单核苷酸多态性;荧光素酶活性
[中图分类号] R78 [文献标识码] A [文章编号] 1673-7210(2015)09(c)-0004-05
[Abstract] Objective To investigate the effects of single nucleotide polymorphism (SNP) in -350 bp (rs1799978) of Dopamine receptor D2 (DRD2) gene on transcription activity and analyze the mechanism of gene regulation. Methods The promoter region sequences of DRD2 gene A or G at site -350 bp (-1000 bp to +168 bp) were amplified using whole blood genomic DNA as template were inserted into the modified pmirGlo-promoter respectively. The recombinant vector and pmirGlo-Basic vector was co-transfected together with pRL-CMV vector containing renila luciferase reporter gene into primarily cultured HEK293. Firefly and Renila luciferase activities were analyzed 48 h later by use of Dual Luciferase reporter assay system. Results Restriction enzyme digestion and sequencing analysis confirmed the correct construction of recombinant expression vector pmirGlo-promoter-A/pmirGlo-promoter-G. The results of luciferase detection showed that the relative luciferase activity of pmirGlo-promoter-G was significantly higher than that of pmirGlo-promoter-A, the difference was statistically significant (P < 0.01). Conclusion Luciferase reporter vectors pmirGlo-promoter-A/pmirGlo-promoter-G containing two SNPs homozygotes in DRD2 gene promoter region -350 bp site are successfully constructed. The transcription activity of DRD2 gene is higher with G at site -350 bp, and lower with A at this site. And these results may be the basis to further study the effect on the susceptibility to post-traumatic stress disorder and SNP function of rs1799978.
[Key words] Dopamine receptor D2; Promoter region; Single nucleotide polymorphism; Luciferase activity
近年来,地震、台风、泥石流等自然灾害越来越常见,交通意外、各种局部战争和恐怖袭击也不断涌现,经历这些创伤性事件而引起的创伤应激障碍综合征(post-traumatic stress disorder,PTSD)也逐渐成为常见病和多发病[1]。研究发现,PTSD具有遗传易感性,但遗传机制不清。目前,随着分子生物学技术的发展、人类基因组计划的不断深入、各国脑科学计划的提出和实施,为揭示PTSD等多基因疾病的遗传易感性及其分子机制提供了可能。
多巴胺是人体内不可缺少的神经递质,在调节认知、记忆、运动及情绪等多种生物学功能中起着十分关键的作用,目前认为,多巴胺信号通路相关分子的基因改变与多种精神类疾病的遗传易感性相关。多巴胺受体D2(DRD2)是最常见的一种多巴胺受体,广泛分布于大脑的多个部位。研究证实,DRD2基因的多个多态性位点与PTSD、抑郁症、精神分裂症等精神类疾病的遗传易感性相关[2-6],是预测PTSD等精神类疾病遗传易感性的重要候选基因。本课题组前期通过生物信息学分析发现DRD2基因启动子区-350 bp位点的A/G多态性可能改变与转录因子SP1的结合能力,从而可能影响DRD2基因的转录;且通过Pubmed文献检索,目前尚无关于rs1799978多态位点对PTSD遗传易感性及其生物学功能研究的相关报道。基于此,本研究通过定基因工程技术分别构建含-350 bp G/A多态位点的启动子区荧光素酶表达载体,并探索该多态性位点对DRD2基因转录活性的影响,为后续研究该多态性位点与PTSD易患性的临床相关性及相应的分子机制提供依据。
1 材料与方法
1.1 实验试剂
经过改造的pmirGlo-promoter质粒(以pmirGlo为母本载体,去掉5094~5609 bp段Human phosphoglycerate kinase promoter,引入源自pAdTrack-CMV的多克隆酶切位点,改造后的pmirGlo-promoter质粒具有Bgl Ⅱ、Sal Ⅰ、Xho Ⅰ、Xba Ⅰ 4个单克隆酶切位点可用),由重庆金麦生物有限公司单佑安博士赠予;海肾荧光素酶表达质粒pRL-SV40和双荧光素酶报告基因试剂盒为Promega公司产品;质粒提取试剂盒、全血基因组DNA提取试剂盒为北京天根生物技术有限公司产品;高保真DNA聚合酶、胶回收试剂盒、T4 DNA连接酶购于Takara公司(大连);限制性内切酶Bgl Ⅱ、XhoⅠ购自NEB公司;脂质体Lipofectine 2000TM为Invitrogen公司产品;DMEM、胎牛血清等细胞培养试剂购自Gibco;细胞系HEK293由本实验室保存;感受态细胞E.coli DH5α由本科室自行保存;本试验设计的所有PCR引物均由上海生物工程有限公司合成;PCR产物和质粒测序均由Takara公司(大连)完成。
1.2 方法
1.2.1 荧光素酶报告基因重组表达载体的构建及鉴定 提取人全血基因组DNA,然后经核酸定量仪定量并调整浓度至50 ng/μL,分装后置于-70℃冻存备用。根据人DRD2基因组序列NC-000011.9设计并合成4条扩增DRD2启动子区序列及-350 bp位点突变的引物。rs1799978-1:5'-GAAGATCTGGGCCTGGTTTTCT TTCTGTGTGTG-3',下划线为上游加的Bgl Ⅱ酶切位点及保护碱基;rs1799978-2:5'-CCGCTCGAGCCGG CTGCTTGAGGCTTCC-3',下划线为下游加的Xho Ⅰ酶切位点及保护碱基;rs1799978-M1:5'-CACCCAGA GTAACAAGCTGTGATTGCAG-3';带下划线的碱基为 -350 bp处;rs1799978-M2:5'-CTGCAATCACAGCTTGTTACTCTGGGTG-3',带下划线的碱基为-350 bp处。首先以提取的基因组DNA为模板,用rs1799978-1与rs1799978-2为上下游引物,经PCR反应扩增,25 μL反应体系,扩增程序为:98℃退火5 min,98℃ 30 s,57℃ 30 s,72℃ 1 min 30 s,35个循环,最后72℃延伸10 min。DRD2基因启动子区序列(-1000~+168 bp),然后将PCR扩增片段经1.5%的凝胶电泳,如果扩增片段在1100 bp左右则用胶回收试剂盒回收目的片段,然后用T4 DNA连接酶将回收的目的片段连入至PTA2载体中,送Takara生物技术有限公司测序鉴定PCR扩增片段的序列是否正确。如果PCR扩增的目的片段序列与GenBank上DRD2基因序列一致,则用限制性内切酶Bgl Ⅱ及Xho Ⅰ双酶切PTA2-rs1799978,并将酶切回收的目的片段经T4DNA连接酶连入同样经Bgl Ⅱ及Xho Ⅰ双酶切回收pmirGlo-promoter空载体中,再将连接产物转化入感受态DH5α中,挑取阳性克隆震荡培养过夜、提取重组质粒,然后用Bgl Ⅱ及Xho Ⅰ双酶切鉴定重组质粒pmirGlo-promoter-A构建是否成功。含突变位点的目的片段扩增则以PTA2-rs1799978质粒为模板,以rs1799978-1和rs1799978-M1为上下游引物进行PCR反应,扩增663 bp(-1000~ -338 bp);以rs1799978-2和rs1799978-M2为上下游引物进行PCR反应,扩增533 bp(-365~+168 bp);然后再以这两次的PCR产物的混合物为模板,以rs1799978-1和rs1799978-2为上下游引物,进行融合PCR反应,扩增出-350 bp位点突变为G的目的片段(-1000 bp到+168、-350 bp位点处为G),然后将融合PCR反应扩增出的目的片段经凝胶电泳及胶回收处理后连入至PTA2载体中,送Takara公司测序鉴定-350 bp处的序列突变是否成功。然后重复pmirGlo-promoter-A载体构建及鉴定的步骤,最终得到定点突变的重组质粒pmirGlo-promoter-G。
1.2.2 重组荧光素酶表达载体的转染 用常规细胞培养试剂复苏、培养HEK293细胞,经过几次细胞传代,待细胞处于对数生长期时将细胞传入48孔板,置于37℃、5%CO2孵育箱中继续培养,当细胞融合度为80%左右时,按照Lipofectine 2000TM脂质体转染试剂盒说明书,将海肾荧光素酶报告基因质粒pRL-SV40与重组质粒pmirGlo-promoter-A和pmirGlo-promoter-G分别共转染至HEK293细胞,设3个重复孔,转然后 48 h后收集细胞,立即采用双荧光素酶报告基因系统检测荧光强度(相对荧光素酶活性)。
1.2.3 双荧光素酶报告基因检测系统检测荧光素酶活性 从细胞培养箱中取出培养48 h的48孔板,弃去培养基,每孔细胞先用PBS洗2次,然后每孔加入200 μL细胞裂解液(passive lysis buffer,PLB),室温放置于水平摇床上用120 r/min、摇15 min以使细胞充分裂解。收集细胞裂解液,同时用移液器上下吹打数次以充分混匀细胞裂解液,将细胞裂解液转移至1.5 mL EP管中,冰浴放置10 min。4℃ 15 000 r/min离心5 min以去除细胞碎片,将上清即细胞裂解液再移至一新的1.5 mL EP管中,置于冰上备用。严格按照双荧光报告系统检测试剂盒说明书在化学发光仪上检测Firefly和Renilla的荧光强度,最后以二者比值(F/R)为校正后的结果,每个样品重复检测3次,取其平均值。
1.3 统计学方法
采用统计软件SPSS 17.0对数据进行分析,正态分布计量资料以均数±标准差(x±s)表示,用单因素 ANOVA分析。以P < 0.05为差异有统计学意义。
2 结果
2.1 DRD2基因-350 bp多态位点的启动子区荧光素酶报告基因表达载体的构建及鉴定
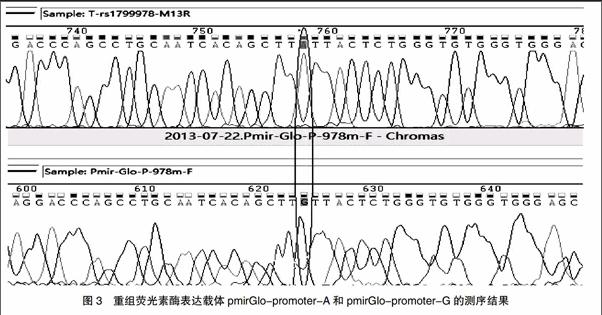
以人全血基因组DNA为模板,rs1799978-1与rs1799978-2为上下游引物进行PCR反应扩增,取扩增产物进行1.5%琼脂糖凝胶电泳。电泳结束后,将凝胶放于凝胶扫描仪中观察,可见泳道1中对应1000 bp的条带上面有一条非常明显的DNA条带,与预期的1168 bp大小相符,说明该条带可能为所需的目的片段(图1A)。将该片段通过T4连接酶连入到PTA2测序载体中,经测序鉴定后证实该片段序列与GeneBank上DRD2基因序列一致(图3)。然后分别以rs1799978-1和rs1799978-M1、rs1799978-2和rs1799978-M2、rs1799978-1和rs1799978-2为上下游引物进行PCR和融合PCR,分别扩增出663、533、1168 bp的目的条带(图1B、C)。将经胶回收和内切酶Bgl Ⅱ和Xho Ⅰ双酶切后的含rs1799978 A和rs1799978 G的PCR产物与报告基因空载体pmirGlo-promoter用T4连接酶连接,然后经转化、克隆及双酶切鉴定(图2)、测序(图3)等步骤证实重组荧光素酶报告基因载体pmirGlo-promoter-A和pmirGlo-promoter-G构建成功。
2.2 荧光素酶报告基因转录活性的测定
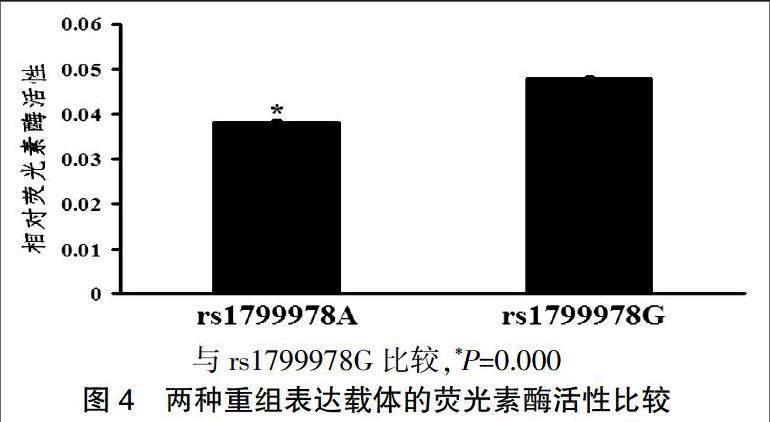
将重组荧光素酶表达载体pmirGlo-Promoter-A和pmirGlo-promoter-G及pRL-SV40共转染HEK293细胞,48 h后收集细胞,裂解后在化学发光仪进行荧光素酶活性检测,以F/R比值作为结果。结果显示,转染pmirGlo-promoter-G质粒的细胞裂解液的相对荧光素酶活性活性显著高于转染pmirGlo-promoter-A质粒的细胞裂解液[(0.0480±0.0004)比(0.0380±0.0005),P = 0.000]。见图4。
3 讨论
PTSD是指个体由于经历各种突发性、威胁性或灾难性事件而出现并长期持续存在的一类精神障碍,其主要表现为患者极度恐惧、害怕、无助感,且持续时间超过1个月,给患者、家庭、甚至整个社会都带来重大的影响。目前,通过家系调查、双生子研究、实验动物模型等多种方法研究证实,PTSD具有遗传易患性,也通过大量的临床关联研究,筛选出了不同种系人群中,可能与PTSD易患性相关的候选基因及其多态性位点,主要是神经递质及其代谢相关的基因,如5-羟色胺转运体、5-羟色胺受体、多巴胺受体等。
DRD2是脑内主要神经递质多巴胺信号通路的重要成员,DRD2基因位于11号染色体上,长度65.8 kb,由8个外显子与7个内含子组成,编码含415个氨基酸残基的蛋白质,属于G蛋白偶联受体家族[7]。目前临床上所用的多种抗精神类药物都属于DRD2拮抗剂类,说明DRD2在多种精神疾病的发生发展过程中有非常重要的作用。大量的研究结果证实,PTSD的遗传易感性与DRD2基因多态性有关。研究最多、最早发现的基因多态性是3'端非翻译区中的 Taq限制性片段长度多态性(rs1800497)。Comings等[8]研究后发现DRD2 Taq1A1多态性位点与PTSD的发生具有临床相关性。另一个经常报道的多态性位点是位于启动子区-141位点的胞嘧啶的缺失/插入突变(-141C del/ins)基因多态性(rs1799732)。研究发现,该多态性位点可使DRD2蛋白表达水平下降[9];且-141C插入突变频率在日本及北欧人群中的PTSD患者较高,但在英国PTSD患者及对照组中却无显著性差异[10],这种互相矛盾的结果可能是由于人群的种族不同所致,另外PTSD患者选择方法以及对照人群不同等都可能出现有争议的结果。位于DRD2基因编码区第7外显子的两种同义突变 His313及Pro319多态性也常见报道。研究发现,编码Pro319基因的单核苷酶多态时可降低mRNA的稳定性而导致其后续的翻译效率下降,并证实该多态性位点影响PTSD的遗传易感性[11];此外,最新研究显示,DRD2基因957C/T的多态性与PTSD相关[12]。目前,虽然证实了DRD2受体的多个多态性位点与包括PTSD在内的精神类疾病的遗传易感性有关,但其具体的分子机制还不是特别清楚,可能与多态性位点改变了DRD2基因的mRNA稳定性、蛋白合成,受体密度及其与多巴胺的结合能力等,从而对疾病的易感性改变。
真核生物基因表达受体内的调控元件精细调控。基因表达调控决定着真核生物的细胞分化、生长和发育的全过程,根据基因表达调控发生的先后顺序,可将其分为转录水平调控、转录后水平的调控、翻译水平的调控以及蛋白质加工水平的调控。随着测序技术的日益发展,越来越多的基因表达调控元件被发现。真核生物的基因转录受到启动子及增强子等多个因素的调控。启动子区的多态位点由于它可以通过改变启动子区与不同转录因子的结合能力,改变基因的转录和蛋白表达[13],而影响对疾病的遗传易感性。双荧光素酶报告基因系统是将萤火虫荧光素酶和海洋肠腔荧光素酶在同一管中完成检测,通常一个报告基因作为内对照,使另外一个报告基因的检测均一化。检测基因表达时,将偶联有调控启动子的有实验报告基因基因的载体与内参载体共同瞬时转染,这样报告基因表达活力的相对改变与偶联调控启动子转录活性的改变相关,以快速、灵敏、简便、稳定地测出转录活性;且双荧光素酶表达载体转染细胞后可在荧光显微镜下直接观察转染是否成功,具有直观性。因而是目前基因表达调控研究中最常用的一种分子生物学工具,通过测定两种荧光素酶的相对转录活性,直接推测出该DNA片段在基因表达调控中的作用[14-16]。本研究采用常规PCR及定点突变的融合PCR法从人全血基因组DNA中扩增出了1168 bp的-350 bp处分别含A和G的DRD2基因启动子序列,并将其分别克隆到pmirGlo-promoter空载体的多克隆位点中(见实验试剂),成功构建了-350 bp处分别含A和G多态位点的pmirGlo-promoter-G和pmirGlo-promoter-A重组荧光素酶表达载体,并用双荧光素酶报告基因系统证实,DRD2基因-350 bp处由A突变为G后,可以显著增强荧光素酶基因的转录活性。
[参考文献]
[1] Zoladz PR,Diamond DM. Current status on behavioral and biological markers of PTSD: a search for clarity in a conflicting literature [J]. Neurosci Biobehav Rev,2013,37(5):860-895.
[2] Hemmings SM,Li M,Marisa K. BDNF Val66Met and DRD2 Taq1A polymorphisms interact to influence PTSD symptom severity: a preliminary investigation in a South African population [J]. Progress in Neuro-Psychopharmacology & Biological Psychiatry,2013,40(2):273-280.
[3] Vasconcelos AC,Neto Ede S,Pinto GR,et al. Association study of the SLC6A3 VNTR (DAT) and DRD2/ANKK1 Taq1A polymorphisms with alcohol dependence in a population from northeastern Brazil [J]. Alcohol Clin Exp Res,2015,39(2):205-211.
[4] Kang SG,Na KS,Lee HJ,et al. DRD2 genotypic and haplotype variation is associated with improvements in negative symptoms after 6 weeks' amisulpride treatment [J]. J Clin Psychopharmacol,2015,35(2):158-162.
[5] Yao J,Wang B. Response to “DRD2 Ser311Cys Polymorphism and risk of schizophrenia”[J]. Am J Med Genet Part B,2015(3):223.
[6] Pan YQ,Qiao L,Xue XD,et al. Association between ANKK1 (rs1800497) polymorphism of DRD2 gene and attention de?cit hyperactivity disorder:a meta-analysis [J]. Neuroscience Letters,2015,590 (1):101-105.
[7] 张国炳,陈峻严.脑内多巴胺受体的分布和功能[J].中国校医,2013,27(1):38-40.
[8] Comings DE,Muhleman D,Gysin R. Dopamine D2 receptor (DRD2) gene and susceptibility to posttraumatic stress disorder:a study and replication [J]. Biol. Psychiatry,1996, 40(5):368-372.
[9] Duan J,Wainwright MS,Comeron JM,et al. Synonymous mutations in the human dopamine receptor D2 (DRD2) affect mRNA stability and synthesis of the receptor [J]. Hum Mol Genet,2003,12(3):205-216.
[10] Jonsson EG,Nothen MM,Grunhage F,et al. Polymorphisms in the dopamine D2 receptor gene and their relationships to striatal dopamine receptor density of healthy volunteers [J]. Mol Psychiatry,1999,4(2):290-296.
[11] Hirvonen MM,Laakso A,Nagren K,et al. C957T polymorphism of dopamine D2 receptor gene affects striatal DRD2 in vivo availability by changing the receptor affinity [J]. Synapse,2009,63(4):907-912.
[12] Ritchie T,Noble EP. Association of seven polymorphisms of the D2 dopamine receptor gene with brain receptor-binding characteristics [J]. Neurochem Res,2003,28(1):73-82.
[13] Pereira C,Sousa H,Silva J,et al. The -1195G allele increases the transcriptional activity of cyclooxygenase-2 gene (COX-2) in colon cancer cell lines [J]. Molecular Carcinogenesis,2014,53(1):E92-E95.
[14] Léjard V,Rebours E,Meersseman C,et al. Construction and validation of a novel dual reporter vector for studying mammalian bidirectional promoters [J]. Plasmid,2014,74(1):1-8.
[15] 庞立丽,邵长胜,段招军.人干扰素λ1基因启动子荧光素酶报告基因质粒的构建及其转录活性分析[J].中国生物制品学杂志,2014,27(6):752-755.
[16] 吴胜昔,陈永文,朱广倍,等.B7-H1启动子荧光素酶报告基因载体的构建及活性检测[J].基础医学与临床,2014, 34(7):955-959.
(收稿日期:2015-06-23 本文编辑:苏 畅)

