全身广泛骨转移为首发症状的甲状腺微小乳头状癌1例
季艳会,谭 建,张桂芝,郑 薇,王任飞
(天津医科大学总医院核医学科,天津 300052)
1 病例资料
患者,女,59岁,既往有甲状腺多发结节病史1年余,TI-RADS 1~2级。2011年9月出现腰部及骨盆区疼痛,行全身PET/CT显像检查示全身骨骼多发异常放射性浓聚灶,累及枕骨、颈、胸、腰椎多处椎体,骨盆、胸骨、肩胛骨、肋骨多处和左侧股骨等,考虑为骨转移;双侧甲状腺体积增大,右叶可见多发局灶性放射性浓聚,高度可疑恶性(图1)。10 d后行耻骨病灶切除术,术后病理诊断:恶性肿瘤,考虑转移癌可能性大(图2),并给予TP方案化疗(多西他赛+卡铂)及帕米膦酸钠治疗1周期。患者甲状腺彩超检查结节分级较好,因此未考虑转移癌来源于甲状腺,故未行甲状腺手术。此后1年先后行TP方案化疗6周期,同时给予帕米膦酸二钠治疗骨转移。左侧股骨头、髋臼、胸骨、第5、11、12胸椎及第1和4腰椎等骨转移灶行三维适形放疗(PTV 30Gy/10 f累计45次),辅以唑来磷酸,芬太尼透皮贴止痛等治疗。2013年1月复查PET/CT示全身骨骼病灶部位浓聚程度较前增高,部分骨质破坏较前明显,双肺多发结节,放射性浓聚,考虑转移;双侧甲状腺体积增大,PET显像可见多发局灶性放射性浓聚,高度可疑恶性,建议活检(图3)。患者遂于全麻下行全甲状腺切除术,术后组织学诊断:(左)甲状腺微小乳头状癌,癌灶直径0.6 cm(图4),侵出腺叶,(右)结节性甲状腺肿,伴不典型增生结节。术后3 d加用左甲状腺素钠25~50μg/d,同时给予硫酸吗啡口服止痛治疗。患者于2013年3月30日跌倒后尾骨部位疼痛,开始卧床,活动受限,1月后自觉右肩背部、右上肢疼痛较前明显加重,伴右手指、双下肢麻木。患者于2013年4月16日主因多发骨痛1年余,加重1月,来我科行大剂量131I治疗,入院前已遵医嘱停用左甲状腺素钠2个月。体格检查:患者强迫卧位,不能自主配合查体。颈前可见长约8 cm术后瘢痕,伤口愈合良好。甲状腺未触及,双侧颈部未触及肿大淋巴结。实验室检查:甲状腺球蛋白(Tg)>300.00(0~55)ng/mL,ATG<20(0~40)IU/mL。TRAb 1.09(0~1.5)IU/L。游离甲状腺功能检测:FT35.45(3.5 ~6.5)pmoL/L,FT44.91(11.5 ~23.5)pmoL/L,TSH 3.757(0.3~5.0)μIU/mL。肝肾功能及血常规正常。甲状腺彩超示符合甲状腺术后改变。入院诊断“(左)甲状腺微小乳头状癌术后(…c期);全身多发骨转移;肺转移癌?”,给予131I3 700MBq口服治疗,同时给予糖皮质激素预防放射性炎症及吗啡缓释片止痛治疗,3 d后加用左甲状腺素钠25μg/d。于131I治疗后第6天行131I全身显像示颈部可见残留甲状腺组织显影,全身骨骼及双肺多发异常示踪剂浓集区,考虑功能性转移癌(图 5)。出院诊断:(1)(左)甲状腺微小乳头状癌术后(…c期);(2)全身多发性骨转移癌;(3)肺转移癌。患者出院后继续口服左甲状腺素钠替代、抑制治疗及吗啡缓释片止痛。出院后 1 月复查:Tg>300 ng/mL,TgAb<20.0 IU/mL,FT34.97 pmol/L,FT413.40 pmol/L,TSH 17.089 μIU/mL。WBC 1.72×109/L,N 62.1%,RBC 1.88×1012/L,HGB 58 g/L,PLT 19×109/L,患者就诊于天津市肿瘤医院,给予升血等对症治疗,但于131I治疗后3月因多脏器感染、衰竭死亡。
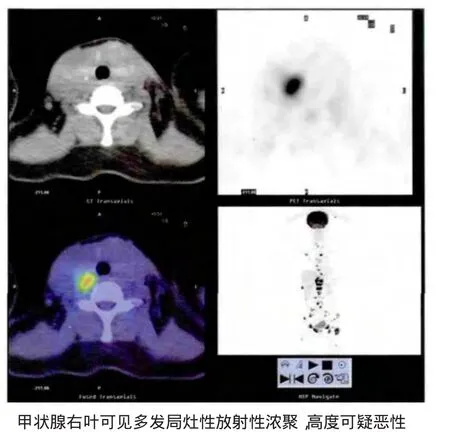
图1 患者首次PET/CT显像

图2 患者耻骨病理图(×40)

图3 患者第2次PET/CT图

图4 患者甲状腺切除术中左叶结节HE染色(×40)

图5 患者第1次治疗剂量131 I全身扫描
2 讨论
甲状腺微小乳头状癌(papillary thyroidmicrocarcinoma,PTMC)[1]很少发生远处转移[2]。文献报道常规尸检的甲状腺隐匿性或微小癌检出率为3%~36%,说明PTMC的发生率较高而生物学行为相对良好[3],部分学者认为PTMC处于亚临床状态,很少发展成为显性癌,有些患者甚至终身无症状。因此,对于无转移、无症状的微小癌可不给予任何治疗,只需长期随诊[4]。Shi等[5]大量文献报道PTC术后预后大多较好,153例PTMC患者只有1例发生远处转移。国外文献报道分化型甲状腺癌骨转移灶有无并无明显影响患者的生存率[6],许艳红等[7]研究示以骨转移为首发症状的DTC患者5年和10年生存率分别为93.0%和71.0%。本患者以全身多发骨痛为首发症状,术后病理示PTMC,在临床上极为少见。
本患者多次检验Tg均明显高于正常,虽提示转移灶可能与甲状腺关系密切,但多次甲状腺彩超检查符合腺瘤样甲状腺肿声像图表现。两次PET/CT检查示右叶甲状腺可见多发局灶性放射性浓聚,高度可疑恶性,而术后病理回报左叶微小乳头状癌,右叶结节性甲状腺肿,18F-FDGPET/CT显像能够反映甲状腺结节摄取和代谢葡萄糖的状态,并非所有的甲状腺恶性结节都能在PET显像中表现为阳性,而某些良性结节也会摄取18F-FDG[8],因此单纯依靠PET/CT显像不能准确鉴别甲状腺结节的良恶性。这与《甲状腺结节及分化型甲状腺癌诊治指南》(以下简称指南)建议相符,PET在诊断甲状腺癌方面没有特异性,不作为首选检查。
通过多例甲状腺结节合并Tg明显升高患者的随访,得到临床提示:第一、PTC确诊前检验Tg水平明显高于正常者,特别是Tg高于100 ng/mL且未合并其他影响Tg的甲状腺疾病,对于判断结节良恶性仍具有一定的指导意义,应提高对甲状腺结节患者术前血清Tg水平的重视,密切随诊结节变化及Tg水平。第二、对于TI-RADS分级较高和(或)合并Tg水平明显升高的结节,应密切关注结节变化,影像学检查首选甲状腺彩超[9],也可行细针穿刺以确定结节性质,决定治疗方案。第三、患者病理示PTMC,术后半年死亡,说明PTMC也具有早期远处转移的可能,提示对于PTMC也应该提高临床警惕性,PTMC具有进一步发展的可能性,对于PTMC的患者应进行危险度评估,视情况行131I治疗[10]。本患者治疗过程中也存在一定的缺陷和失误:(1)全身骨转移患者的骨组织病理学检查示“恶性肿瘤,转移癌可能性大”,但未做进一步免疫组化检查寻找原发灶,并且对PET/CT显像高度可疑恶性”应进一步做细针穿刺。(2)患者外院行甲状腺切除术,术后病理提示“左甲状腺微小乳头状癌,癌灶直径0.6 cm,侵出腺叶”,对该患者的病理标本应进一步做免疫组化及肿瘤基因检测分型更进一步明确病理分型。(3)患者PET检查提示甲状腺甲状腺右叶可见多发局灶性放射性浓聚,即使B超检查不支持甲状腺癌,但患者多发骨转移灶来源不明时,也应行甲状腺穿刺细胞学检查排除诊断。
[1]Zheng X,Wei S,Han Y,etal.Papillary microcarcinoma of the thyroid:clinical characteristicsand BRAF(V600E)mutationalstatus of977 cases[J].Ann SurgOncol,2013,20(7):2266
[2]Jacqut—Laperriere S,Timoskenko A P,Dumollard J M,et a1.Papillaly thyroid rnicrocarcinoma:incidence and prognostic factors[J].Eur Arch Otorhinolaryngol,2007,264(8):935
[3]邵燕,蔡秀军,高力,等.甲状腺微小乳头状癌中央区淋巴结转移及临床因素分析[J].中华医学杂志,2009,89(6):403
[4]Ito Y,Uruno T,Takamura Y,etal.An observation trial without surgical treatment in patientswith papillarymicrocarcinoma of the thyroid[J].Thyroid,2003,13(4):381
[5]Shi L,Chen JH,Wang S T,etal.Treatment for papillary thyroid microcarcinoma[J].Contemp Oncol(Pozn),2013,17(1):20
[6]Pittas A G,Adler M,FazzariM,etal.Bonemetastases from thyroid carcinoma:clinical characteristics and prognostic variables in one hundred forty-six patients[J].Thyroid,2000,10(3):261
[7]许艳红,宋红俊,邱忠领,等.以骨转移为首发症状的分化型甲状腺癌的临床特征与生存分析[J].肿瘤,2011,31(6):538
[8]关志伟,徐白萱,陈英茂,等.大规模人群FDG-PET/CT意外发现甲状腺高代谢结节的回顾性分析[J].中华核医学与分子影像杂志,2012,32(1):32
[9]Mikosch P,Gallowitsch H J,Kresnik E,etal.Value of ultrasoundguided fine-needle aspiration biopsy of thyroid nodules in an endemic goitrearea[J].Eur JNuclMed,2000,27(1):62
[10]Wu LS,Milan SA.Managementofmicrocarcinomas(papillary and medullary)of the thyroid[J].CurrOpin Oncol,2013,25(1):27

