候选抑癌基因RASSF6在胃癌组织中的表达及其与临床病理特征的关系
刘新兰,李淑璟,张海霞
(1.宁夏医科大学总医院肿瘤医院肿瘤内科,银川 750004;2.宁夏医科大学研究生院,银川 750004)
肿瘤的形成是多基因病变的过程,其发生发展与抑制细胞突变和异常增殖的抑癌基因功能失活密切相关。RASSF6近年来在多种肿瘤中被发现和证实是潜在的抑癌基因,但在胃癌中罕见报道。本研究应用组织微阵列通过免疫组化SP法、实时荧光定量RT-PCR和Western blot法检测候选抑癌基因RASSF6在胃癌组织中的表达情况,分析它们与胃癌临床病理特征的关系,探讨RASSF6是否为胃癌的抑癌基因。
1 资料与方法
1.1 标本来源及处理 选取在宁夏医科大学总医院手术并经病理证实的胃癌及癌旁正常组织标本各100例,其中80份为2010年1月-2013年3月的胃癌及癌旁正常组织石蜡标本,20份为2013年4月-6月新鲜胃癌及癌旁正常组织标本,新鲜标本以无菌手术器械剪取癌组织和距癌灶5 cm的癌旁组织,所有标本切取后分为2份,一份放入经0.1%DEPC(焦磷酸酯)水处理过的冻存管内,置-80℃冰箱冻存;另一份经10%中性福尔马林溶液固定常规石蜡包埋、切片。所有患者术前未接受任何放、化疗等抗肿瘤治疗。男性67例,女性33例;年龄:<60岁35例,≥60岁65例;肿瘤大小:<3 cm的38例,≥3 cm的62例;汉族61例,少数民族39例;分化程度:高分化19例,中分化24例,低分化57例;浸润深度:黏膜及黏膜下22例,肌层23例,浆膜及浆膜外55例;有淋巴结转移者53例,无淋巴结转移者47例;TNM分期按照2010年国际抗癌联盟(UICC)公布的标准:…期32例,…期14例,Ⅲ期46例,…期8例。
1.2 组织微阵列技术免疫组化SP法 兔抗人RASSF6多克隆抗体1∶200稀释,购自美国Abcam公司,DAB等试剂盒均购自北京中杉金桥生物技术有限公司,制备孔径为3mm的含有52个组织芯的组织芯片,连续制成4μm厚切片若干张,进行SP法免疫组化染色。每例标本选4张切片,1张用于HE染色,其余3张用于IHC染色,实验步骤按试剂盒说明书进行,严格控制实验条件。用已知阳性的肝癌组织切片作为阳性对照,PBS作为阴性对照。结果依照Fromowitz综合计分法,将细胞着色强度与阳性着色细胞所占百分比二者结合判定,细胞着色强度:不着色计0分;淡黄色计1分;棕黄色计2分;棕褐色计3分。二者积分相加:0~1分为阴性,≥2分为阳性。阳性细胞百分数为10个视野阳性细胞的平均数占这10个视野中细胞数的百分比:<5%计0分;5%~25%计1分;26%~50%计 2分;51%~75%计3分;>75%计4分。
1.3 实时荧光定量RT-PCR 提取新鲜胃癌组织及对应癌旁正常组织的总RNA,并逆转录为cDNA后扩增和分析。采用β-actin为内参照,RASSF6和β-actin RNA引物序列由上海生物工程有限公司设计合成,RASSF6上、下游引物分别为:5c-AGCTGCCAGTTCTTGGAATG-3c、5c-AGGCCAGAC AGCTCTGATGT-3c;β-actin上、下游引物分别为:5c-CCACGGCTGCTTCCAGCTCC-3c,5c-GGACTCC ATGCCCAGGAAGGAA-3c。反应条件为25μL的反应体系,94℃预变性 3min,94℃变性30 s,58℃退火30 s,72℃延伸1min,35个循环,最后72℃延伸5min,至4℃终止。实验数据用2-△△Ct进行处理。
1.4 Western blot液氮中取出组织后裂解液裂解,同时加蛋白酶及磷酸酶抑制剂,BCA法测蛋白浓度,100℃5min变性蛋白,10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转PVDF膜25V30min,以含5%脱脂奶粉的TBS-T室温封闭1 h,加RASSF6一抗(1∶500)、内参照 GAPDH 一抗(1∶1 000),4 ℃过夜;二抗(1∶5 000)室温 1 h,显影后凝胶成像系统扫描,并用图像分析软件进行定量分析。
1.5 统计学方法 应用SPSS13.0统计软件处理数据。计数资料采用χ2检验,计量资料以x±s表示,采用t检验,Spearman相关分析,以P<0.05为差异有统计学意义。
2 结果
2.1 组织微阵列技术免疫组化SP法
2.1.1 RASSF6的表达与胃癌临床病理特征的关系
胃癌组织中RASSF6的表达在分化程度、浸润深度、淋巴结转移及胃癌临床分期差异均有统计学意义(P<0.05),见表 1。
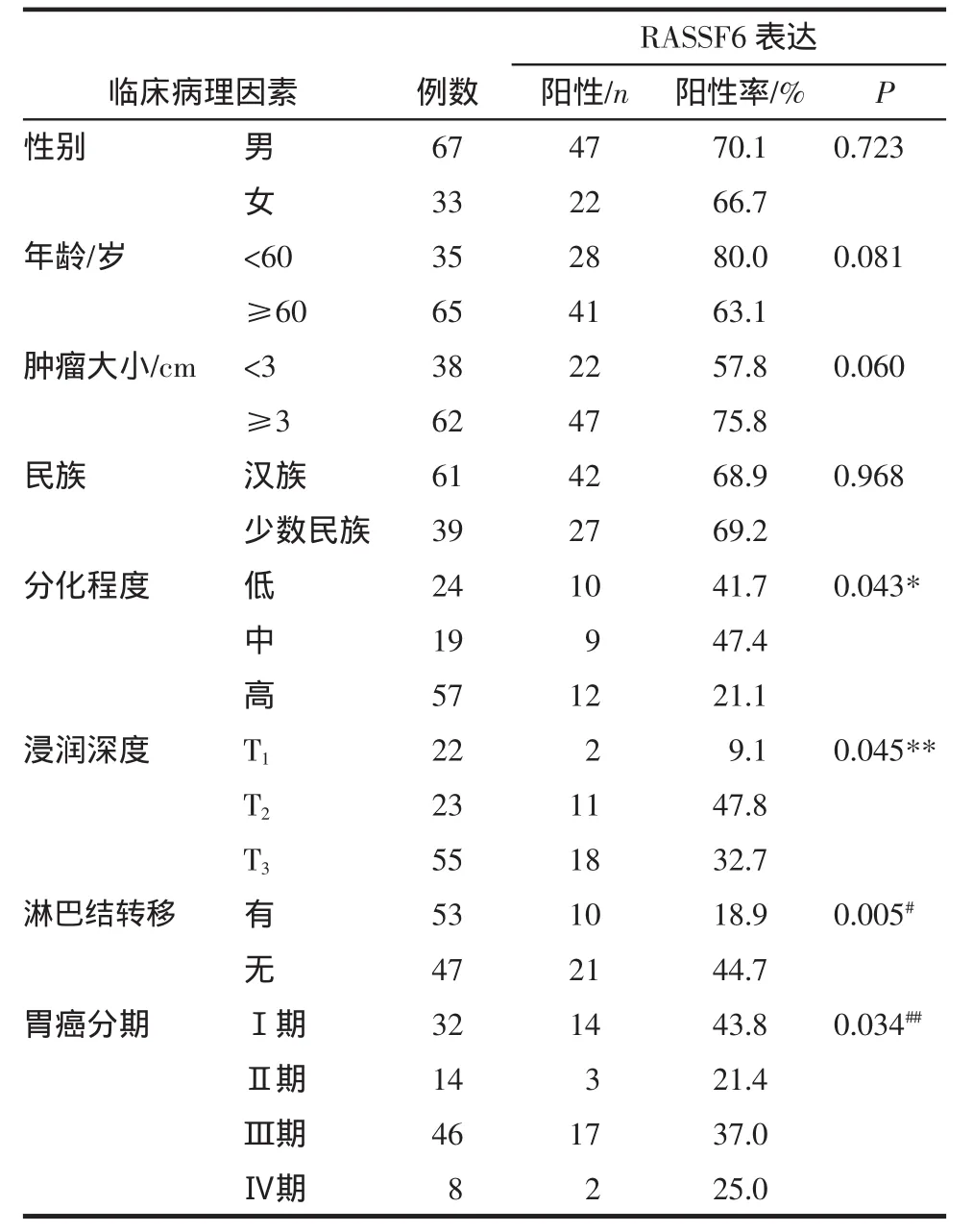
表1 RASSF6的表达与胃癌临床病理特征的关系Tab1 Expressionsof RASSF6 in gastric cancer and itsassociation with clinicopathologic feature
2.1.2 胃癌组织及癌旁正常胃黏膜组织中RASSF6的表达 RASSF6阳性染色主要定位于胃癌细胞的细胞浆和细胞核,呈深棕色颗粒状(图1),100例胃癌组织中RASSF6阳性表达率为31.0%,明显低于癌旁正常胃黏膜组织中的阳性表达率76.0%,差异有统计学意义(P<0.05),见图2。
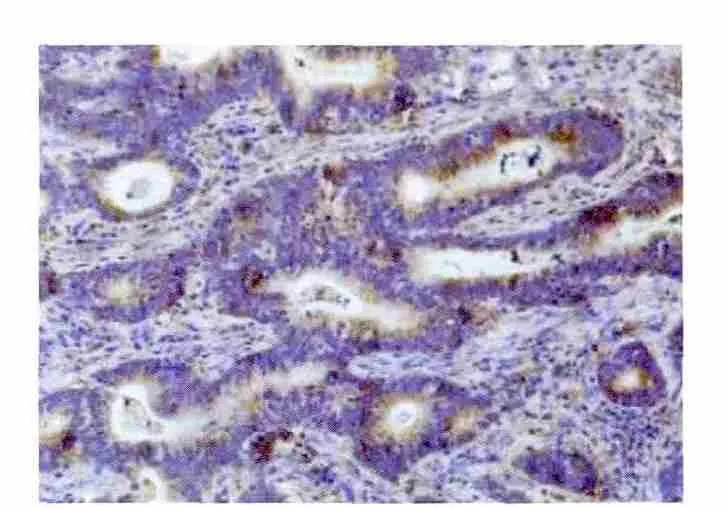
图1 胃癌组织中RASSF6的表达(SP×200)Fig 1 Expressionsof RASSF6 in gastric cancer(SP×200)
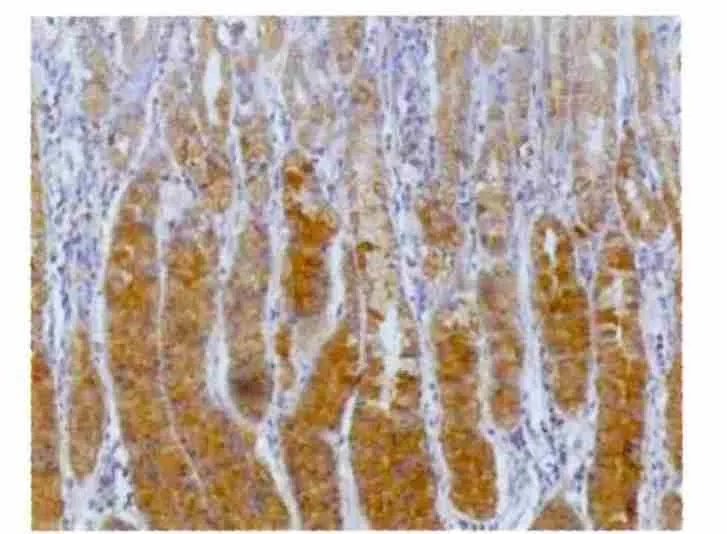
图2 正常胃黏膜中RASSF6的表达(SP×200)Fig 2 Expressionsof RASSF6 in adjacentnorm al tissues(SP×200)
2.2 实时荧光定量RT-PCR法 20例胃癌组织中RASSF6mRNA的表达量明显低于癌旁正常组织,差异有统计学意义(P<0.05),见表2。
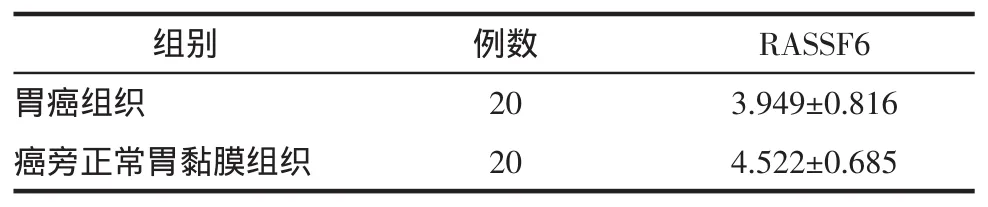
表2 RASSF6mRNA在胃癌组织和癌旁正常组织中的表达Tab 2 Expressionsof RASSF6mRNA levels in thegastric cancers and theadjacentnorm al tissues
2.3 Western blot法 20例胃癌组织中RASSF6蛋白的表达量为1.589±2.237,明显低于癌旁正常胃组织中的表达5.723±1.939,差异有统计学意义(P<0.05),见图 3、图 4。

图3 GAPDH在胃癌组织及癌旁正常组织中的表达(T为胃癌组织、N为正常组织)Fig3 ExpressionsofGAPDH in thegastric cancersand theadjacent norm al tissues

图4 RASSF6在胃癌组织及癌旁正常组织中的表达(T为胃癌组织、N为正常组织)Fig 4 ExpressionsofRASSF6 in thegastric cancersand theadjacent normal tissues
3 讨论
胃癌仍是全球范围内因癌死亡的第二位原因[1],在我国其发病率和死亡率也居各种消化系统恶性肿瘤之首。主要原因是临床上诊断分析缺乏特异的肿瘤标志物,早期诊断率低。因此寻找与胃癌早期诊断和治疗相关的新的基因已成为目前胃癌研究的重点内容。近年来有学者认为RASSF6基因可能是胃癌新的候选抑癌基因,其在胃癌发生发展过程中的作用值得深入研究。
RASSF6是Ras相关结构域家族(RASSFs)新成员之一,位于染色体4q13.3,含13个外显子,有3个转录本(RASSF6A~RASSF6C)[2-3],该家族是 2000 年由Dammann等[4]首次发现并命名,参与不同的细胞内机制如凋亡、细胞周期控制、微管稳定性等,一些还表现出抑制肿瘤的功能[2,5-6]。有研究发现RASSF6可在HeLa、MCF-7和HepG2等细胞株中检测到,但在原发性乳腺癌、甲状腺癌组织中表达减少[7-9],因此推测RASSF6可能在肿瘤形成中起作用[8-9]。
本研究采用组织微阵列技术,通过免疫组织化学方法检测RASSF6在100例胃癌组织及癌旁正常胃组织中的表达,结果发现RASSF6在胃癌组织中的阳性表达率为31.0%,明显低于其在正常胃组织中的表达(76.0%),差异有统计学意义。为了进一步证实RASSF6在胃癌中的表达差异,笔者又通过实时荧光定量RT-PCR及Western blot方法检测了20例新鲜胃癌及癌旁正常胃黏膜组织中RASSF6 mRNA及蛋白的表达情况,结果同样发现在胃癌组织中RASSF6mRNA及蛋白表达量均明显低于癌旁正常胃组织,这与免疫组化结果相一致。因此推测RASSF6可能是胃癌中新的抑癌基因,其表达缺失可能导致肿瘤更易向恶性表型发展。经过上述的验证后笔者又对RASSF6蛋白阳性表达与胃癌临床病理特征的关系进行了分析,其结果显示,RASSF6表达与胃癌的分化程度、浸润深度、淋巴结转移及TNM分期有关,而与性别、年龄、肿瘤大小及民族无关,这与文献报道[7,10]相一致。提示RASSF6在胃癌的发生、进展和浸润转移过程中发挥了负性调控的作用。
综上,RASSF6在胃癌中可能为新的抑癌基因。其表达缺失可促进胃癌的发生发展,也可致肿瘤更易向恶性表型发展。在胃癌早期进行RASSF6失表达的检测,可能为胃癌的早期筛查和诊断提供有利的生物学信息。虽然RASSF6的具体作用机制目前尚不明确,但相信随着对RASSF6基因的深入研究,会对其在肿瘤中的作用有一个更全面的认识。
[1]Peng Z,Wei D,Wang L,etal.RUNX3 inhibits the expression of vascular endothelial growth factor and reduces the angiogenesis,growth,andmetastasisofhuman gastric cancer[J].Clin Cancer Res,2006,12(21):6386
[2]van derWeyden L,Adams D J.The Ras-association domain family(RASSF)members and their role in human tumourigenesis[J].Biochim Biophys Acta,2007,1776(1):58
[3]Kaira K,Sunaga N,Tomizawa Y,etal.Epigenetic inactivation of the RAS-effectorgene RASSF2 in lung cancers[J].Int JOncol,2007,31(1):169
[4]Dammann R,LiC,Yoon JH,etal.Epigenetic inactivation ofa RAS association domain family protein from the lung tumour suppressor locus3p21.3[J].NatGenet,2000,25(3):315
[5]Richter A M,Pfeifer G P,Dammann R H.The RASSF incancer;fromepigenetic silencing to functional characterization[J].Biochim BiophysActa,2009,1796(2):114
[6]Ikeda M,Hirabayashi S,Fujiwara N,etal.Ras-association domain family protein 6 inducesapoptosis via both caspase-dependentand caspase-independentpathways[J].Exp CellRes,2007,313(7):1484
[7]Allen NP,Donninger H,VosM D,etal.RASSF6 isanovelmember of the RASSF family of tumor suppressors[J].Oncogene,2007,26(42):6203
[8]Zientek-TargoszH,Kunnev D,Hawthorn L,etal.Transformation of MCF-10A cells by random mutagenesis with frameshiftmutagen ICR191:A model for identifying candidate breast-tumor suppressors[J].MolCancer,2008,7:51
[9]Calvisi D F,Ladu S,Gorden A,etal.Ubiquitous activation of Ras and Jak/Stat pathways in human HCC[J].Gastroenterology,2006,130(4):1117
[10]Wen Y,WangQ,Zhou C,etal.Decreased expressionofRASSF6 isa novel independent prognosticmarker of aworse outcome in gastric cancer patients after curative surgery[J].Ann Surg Oncol,2011,18(13):3858

