新烷化剂替莫唑胺酯对胶质瘤细胞生长的影响
郭珊珊,朱仲玲,徐 辉,丁凤霞,王国成,赵 敏,阎 昭
(1.天津医科大学肿瘤医院肿瘤研究所,国家药物临床试验机构,国家肿瘤临床医学研究中心,天津市“肿瘤防治”重点实验室,天津 300060;2.天津天士力集团研究院,天津 300402)
多形性脑胶质瘤(GBM)是恶性程度最高的原发性脑肿瘤[1]。目前,术后替莫唑胺(TMZ)联合放疗是治疗GBM的标准方案。尽管如此,恶性脑胶质瘤患者的平均存活时间仅为15个月[2]。TMZ耐药是造成胶质瘤患者治疗效果不佳的主要原因。TMZ主要攻击细胞DNA,造成DNA烷基化损伤,进而形成DNA交联,导致细胞死亡[3]。在众多DNA烷基化损伤中,以O6-甲基鸟嘌呤(O6-mG)的损伤威胁最大,是引起细胞致死的重要原因[4]。机体对O6-mG的修复主要依赖O6-甲基鸟嘌呤-DNA甲基转移酶(MGMT),此酶将甲基从DNA的O6位转移到自身半胱氨酸残基上,使DNA链上的鸟嘌呤损伤修复,同时MGMT不可逆地失活,是一种“自杀式”、可消耗酶[5-6]。临床研究一些MGMT抑制剂作为TMZ辅助化疗药物,如O6-BG,但是,临床试验发现,O6-BG具有神经毒性[7]。所以,设计既有TMZ活性作用,又能够消耗MGMT蛋白的药物具有重要的临床意义。TMZ-HE是在TMZ结构基础上改造而来,保留原有药物的作用基团,其目的为在保留原有药物的作用结构基础上,增加药物的脂溶性,使药物进入肿瘤内部的浓度增加。起初,TMZ-HE作为治疗皮肤癌而设计的前体药,能够抑制裸鼠异种移植的黑色素瘤的生长[8]。胶质瘤细胞LN-18由于自身MGMT表达属于原发性耐药细胞系[9-10],本研究选取LN-18细胞系,旨在探索TMZ-HE体外对脑胶质瘤细胞的增殖抑制及诱导凋亡的作用,同时对MGMT蛋白的影响。
1 材料与方法
1.1 材料 TMZ、TMZ-HE由天津天士力公司提供,纯度>99%。二甲基亚砜(DMSO)溶解配成100 mmol/L贮存液,置-20℃冻存。胶质瘤LN-18细胞购于ATCC,由本实验室冻存。改良Eagle培养基(Dulbecco’smodified Eagle’smedium,DMEM)胰蛋白酶购自Gibico公司,胎牛血清购自天津灏洋生物制品公司。四甲基偶氮唑蓝(MTT)、Hoechst33342荧光试剂盒、细胞凋亡试剂盒均为Sigma公司产品,MGMT抗体为CST公司。
1.2 方法
1.2.1 细胞培养 LN-18细胞用DMEM(含10%胎牛血清,1%双抗)培养液培养,置于37℃、5%CO2孵箱中培养,0.25%胰蛋白酶消化传代。
1.2.2 MTT比色法 取对数生长期LN-18细胞,以0.25%胰蛋白酶消化,计数,稀释成1×104/mL的单细胞悬液,接种至96孔板,过夜贴壁后,加入含TMZ、TMZ-HE 终浓度为 62.5、125、250、500、1 000 μmol/L的培养液作为处理组及浓度为0μmol/L的等量DMSO对照组,每种浓度设4个重复孔,并以空白孔调零。药物作用24、48、72和96h后,每孔加入20μL 5mg/mLMTT,继续培养4 h,吸去上清,每孔加150μL DMSO,振荡10min。490 nm波长处酶标仪检测吸收值(OD),结果以各组OD均值±标准差表示(实验重复3次)。
1.2.3 二维克隆法 取对数生长期LN-18细胞,调整细胞密度为200个/mL,以每孔1mL接种于12孔板,待细胞贴壁后,各实验组加入含药培养液(25~200μmol/L),阴性对照组分别加入等量的不含药培养液,每组设2个复孔。每隔3 d换液,2周后取出培养板,甲醇-20℃固定10min,加入结晶紫染色液染色30min。显微镜下观察克隆大小及数量,>50个细胞为克隆,计数。
1.2.4 Hoechst33342/PI荧光染色 取对数生长期LN-18细胞,调整细胞密度为1×106/mL,以每孔1mL接种于24孔板,待细胞贴壁后,加入含TMZ、TMZHE(50~400 mol/L)培养液,作用 96 h 后,弃上清,PBS洗2遍,各孔均加入 Hoechst染料(10 g/mL)、PI染料(1μg/mL)500μL,37℃避光孵育 10min,弃去染料,加入培养液,荧光倒置显微镜下观察并拍照。
1.2.5 流式细胞术Annexin V-FITC/PI双染检测细胞凋亡率 TMZ、TMZ-HE(50~400 mol/L)作用LN-18细胞96 h,收集细胞,调整细胞浓度至1×105/mL,各取100μL;加入预冷的结合缓冲液100μL重悬细胞;加入5μLAnnexinV-FITC和PI染液于细胞悬液中,轻轻混匀,避光染色10min;补加200μL结合缓冲液,流式细胞仪检测凋亡的百分比。
1.2.6 Western blot法检测MGMT蛋白的表达 收取蛋白,BCA试剂盒检测蛋白浓度,将等量蛋白(约50μg)在15%十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离,电转移至PVDF膜后封闭,4℃孵育MGMT兔抗人单克隆抗体过夜,TBST洗膜3次,兔抗荧光二抗孵育,TBST洗膜3次,荧光扫描仪扫描。
1.3 统计学分析 采用SPSS 13.0统计软件处理数据,组间分析比较用t检验。计量资料以x±s表示,采用方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 TMZ-HE对LN-18细胞活力的影响 MTT结果显示,相同浓度梯度的TMZ、TMZ-HE作用胶质瘤LN-18细胞24~96 h后,两种药物均具有增殖抑制作用,且具有浓度和时间依赖性(图1)。TMZ在24、48、72、96 h 处的 IC50值分别为 (2 448±0.17)、(2 063±0.16)、(1 298±0.08)、(1 020±0.095)μmol/L,TMZ-HE 的 IC50值分别为 (318.2±0.03)、(215.9±0.04)、(204.3±0.04)、(178.3±0.05)μmol/L,作用 96 h TMZ和TMZ-HE的IC50值相差约5.72倍,具有显著统计学差异(P<0.001)。以上结果表明,TMZ-HE对胶质瘤细胞LN-18的增殖抑制效果明显优于TMZ。

图1 TMZ,TMZ-HE作用LN-18细胞24、48、72、96 h后细胞存活率Fig 1 Survival ratesof the LN-18 glioma cells treated by different concentrationsof TMZ and TMZ-HE for 24,48,72 and 96 h
2.2 TMZ-HE对LN-18细胞克隆形成的影响 克隆结果显示,TMZ、TMZ-HE对LN-18克隆形成均有抑制作用,随着药物浓度增加,克隆形成数量也随着减少,但TMZ-HE的克隆抑制效果强于TMZ。如图2所示,TMZ-HE作用LN-18细胞后,克隆数量明显少于TMZ组,在200μmol/L的TMZ-HE作用下,能够完全抑制克隆形成,而TMZ仅能抑制40%。
2.3 TMZ-HE诱导LN-18细胞发生凋亡情况TMZ-HE作用LN-18细胞96 h后,细胞凋亡率(包括早期凋亡和晚期凋亡)分别为8.4%、13.5%、14.9%、36.9%,死亡率为2.4%、5.4%、3.1%、6.5%,而TMZ诱导LN-18的凋亡率为7.1%、8.8%、11.5%、28.7%,死亡率为3.3%、2.8%、4.3%、7.3%。其结果表明,TMZ-HE诱导胶质瘤LN-18细胞发生的凋亡高于TMZ,具有浓度依赖性。但是,TMZ和TMZ-HE引起细胞的死亡数量较少,且没有明显的浓度依赖性,见图3。

图2 不同浓度TMZ,TM Z-HE作用LN-18后克隆形成数量百分比Fig 2 Effectsof graded TMZ and TMZ-HE on LN-18 colony form ation
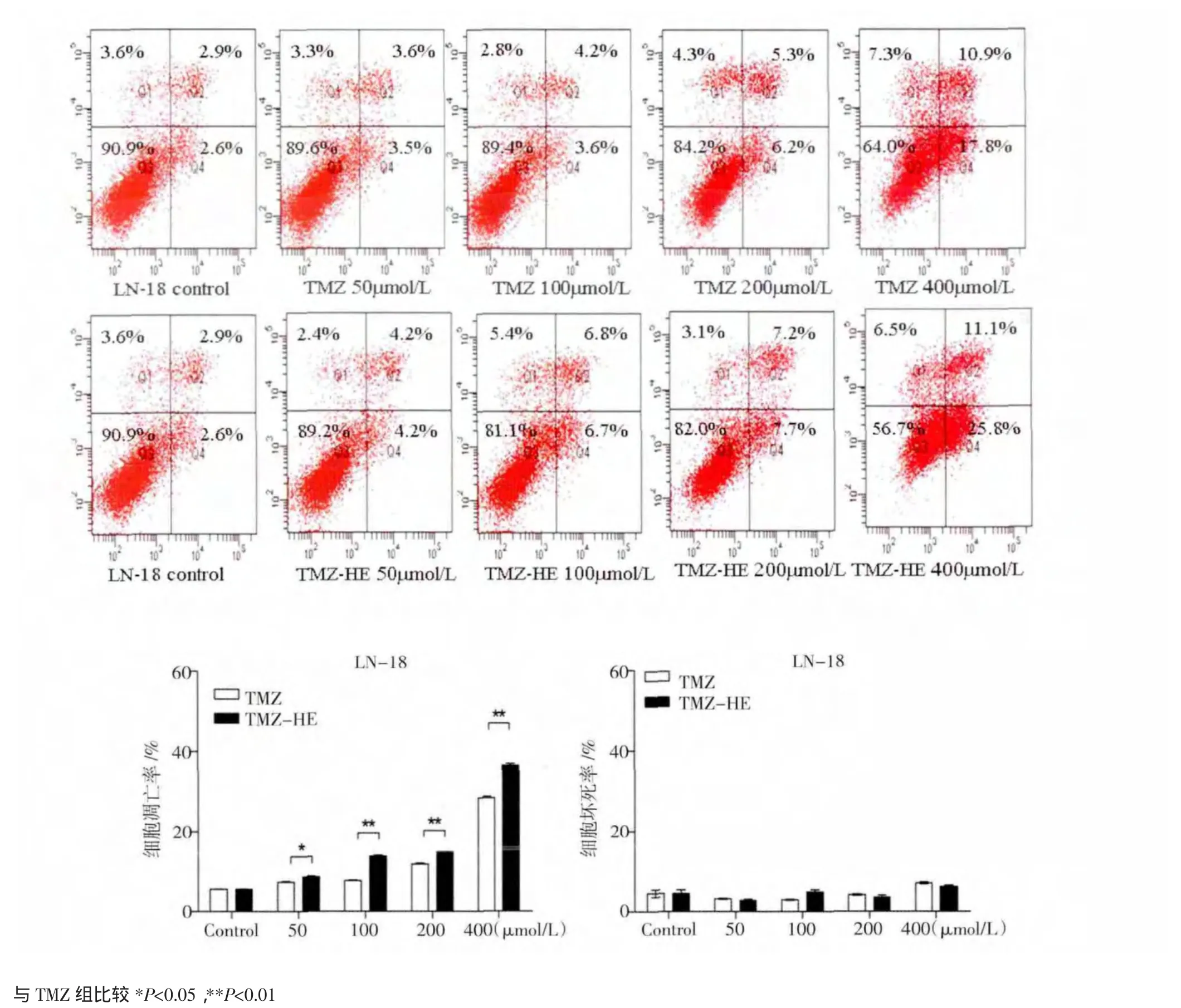
图3 TMZ,TMZ-HE作用LN-18细胞96 h后流式细胞仪检测细胞凋亡率和死亡率Fig 3 Apoptosisand necrosisof LN-18 cellsby flow cytometry after treated with TMZ and TMZ-HE for 96 h
2.4 Hoechst33342/PI荧光染色观察细胞核形态变化和细胞坏死情况 如图4A所示,TMZ、TMZ-HE作用LN-18细胞96 h后,荧光显微镜下观察可见细胞核荧光信号增强,同时,随着浓度增加,细胞核数量不断减少,但是相同浓度下的TMZ-HE组细胞核数量减少的更多。相同作用条件下,PI染色观察可见,随着两种药物浓度增加,坏死细胞没有明显增加,且荧光信号较少,几乎没有坏死,见图4B。这与笔者流式检测的结果相符,说明TMZ-HE更多的诱导LN-18细胞发生凋亡,且诱导细胞的凋亡率高于TMZ,其结果具有统计学意义。

图4 Hoechst33342(A)/PI(B)染色观察TMZ、TMZ-HE对LN-18细胞核的影响及坏死情况(×10)Fig 4 Hoechst33342(A)/PI(B)stainingwasobserved in TMZ,TMZ-HE effecton LN-18 cellnucleiand necrosis(×10)
2.5 TMZ-HE对LN-18细胞耐药蛋白MGMT的影响 Western blot结果显示,两种药物能够使MGMT表达量降低,其具有浓度依赖性。但是,TMZ-HE能够较TMZ更早更多的消耗MGMT蛋白,100μmol/L的TMZ-HE能够完全消耗细胞中MGMT蛋白,而TMZ则需要更高浓度,见图5。

图5 TMZ,TMZ-HE对LN-18细胞中耐药蛋白MGMT的影响Fig 5 Theeffectof TMZ,TMZ-HE on the resistant proterin MGMT in LN-18 cells
3 讨论
GBM是…级脑肿瘤,年发病率为5~8/10万,具有生长迅速、侵袭性强等特性,使得手术彻底切除困难,极易复发[11]。目前对GBM的治疗采用手术和放化疗的综合治疗方式[12]。TMZ是临床治疗恶性脑胶质细胞瘤的标准一线化疗药物。临床研究表明,TMZ对人恶性脑胶质瘤的有效率在45%左右,GBM对TMZ的耐药性是化疗失败的主要原因[7,13]。其中,DNA修复酶MGMT是耐药的主要原因之一[14-15]。有研究表明,白藜芦醇能够抑制MGMT蛋白的表达,与TMZ联合使用能够增加TMZ的敏感性[16]。TMZ治疗胶质瘤的作用效果与MGMT蛋白的消耗和合成的速率有关[5]。本研究通过检测TMZ-HE对LN-18的作用效果,可以初步探索TMZ-HE是否能够克服TMZ耐药。研究结果表明,新型烷化剂TMZ-HE能够较TMZ更早更多地降低胶质瘤LN-18细胞中MGMT蛋白的表达含量,相应可以增加DNA损伤,导致更多的细胞死亡。通过凋亡等相应功能性实验结果表明TMZ-HE的作用效果明显优于TMZ,具有统计学意义,说明TMZ-HE能够通过降低MGMT的表达增强对LN-18的作用效果。TMZ-HE是在TMZ结构基础上改造而来,保留了原有的作用基团,所以,通过凋亡检测和荧光染色结果可以发现TMZ和TMZ-HE都主要诱导LN-18细胞发生凋亡,而细胞死亡几乎没有检测到。这与Roos等[17]研究的TMZ能够诱导胶质瘤细胞发生凋亡的结果一致。但是,细胞发生凋亡的途径有很多,会受到各种因素的影响,如p53在胶质瘤细胞中的状态不同,会诱导细胞发生不同途径的凋亡[18]。所以,TMZ-HE诱导胶质瘤细胞发生凋亡的途径是否与TMZ完全相同,其增加的酯结构是否仅影响药物的渗透能力还有待进一步研究。
本实验通过MTT法、二维克隆法证明了TMZHE对胶质瘤细胞的短期和长期作用效果都优于TMZ,但两者有一个共同点,即长期的作用效果更加明显,200μmol/L TMZ能够抑制60%的克隆形成,TMZ-HE甚至完全抑制LN-18克隆的形成。TMZ诱导细胞凋亡发生的时间为96 h,这是因为TMZ首先导致胶质瘤细胞发生自噬,研究发现,通过药物抑制自噬能够增加TMZ诱导的凋亡[19-20]。TMZ-HE在96 h处诱导LN-18细胞发生更多的凋亡,这是由于TMZ-HE本身能够抑制自噬导致凋亡增多,还是和TMZ相同,先发生自噬,然后诱导更多的凋亡,这是笔者值得探讨的问题。
综上所述,本研究证明了TMZ-HE能够通过下调MGMT蛋白抑制胶质瘤细胞LN-18的增殖并诱导其凋亡,TMZ-HE较TMZ作用效果更好,对治疗胶质瘤有很好的应用前景。因此,TMZ-HE是否能够克服TMZ耐药以及诱导凋亡的机制是进一步研究的主要内容。这些研究大多数还是建立在体外实验上,由于体内外环境差别较大,要想更好地了解TMZ-HE在胶质瘤中的作用,还有待进一步开展TMZ-HE在体内的相关研究。
[1]Wen P Y,Kesari S.Malignant gliomas in adults[J].N Engl JMed,2008,359(5):492
[2]Helseth R,Helseth E,Johannesen TB,etal.Overall survival,prognostic factors,and repeated surgery in a consecutive series of 516 patientswith glioblastomamultiforme[J].Acta Neurol Scand,2010,122(3):159
[3]Zhang J,StevensM F,Bradshaw TD.Temozolomide:mechanismsof action,repairand resistance[J].CurrMol Pharmacol,2012,5(1):102
[4]RoosW P,Kaina B.DNA damage-induced celldeath:from specific DNA lesions to the DNA damage response and apoptosis[J].Cancer Lett,2013,332(2):237
[5]Silber JR,Bobola M S,Blank A,etal.O(6)-methylguanine-DNA methyltransferase in glioma therapy:promise and problems[J].Biochim Biophys Acta,2012,1826(1):71
[6]Spiegl-Kreinecker S,Pirker C,FilipitsM,etal.O6-methylguanine DNA methyltransferase protein expression in tumor cells predicts outcome of temozolomide therapy in glioblastoma patients[J].Neuro Oncol,2010,12(1):28
[7]Inno A,Fanetti G,Di Bartolomeo M,etal.Role of MGMT as biomarker in colorectal cancer[J].World JClin Cases,2014,2(12):835
[8]Suppasansatorn P,WangG,Conway BR,etal.Skin delivery potency and antitumor activities of temozolomide ester prodrugs[J].Cancer Lett,2006,244(1):42
[9]Happold C,Roth P,Wick W,etal.Distinctmolecularmechanisms of acquired resistance to temozolomide in glioblastoma cells[J].J Neurochem,2012,122(2):444
[10]Fan CH,Liu W L,Cao H,etal.O6-methylguanine DNA methyltransferase asa promising target for the treatmentof temozolomideresistantgliomas[J].CellDeath Dis,2013,4:e876
[11]Dolecek TA,Propp JM,Stroup N E,etal.CBTRUSstatistical report:primary brain and central nervous system tumors diagnosed in theUnited Statesin2005-2009[J].NeuroOncol,2012,14(Suppl5):1
[12]Stupp R,HegiM E,van den BentM J,etal.Changing paradigms-an update on themultidisciplinarymanagementofmalignantglioma[J].Oncologist,2006,11(2):165
[13]Cavaliere R,Wen P Y,Schiff D.Novel therapies for malignant gliomas[J].NeurolClin,2007,25(4):1141
[14]Wiewrodt D,Nagel G,Dreimüller N,etal.MGMT in primary and recurrent human glioblastomas after radiation and chemotherapy and comparisonwith p53 statusand clinicaloutcome[J].Int JCancer,2008,122(6):1391
[15]Ramirez Y P,Weatherbee JL,Wheelhouse R T,etal.Glioblastoma multiforme therapy and mechanisms of resistance[J].Pharmaceuticals(Basel),2013,6(12):1475
[16]Huang H,Lin H,Zhang X,etal.Resveratrol reverses temozolomide resistance by downregulation of MGMT in T98G glioblastoma cells by theNF-κB-dependentpathway[J].OncolRep,2012,27(6):2050
[17]RoosW P,Batista L F,Naumann SC,etal.Apoptosis inmalignant glioma cells triggered by the temozolomide-induced DNA lesion O6-methylguanine[J].Oncogene,2007,26(2):186
[18]Goldstein M,RoosW P,Kaina B.Apoptotic death induced by the cyclophosphamide analoguemafosfamide in human lymphoblastoid cells:contribution of DNA replication,transcription inhibition and Chk/p53 signaling[J].ToxicolApplPharmacol,2008,229(1):20
[19]Zou Y,Wang Q,Li B,etal.Temozolomide induces autophagy via ATM AMPK ULK1 pathways in glioma[J].Mol Med Rep,2014,10(1):411
[20]Zanotto-Filho A,BraganholE,Klafke K,etal.Autophagy inhibition improves the efficacy of curcumin/temozolomide combination therapy in glioblastomas[J].Cancer Lett,2015,358(2):220

