相控阵激励信号对经颅HIFU焦域影响的仿真研究
丁 鑫,韩珍珍,菅喜岐
(天津医科大学生物医学工程与技术学院,天津300070)
高强度聚焦超声是将体外的低能量超声波聚焦于体内治疗靶区,通过其产生的热效应等使靶区组织温度在短时间内达到60℃以上,热凝固致死靶区内组织的疗法。该疗法现已应用于临床实体性均匀组织肿瘤如乳腺肿瘤、子宫肌瘤、肝肿瘤等的治疗[1]。由于颅骨的非均质结构,其声速、密度、衰减系数等声学参数与周围脑组织的特性相差大[2],在HIFU经颅骨传播入脑组织的过程中,发生严重的波形畸变、相位和幅值失真、散焦或焦点前移的现象,HIFU经颅治疗脑肿瘤时可能导致烫伤颅骨及其周边组织或不能致死靶区组织等问题的发生。本文基于人体头颅CT数据重建的图像和64阵元三维相控换能器,以颞骨窗为声窗建立三维数值仿真模型,采用时域有限差分法(Finite Difference Time Domain,FDTD)数值解析Westervelt声压传播方程和Pennes生物热传导方程,研究相控阵激励信号对HIFU经颅形成焦域的影响,应用基于时间反转的互相关调制法,对相控换能器全部阵元或不同环阵元激励信号的相位和幅值进行调制,提高HIFU经颅聚焦的性能,使其在颅内靶区处精确聚焦,并降低HIFU对颅骨以其周边组织造成热损伤的风险。
1 模型与方法
1.1 基本方程式
1.1.1 声波传播方程式 采用Westervelt非线性声波传播方程描述声波传播过程[3],其式如下:

式中,荦为拉普拉斯算子,ρ为声压(Pa),c(m/s)为声速为声波非线性系数为声波扩散系数,ω=2πf(rad/s)为角频率,f(Hz)为频率,(ts)为时间。
1.1.2 生物热传导方程 在不考虑血流灌注的影响的条件下,采用Pennes生物传热方程[4]描述HIFU经颅的温度场,其式如下:

式中,T 为组织温度(℃),Cr、kr分别为组织的比热[J/(Kg·℃)]和热传导率[W/(m·℃)],T0为组织的初始温度 37 ℃,单位体积的发热量(J/m3)q=2αI,声强为声波周期。
1.2 数值仿真模型 数值仿真模型如图1所示。

图1 数值仿真模型图Fig 1 The diagram of the simulationmodel
由开口直径100mm,曲率半径80mm的64阵元圆环形相控换能器和人体头颅CT扫描数据构成。其中,相控换能器中心开口39.5mm,每个阵元直径为8.5mm,工作频率为0.8MHz,设定焦点位于相控换能器几何焦点处。模型中颅骨部分通过CT图像三维重建而成,利用CT图像的亨氏值H(Hu)计算介质的孔隙率Φ,根据Φ值计算[5]不同位置处颅骨和脑组织密度ρ、声速c和衰减系数α如下:


表1 仿真参数表Tab1 The tableof parameters in thesim ulation
1.3 基于时间反转的互相关法调制阵元激励信号
1.3.1 如图2所示,基于时间反转法在目标靶点(焦点)处设置理想正弦信号点声源,通过数值仿真获得每个阵元接收理想点源经颅传播的声波信号,并将该声波信号进行时间反转处理,用于调制并获取阵元激励信号。
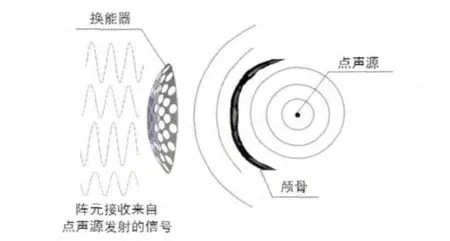
图2 通过理想点声源获取阵元激励信号的示意图Fig 2 The diagram of obtaining driving signals of arrays through the idealacoustic source
1.3.2 取任一阵元为基准阵元,将其时间反转信号与其余阵元的时间反转信号分别做互相关,得到如图3所示的每个阵元与基准阵元的相关关系,对各阵元互相关最大值与基准阵元的自相关最大值的相位做差,得到每个阵元相对于基准阵元相位延迟Δt;对各阵元互相关最大值相对基准阵元的自相关最大值做归一化处理,得到各阵元相对于基准阵元的幅值调制比。
1.3.3 在保证相控换能器总输入能量调制前后一致的前提下,按照幅值调制比调制每个阵元的输入声强的幅值,实现对所有阵元发射的经颅声波的幅值调制;针对不同环阵元的激励信号调制时,在保证能量恒定的情况下,保证不调制阵元的声强不变,对需要调制的阵元输入声强幅值按幅值调制比进行调制。
1.3.4 以各阵元相对于基准阵元的相位延迟调制对应的正弦激励信号相位,以调制后的输入声强幅值调制对应的正弦信号激励幅值,实现如图4所示的经颅聚焦。

图3 基于时间反转信号的互相关关系Fig 3 The correlation between tim e reversed signals

图4 经调制后的相控换能器阵元激励信号经颅聚焦示意图Fig 4 The diagram of transcranial focusing after modulating the drving signalsofphased transducer
2 结果
2.1 相控阵元激励信号的相位延迟及幅值调制比以图1为数值仿真模型,在颅骨外表面距离相控换能器55mm,阵元初始声强为2.5 w/cm2,辐照时间为20 s的条件下,采用基于时间反转的互相关调制法对换能器全部阵元激励信号调制时,各阵元相对于基准阵元的相位延迟、幅值调制比如图5所示。其中,图5(a)为各阵元相对于基准阵元的相位延迟,可用于调制相控阵激励信号的相位;图5(b)为各阵元相对于基准阵元的幅值调制比,可用于调制相控阵激励信号的幅值。
2.2 相控阵元激励信号全调制对焦域的影响 采用图5所示的调制换能器的相位延迟和幅值调制比对换能器全部阵元的激励信号进行相位调制聚焦、相位与幅值同时调制聚焦以及相控换能器曲面自聚焦形成的声轴上声压变化曲线如图6所示,图7为与图6对应的声轴上温度变化曲线。图中灰色实线为相控换能器曲面自聚焦时(即未对阵元激励信号进行调制)形成的曲线,灰色点画线为相位调制后聚焦形成的曲线,黑色实线为对全阵元同时调制相位和幅值后聚焦形成的曲线。

图5 相控阵元激励信号的相位延迟及幅值比Fig 5 The phasedelay and radio ofamplitudeof drving signalsby phased tranducer

图6 调制激励信号后经颅聚焦形成的声轴声压曲线Fig 6 Theacoustic curveson axis focusing bym odu lated drving signals

图7 调制激励信号后经颅聚焦形成的声轴温度曲线Fig 7 The thermalcurveson axis focusing bymodulated d rving signals
由图6和图7可知,仅利用相控换能器球面曲率进行聚焦时,经颅声波不能在设定的几何焦点(80mm)处形成聚焦,实际形成焦点较几何位置前移,且在颅骨内存在较大声压和较高温度。对换能器激励信号进行相位调制后,经颅声波可在设定几何焦点处形成聚焦,但焦点处声压和温度较曲面自聚焦减小,颅骨内高声压与曲面自聚焦相比有所降低。对全部阵元激励信号进行相位和幅值调制时,不仅使经颅声波精确聚焦,而且使焦点声压和温度较仅作相位调制时升高,与曲面聚焦时焦点处声压及温度相近,同时颅骨内声压及温度较相位调节时有所降低,使更多的能量聚焦于目标焦点处。
图8为调制激励信号后经颅聚焦形成的焦平面温度场分布。取焦点处温度高于60℃的区域为焦域,由图8可知,曲面自聚焦时,虽形成焦域,但焦域未出现在设定焦点处;经过调制后,经颅HIFU可在设定焦点处形成近似椭圆的焦域,且颅骨内不出现温度较高的区域。图9所示为通过空间积分计算得到的不同调制激励信号经颅聚焦形成焦域体积。
由图9可知,曲面自聚焦时,声波聚焦形成一定体积的焦域,但结合图8可知,该焦域并未出现在设定靶区处,且由于声波在颅内传播距离小,传播过程中衰减损失的能量少,导致在近颅骨处沉积能量较多,使该焦域体积较大,对非靶区造成较多损伤;相位调制时,声波聚焦在设定焦点处并形成一定体积的焦域;相位和幅值同时调制时,声波在焦点处聚焦形成的焦域较相位调制时增大,更多的能量沉积此处,利于充分消融靶区组织。
2.3 不同环上阵元激励信号幅值的调制对焦域的影响 以上对相控阵全阵元激励信号的调制进行了分析。然而,相控换能器的特性之一是阵元的调控信号彼此独立,可分别调控阵元实现空间聚焦[9],故根据聚焦要求可针对换能器不同阵元激励信号进行调控。在这里,对不同环上阵元的激励信号幅值按如下8种方式调制:A方式为全阵元调制;B方式为第2、3、4环阵元调制;C方式为第3、4环阵元调制;D方式为第4环阵元调制;E方式为第1环阵元调制;F方式为第1、2环阵元调制;G方式为第1、2、3环阵元调制;H方式为不对声波幅值调制。图10为这8种方式调制后的各阵元激励信号幅值。

图8 调制激励信号后经颅聚焦形成的焦平面温度场分布Fig 8 The thermaldistributionsof focalp lane focusing bym odulated drving signals
采用图10所示的不同幅值调制方式对换能器不同环阵元激励信号进行调制,不同调制方式下声轴上焦点处及颅骨处温度变化曲线如图11所示。由图11可知,C方式(第3、4环阵元激励信号幅值调制)时,声波聚焦在设定焦点处的温度高于60℃,且颅骨内温度低于45℃[10],与其他调制方式相比,颅骨内的温度较低。由此可知相控换能器外环阵元激励信号幅值大小对聚焦声场的影响较大,对相控换能器外环阵元激励信号调制后,既可实现声波在设定焦点聚焦,又可使声波对颅骨造成的热损伤最小。

图10 8种方式调制后的各阵元激励信号幅值Fig 10 Theamplitudeof drving signals in eight conditionsofm odulating
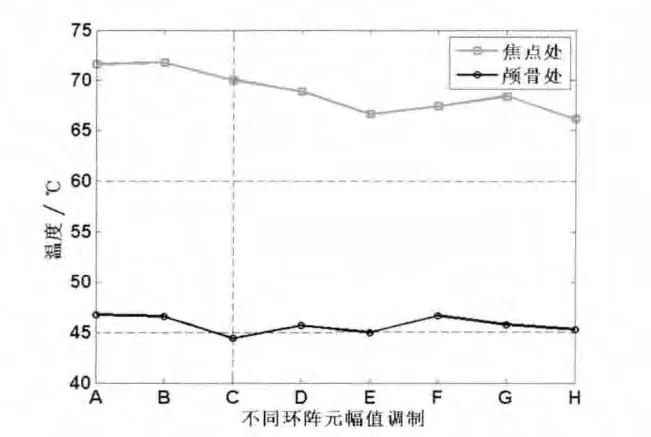
图11 不同调制方式下经颅聚焦形成的声轴上焦点处及颅骨处温度变化情况Fig 11 The tem peraturecurves at focus and the surface between sku lland water in differentm odu lating conditions
3 讨论
HIFU因其具有非侵入性和可重复治疗性等特点被引入脑肿瘤治疗、经血脑屏障的药物传递等[11]。但HIFU经颅后无法精确聚焦于靶区及对颅骨和其周边组织的伤害仍是限制HIFU无创地进行经颅治疗的重要难题。1996年,Fink等[12]将时间反转法应用于HIFU经离体颅聚焦的实验中,研究经颅HIFU的相位调节。1998年,Tanter等[13]提出对比声波经过水体信号和声波经过水体内置离体颅骨信号的方法,对经颅声波幅值补偿。但该方法中认为颅骨厚度很小且贴近相控换能器表面。而实际治疗时,相控换能器不是总覆盖在颅骨表面进行治疗,颅骨与相控换能器的距离对治疗效果存在影响[14]。2005年,Hynynen等[15]提出采用波长与颅骨厚度相近的0.25MHz超声波进行经颅治疗,使颅骨对声波的衰减作用降低。频率越低越易形成空化效应,空化效应会对组织造成损伤。2013年,Narumi等[16]提出时间延迟结合互相关法校正在非均质介质中传播声波的幅值畸变,并实现经颅聚焦,但对幅值校正能量分配过程未详细阐述,且是否可针对独立的换能器阵元进行校正并未讨论。
本文基于人头颅CT数据和时间反转的互相关调制法,结合Westervelt声波传播方程和Pennes热传导方程,采用FDTD法,仿真研究了调控激励信号的相位和幅值并实现HIFU经颅精确聚焦的方法,以及相控换能器激励信号对经颅HIFU聚焦焦域的影响。综合上述研究结果得到如下结论:(1)相控阵激励信号对HIFU经颅聚焦存在影响;通过调制相控换能器阵元激励信号相位,可使经颅声波精确聚焦;通过对各阵元激励信号幅值大小的重新分配,可提高靶区焦点处最大声压和最高温度,增大在焦点处的经颅声能量聚积,实现高效聚焦。(2)通过对相控换能器不同环上阵元激励信号的调制,可降低颅骨处的温度,降低对颅骨周边组织的造成热损伤的风险。
本研究基于人体实际颅骨在直角坐标系内进行数值仿真研究,仿真中未考虑实际治疗颅骨外的皮肤组织,有关皮肤对HIFU经颅形成焦域的影响并未讨论;当皮肤存在且考虑血流灌注时,经皮肤传播的声波幅值的调制方法正在研究中。
[1]熊六林.高强度聚焦超(HIFU)治疗肿瘤原理及临床应用现状[J].中国医疗器械信息,2009,15(3):17
[2]Pinton G,Aubry JF,Fink M,etal.Effects of nonlinear ultrasound propagation on high intensity brain therapy[J].Med Phys,2011,38(3):1207
[3]Westervelt PJ.Parametric acoustic array[J].JAcoust Soc,2005,35:535
[4]Pennes H H.Analysis of tissue and arterial blood temperatures in the restinghuman forearm[J].JApplPhysiol,1948,1(2):93
[5]Aubry JF,TanterM,PernotM,etal.Experimentaldemonstration of noninvasive transskull adaptive focusing based on prior computed tomography scans[J].JAcoustSoc Am,2003,113(1):84
[6]Mur G.Absorbing boundary conditions for the Finite-Difference approximation of the Time-Domain Electromagnetic-Field equations[J].Electromagnetic Compatibility,IEEE Transactions on,1981,EMC-23(4):377
[7]Clement G T,White P J,Hynynen K.Enhanced ultrasound transmission through the human skull using shearmode conversion[J].JAcoustSoc Am,2004,115(3):1356
[8]Pernot M,Aubry J F,Tanter M,etal.Prediction of the skull overheating during high intensity focused ultrasound transcranial brain therapy[C]//UltrasonicsSymposium,2004 IEEE,2,2004:1005
[9]Yuldashev PV,Shmeleva SM,Ilyin SA,etal.The role of acoustic nonlinearity in tissue heating behind a rib cage using a highintensity focused ultrasound phased array[J].PhysMed Biol,2013,58(8):2537
[10]Behnia S,Ghalichi F,Jafari,etal.Finite-element simulation of ultrasound brain surgery:effects of frequency,focal pressure,and scanning path in bone-heating reduction[J].CentEur JPhys,2008,6(2):211
[11]Kyriakou A,Neufeld E,Werner B,etal.A review of numerical and experimental compensation techniques for skull-induced phase aberrationsin transcranial focused ultrasound[J].Int JHyperthermia,2014,30(1):36
[12]Thomas J L,Fink M A.Ultrasonic beam focusing through tissue inhomogeneitieswith a time reversalMirror:application to transskull therapy[J].Ultrasonics,Ferroelectricsand Frequency Control,IEEE Transactionson,1996,43(6):1122
[13]Tanter M,Thomas J L,Fink M.Focusing and steering through absorbing and aberrating layers:application to ultrasonic propagation through theskull[J].JAcoustSoc Am,1998,103(5Pt1):2403
[14]王意喆,张千,周文征,等.HIFU经颅治疗中降低颅骨声压的仿真研究[J].计算机仿真,2014,31(5):209
[15]Yin X,Hynynen K.A numerical study of transcranial focused ultrasound beam propagation at low frequency[J].Phys Med Biol,2005,50(8):1821
[16]Narumi R,Matsuki K,Mitarai S,etal.Focus control aided by numerical simulation in heterogeneous media for high-intensity focused ultrasound treatment[J].Jpn JAppl Phys,2013,52(7S):07HF01-09

