市售不同厂家格列齐特缓释片的体外释放度比较
任 静,杨金荣,许煜静
(天津医科大学药学院,天津市临床药物关键技术重点实验室,天津300070)
格列齐特(gliclazide)为第二代口服磺酰脲类降血糖药,能降低血小板黏附力,降低血糖黏度,用于成年型糖尿病或伴有血管病变者。法国施维雅公司率先研制出了格列齐特缓释制剂,规格为每片30 mg,2003年在中国上市,商品名为达美康。我国有多个厂家生产格列齐特缓释片,其处方工艺差别大[1]。在多种pH溶出介质中溶出曲线的测定是先进国家药物审评机构评价口服固体制剂内在质量的一种重要手段,该试验可用于评估不同来源的同一制剂内在质量差异[2-3]。本试验对6个市售厂家格列齐特缓释片在3种不同释放介质中的体外释放进行研究,并与达美康缓释片进行比较,为评价国内格列齐特缓释片的质量情况提供依据,从而为药品的安全性、有效性和稳定性提供保障。
1 材料与方法
1.1 仪器与试剂
1.1.1 仪器 ZRS-8智能溶出仪(天津大学无线电厂),安捷伦1200系列高效液相色谱仪,BSA124S万分之一电子天平(赛多利斯科学仪器有限公司)。
1.1.2 试剂 格列齐特对照品(中国药品生物制品检定所,批号100269-201004);格列齐特缓释片(以下简称达美康,批号2001769);其余6个厂家的格列齐特缓释片分别为A-1(北京某药厂,批号21311020),A-2(北京某药厂,批号 21312029),B-1(山东某药厂,批号131102),B-2(山东某药厂,批号140501),C(深圳某药厂,批号 1402064),D(山东某药厂,批号 140306),E(海南某药厂,批号 20131002),F(天津某药厂,批号20130603)。甲醇(色谱纯,天津基准化学试剂有限公司),乙腈(色谱纯,J&KSCIENTIFIC TLD),三氟乙酸(色谱纯,J&K SCIENTIFIC TLD),三乙胺(色谱纯,J&K SCIENTIFICTLD)。
1.2 试验方法
1.2.1 外观检查 观察各厂家药片是否完整光洁,色泽均匀,有适宜的硬度。
1.2.2 色谱条件 色谱柱:AgilentC8色谱柱(5μm,150mm× 4.6mm);流动相:乙腈-水-三乙胺-三氟乙酸(48∶52∶0.1∶0.1);检测波长:228 nm;进样量:20 μL;柱温:35 ℃;流速:1.0mL·min-1。
1.2.3 储备液的配制 精密称取格列齐特对照品约30mg,置100mL量瓶中,加甲醇5mL溶解,加pH 7.4磷酸盐缓冲液(PBS)稀释至刻度(浓度为300 μg·mL-1),摇匀,作为储备液。
1.2.4 标准曲线的制备方法 精密量取上述储备液 0.5、1.0 、2.0 、3.0 、4.0 、5.0 、6.0mL,分别置 50 mL量瓶中,加入pH 7.4 PBS稀释至刻度,制成系列对照品溶液。在上述色谱条件下,分别量取上述溶液20μL进样,测定峰面积。
1.2.5 对照品溶液的配制 精密称取格列齐特对照品约33mg,置100mL量瓶中,加甲醇5mL溶解,加 pH 7.4 PBS 稀释至刻度(浓度为 330 μg·mL-1),摇匀,精密量取上述储备此液5.0mL置50mL量瓶中,加入pH 7.4 PBS稀释至刻度,制成对照品溶液。在上述色谱条件下,分别量取上述溶液20μL进样,测定峰面积。
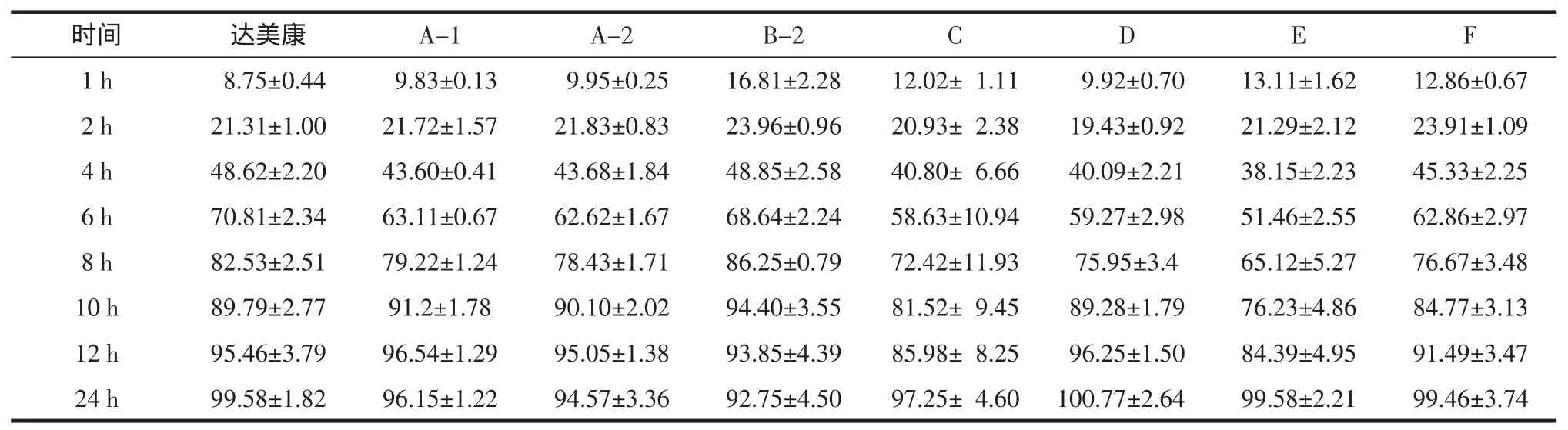
1.2.6 释放度测定方法[4]取样品6片,采用ChP2010年版释放度测定法第一法装置,以脱气处理的pH 7.4PBS900mL为释放介质,转速为100 r/min,温度(37±0.5)℃,依法操作。分别在 1、2、4、6、8、10、12、24 h取溶液5mL,滤过,并及时补充同温度介质5mL,取续滤液20μL进样,记录色谱图。以外标法计算每片在不同时间的累积释放百分率。
1.2.7 样品在不同介质中的释放度测定 照1.2.6的方法,分别以pH 7.4 PBS、pH 4.5 PBS和蒸馏水作为释放介质,分别在 1、2、4、6、8、10、12 、24 h 取样,考察样品在不同介质中的释放情况。
1.2.8 结果判定方法
1.2.8.1 药品标准[4]:格列齐特缓释片在2、4、12 h的格列齐特释放量应分别为标示量的17%~31%、35%~55%、75%以上。
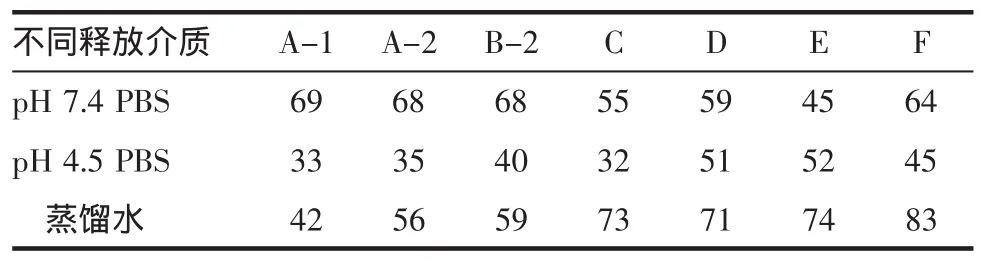
1.2.8.2 相似因子[1,5]:将各厂家样品释放曲线分别与达美康释放曲线进行比较,计算相似因子。相似因子计算公式为 f2=50×lg{100×[1+1/n×∑(Rt-Tt)2]-0.5},Rt与Tt分别代表参比和受试制剂第t时间点的平均累积释放百分率,n为测试点数,若受试与参比制剂的溶出曲线间的f2值不小于50,则认为两者相似。
1.2.9 模型拟合 将释药曲线进行零级方程、一级方程和Higuchi方程的释药模型拟合[6-8,10],比较拟合参数。
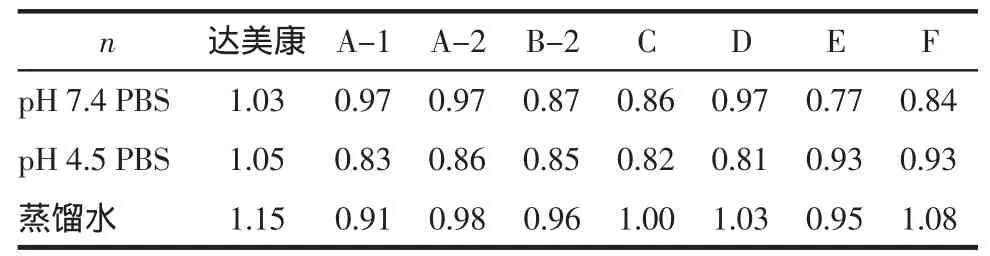
1.2.10 释放机制[10]将释药曲线进行Ritger-Peppas方程释药模型拟合,提取参数k,确定释药机制。根据Ritger-Peppas方程式:Mt/M∞=ktn,对于圆柱型制剂,时间项t的指数的意义为:(1)当n≤0.49,药物释放机制为Fickian扩散;(2)0.49 1.3 参数提取与比较 将释药曲线以威布尔方程进行拟合,对所得的威布尔参数m,T50,Td分别与达美康进行比较(t检验),比较 A-1,A-2 的 T50,Td(t检验)[6]。 2.1 外观检查 B-1厂家药片中有边缘不整,有明显的吸潮膨胀现象,硬度小,外观检查不合格;其余厂家样品外观均合格。 2.2 格列齐特标准曲线的线性范围 分别以峰面积作为纵坐标,以对照品溶液浓度作为横坐标进行线性回归,回归方程y=53.203x+25.967,相关系数r=0.999 6,结果表明格列齐特在 2.95~35.41μg·mL-1浓度范围内,线性关系良好。 2.3 释放度结果 不同厂家格列齐特缓释片在不同释放介质中平均累积释放百分率数据见表1~3。 2.3 结果判定 2.3.1 药品标准 从表1中看出各厂家样品在pH 7.4PBS中2、4、12h的释放度数据均符合要求。 2.3.2 相似因子 各厂家样品释放曲线与达美康溶出曲线的相似因子见表4。从表4中可以看出在pH 7.4 PBS中,只有E厂家样品与达美康的相似因子小于50,与达美康不相似,其余厂家样品均与达美康相似;在pH 4.5 PBS中,只有D和E厂家样品与达美康的相似因子大于50,其余厂家样品均不相似;在蒸馏水中只有A-1厂家样品与达美康的相似因子小于50,不相似,其余均相似。综上,只有D厂家样品在pH 7.4 PBS、pH 4.5 PBS和蒸馏水中与达美康相似。 表1 不同厂家格列齐特缓释片在pH 7.4 PBS中的平均累积释放百分率(%)(n=6Tab1 Accumulate dissolution percentage of dlam icronm r and gliclazide sustained-release tablets of differentmanufacturers in phosphate buffered saline(pH 7.4)(%)(n=6 表1 不同厂家格列齐特缓释片在pH 7.4 PBS中的平均累积释放百分率(%)(n=6Tab1 Accumulate dissolution percentage of dlam icronm r and gliclazide sustained-release tablets of differentmanufacturers in phosphate buffered saline(pH 7.4)(%)(n=6 时间 达美康 A-1 A-2 B-2 C D E F 1 h 8.75±0.44 9.83±0.13 9.95±0.25 16.81±2.28 12.02± 1.11 9.92±0.70 13.11±1.62 12.86±0.67 2 h 21.31±1.00 21.72±1.57 21.83±0.83 23.96±0.96 20.93± 2.38 19.43±0.92 21.29±2.12 23.91±1.09 4 h 48.62±2.20 43.60±0.41 43.68±1.84 48.85±2.58 40.80± 6.66 40.09±2.21 38.15±2.23 45.33±2.25 6 h 70.81±2.34 63.11±0.67 62.62±1.67 68.64±2.24 58.63±10.94 59.27±2.98 51.46±2.55 62.86±2.97 8 h 82.53±2.51 79.22±1.24 78.43±1.71 86.25±0.79 72.42±11.93 75.95±3.4 65.12±5.27 76.67±3.48 10 h 89.79±2.77 91.2±1.78 90.10±2.02 94.40±3.55 81.52± 9.45 89.28±1.79 76.23±4.86 84.77±3.13 12 h 95.46±3.79 96.54±1.29 95.05±1.38 93.85±4.39 85.98± 8.25 96.25±1.50 84.39±4.95 91.49±3.47 24 h 99.58±1.82 96.15±1.22 94.57±3.36 92.75±4.50 97.25± 4.60 100.77±2.64 99.58±2.21 99.46±3.74 表2 不同厂家格列齐特缓释片在pH 4.5PBS中的平均累积释放百分率(%)(n=6)Tab2 Accum ulate dissolution percentage of dlam icronm r and gliclazide sustained-release tablets of differentm anufactures in phosphate bu ffered saline(pH 4.5)(%)(n=6 表2 不同厂家格列齐特缓释片在pH 4.5PBS中的平均累积释放百分率(%)(n=6)Tab2 Accum ulate dissolution percentage of dlam icronm r and gliclazide sustained-release tablets of differentm anufactures in phosphate bu ffered saline(pH 4.5)(%)(n=6 时间 达美康 A-1 A-2 B-2 C D E F 1 h 2.39±0.11 7.04±0.92 6.45±0.48 5.42±0.57 7.3±1.27 7.07± 0.39 4.50±1.29 4.67±0.44 2 h 6.79±0.39 16.10±2.45 14.40±1.27 14.03±1.26 17.16±2.42 12.55± 0.53 10.45±2.47 11.57±1.26 4 h 18.14±0.39 34.70±4.68 31.24±3.27 30.68±1.84 35.32±2.60 23.67±11.05 23.73±5.79 27.55±4.47 6 h 28.55±1.77 51.97±5.78 46.79±5.29 47.67±4.74 50.56±3.83 36.13± 1.63 36.34±7.94 37.56±4.95 8 h 36.46±1.85 62.55±5.71 59.43±5.53 54.97±3.27 63.76±4.97 47.70± 3.25 46.88±8.45 51.38±4.67 10 h 42.08±1.88 70.88±5.54 69.59±6.46 62.05±5.89 74.09±2.36 54.78± 3.28 54.63±8.33 60.13±4.79 12 h 46.15±1.99 75.72±5.90 75.39±6.99 64.86±7.32 78.83±1.51 59.94± 2.98 60.10±7.93 66.27±5.50 24 h 60.79±3.92 83.31±3.95 83.66±6.28 70.86±6.80 84.92±1.51 77.57± 4.25 73.61±5.54 77.16±4.55 表3 不同厂家格列齐特缓释片在蒸馏水中的平均累积百分率(%)(n=6)Tab3 Accumu late dissolution percentageof dlam icronm r and gliclazid sustained-release tabletsof differentmanufactures in water(%)(n=6 表3 不同厂家格列齐特缓释片在蒸馏水中的平均累积百分率(%)(n=6)Tab3 Accumu late dissolution percentageof dlam icronm r and gliclazid sustained-release tabletsof differentmanufactures in water(%)(n=6 时间 达美康 A-1 A-2 B-2 C D E F 1 h 5.31±0.42 11.04±1.14 8.70±1.00 7.14±0.44 7.78±0.73 7.42±0.56 8.32±1.68 6.47± 0.37 2 h 14.35±1.62 24.79±2.42 20.35±2.25 18.20±1.15 18.09±1.53 16.75±1.05 18.31±3.67 15.89± 0.62 4 h 39.43±4.71 54.47±4.69 43.88±4.26 38.45±1.88 41.83±4.25 40.48±3.90 41.52±5.84 38.58±11.43 6 h 57.94±6.38 77.40±2,51 67.26±5.80 56.38±1.82 62.24±3.94 64.25±4.29 60.99±6.66 59.20± 1.99 8 h 72.26±7.92 90.61±3.11 83.71±5.72 67.09±1.58 75.64±3.65 77.64±3.92 71.97±6.56 73.70± 2.28 10 h 80.89±6.74 96.47±1.43 90.75±4.91 72.54±1.62 85.21±2.74 84.15±2.96 79.63±4.19 84.45± 2.49 12 h 87.99±3.40 97.49±1.00 92.52±4.37 74.90±2.31 88.99±2.14 86.76±1.63 82.52±3.01 90.32± 1.90 24 h 94.03±2.97 96.85±0.69 97.28±1.50 82.24±2.51 93.72±1.8 87.95±1.76 83.83±1.68 94.90± 1.05 表4 不同厂家格列齐特缓释片与达美康释放曲线的相似因子Tab4 f2 factor of gliclazid sustained-release tablets of 6 manufactures A厂家两批产品A-1与A-2在pH 7.4 PBS、pH4.5 PBS中,相似因子差异很小,但在蒸馏水释放介质中,相似因子差异大。 2.3.3 模型拟合 根据上述释放度测定结果,对达美康及6个不同厂家产品进行释药模型拟合,在pH 7.4PBS中,达美康一级方程拟合度的相关系数较高,为0.995 5,其余厂家产品Higuchi方程拟合的相关系数较高,均大于等于0.984。在pH 4.5 PBS和蒸馏水中,所有厂家产品一级方程拟合度的相关系数较高。 2.3.4 释药机制比较 将不同释放介质中的平均累积释放百分数带入Ritger-Peppas方程Mt/M∞=ktn,提取参数 n(表 5)。 从表5可以看出,达美康在3种介质中均为骨架溶蚀机制。市售样品在pH 7.4 PBS中,只有E厂产品的释放机制为扩散与骨架溶蚀机制相结合(0.49 表5 不同厂家格列齐特缓释片在不同介质中的Ritger-Peppas方程参数nTab5 Param eters n in Ritger-Peppas equation for gliclazid sustained-release tablets of 6 m anu factures in different dissolutionmedium s 2.3.5 威布尔方程拟合参数比较 不同释放介质中的平均累积释放百分数带入威布尔(Weibull)概率分布函数表达式提取参数m(形态参数)、T50(释放50%所需的时间)、Td(释放 63.2%所需的时间),结果见表7。对所得参数T50、Td分别与达美康进行t检验。 从表7中可以看出,在pH 7.4 PBS中,B-2厂家产品与达美康T50、Td有显著差异(P<0.01),其余无明显差异(P>0.05);在pH 4.5 PBS中,所有厂家产品与达美康T50、Td的P均小于0.05,有差异;在蒸馏水中,B-2、E和F厂家与达美康T50、Td无明显差异(P>0.05),其余厂家有明显差异(P<0.01)。综上,D、E和F厂家产品与达美康T50,Td差异较小。 A厂家两批产品A-1与A-2在pH 7.4 PBS和pH 4.5 PBS中,T50、Td与达美康无明显差异(P>0.05),在蒸馏水中有显著差异(P<0.01)。 表6 6个不同厂家格列齐特缓释片在不同介质中的溶出参数(%)(n=6,)Tab6 Dissolution degreesparametersofgliclazid sustained-release tabletsof6manufacturesin 3 differentdissolutionmedium s(%)(n=6) 表6 6个不同厂家格列齐特缓释片在不同介质中的溶出参数(%)(n=6,)Tab6 Dissolution degreesparametersofgliclazid sustained-release tabletsof6manufacturesin 3 differentdissolutionmedium s(%)(n=6) 与达美康比较**0.01 参数 达美康 A-1 A-2 B-2 C D E F PBSpH7.4 m 1.42±0.04 1.34±0.03 1.33±0.02 1.29±0.09 1.20±0.10 1.21±0.03 1.04±0.05 1.15±0.04 T50/h 4.17±0.18 4.32±0.10 4.32±0.19 3.87±0.16***4.87±0.98 4.68±0.26 4.98±1.06 4.32±0.27 Td/h 5.41±0.26 5.67±0.15 5.69±0.27 5.15±0.19***6.73±1.60 6.51±0.36 7.18±1.38 5.95±0.43 m 1.51±0.07 1.14±0.04 1.44±0.05 1.05±0.04 1.39±0.03 1.43±0.04 1.26±0.05 1.45±0.05蒸馏水 T50/h 5.36±0.62 3.56±0.30*** 4.31±0.46*** 6.38±0.21 4.79±0.35*** 4.90±0.38*** 5.17±0.67 5.09±0.18 Td/h 6.84±0.86 4.57±0.41*** 5.57±0.64*** 9.05±0.32 6.24±0.47** 6.37±0.53** 6.91±0.84 6.55±0.27 PBSpH4.5 m 1.32±0.04 1.22±0.05 1.25±0.05 1.21±0.10 1.23±0.09 1.05±0.07 1.24±0.02 1.26±0.05 T50/h 10.81±0.48 6.22±0.78*** 6.22±0.7*** 7.02±1.11***5.95±0.38*** 9.11±0.57*** 9.08±1.67** 7.94±0.89***Td/h 14.13±0.73 8.40±1.10*** 8.90±1.02*** 9.47±1.73***8.03±0.56*** 12.94±1.05*** 12.22±2.23*** 10.61±1.25*** 本研究的6个厂家产品虽均从市场流通环节获得,但仍不能排除因生产规模和生产工艺而造成的固体制剂的内在品质存在的差异。研究结果显示在pH 7.4 PBS和蒸馏水中,不同厂家的格列齐特缓释片释放曲线与达美康基本相似,而在pH 4.5 PBS中,各厂家样品的释放曲线与达美康体现出明显的差异。 释放曲线相似因子和释药机制的综合比较显示,在3种不同释放介质中,由于原研药达美康的释药机制为骨架溶蚀且n值大于1,市售产品的n值较小,越接近或小于0.84时,就可能表现出扩散与骨架溶蚀机制相结合的释药机制,与达美康差异越大,相似因子就会偏低,甚至小于50。综合比较,只有D厂家与原研药达美康在3种不同释放介质中与达美康释放机制相似且相似因子均大于50。6个厂家产品在pH 4.5 PBS差异体现最为明显。释放程度偏大是所有厂家产品共同的问题。威布尔函数参数的综合比较显示,D、E和F厂家与原研药达美康在3种不同释放介质中溶出参数与达美康差异较小。 B-1厂家药片外观检查不合格,判断可能是由于包装材料不合格造成的。A厂家两批产品相似因子、溶出参数、释药机制参数的比较均显示在pH7.4 PBS和pH4.5 PBS中无明显差异,在蒸馏水中有显著差异,说明A厂家产品批间存在差异。 溶出度是评价口服固体药物制剂内在品质优劣的核心技术所在,由于与生物利用度密切相关,故提高溶出度要求,可大大提高在各种人群体内的生物利用度,从而促进制药企业在科研、技术人员上的投入,使得安全、有效、技术含量高的产品充分占领市场。日本、美国已先后推出日本参比制剂目录、固体制剂溶出曲线数据库来提高仿制药的内在品质,使仿制药具有与原创药相同的生物等效性。因此通过国家药品审评部门加大对溶出度试验的审评力度并逐步提高标准,与国际接轨,可促进我国药品生产工艺的提高,推动药品生产企业对制剂工艺的深入研究,带动药学高等教育的发展,同时拉动我国药用辅料行业、制药机械设备等行业的发展和进步,并对药品研发公司的整合、企业兼并的市场行为也必将具有积极的促进作用。 [1]卢骏,吴涛,胡建平,等.格列齐特缓释片的制备及体外释放度[J].中国医药工业杂志,2004,35(7):410 [2]谢沐风.如何科学、客观地制订溶出度试验质量标准[J].中国医药工业杂志,2012,43(3):A23 [3]张启明,谢沐风,宁保明,等.采用多条溶出曲线评价口服固体制剂的内在质量[J].中国医药工业杂志,2009,40(2):308 [4]国家食品药品监督管理局标准.YBH03642006格列齐特缓释片[S] [5]Shah V P,Tsong Y,Shathe P,etal.In vitro dissolution profile comparision-statisticsofthesimalarity factor,f2[J].PharmaceutRes,1998,15(6):8891 [6]王志强,吴继禹,张秀华.用Excel软件对溶出数据进行多种曲线拟合和处理[J].海峡药学,2006,18(1):47 [7]张莉,夏运岳.用电子表格Excel计算药物溶出度Weibull分布参数[J].药学进展,2002,26(1):8 [8]刘瑞新,李学林,王青晓.威布尔溶出曲线的4种非线性拟合方法比较[J].中国医院药学杂志,2009,29(15):1315 [9]方积乾.卫生统计学[M].第6版.北京:人民卫生出版社,2008:105-105 [10]陈健,朱盛山,蔡延渠,等.口服缓控释制剂数学模型研究概述[J].中草药,2011,42(8):16252 结果



3 讨论

