农业院校化学制药工艺学案例教学
郝双红等


【摘要】本文以新型高效除草剂烟嘧磺隆为例,结合文献及作者研究,从化学制药工艺学案例教学角度,提出了该药工艺路线设计及选择思路,并对其工艺原理及过程进行了解释,同时绘制了工艺流程,相关内容为农业院校化学制药工艺学案例教学提供了一个范例。
【关键词】化学制药工艺学 烟嘧磺隆 合成工艺 案例教学
【中图分类号】G64 【文献标识码】A 【文章编号】2095-3089(2015)10-0164-02
“化学制药工艺学”是制药工程专业的一门核心课程,目前常见教科书有赵临襄和王亚楼分别编写的《化学制药工艺学》两个版本、以及元英进和王效山等分别编写的《制药工艺学》两个版本。上述教材中化学药物合成实例都是常见药物如奥美拉唑、氯霉素等,这对培养学生制药工艺研究素养具有重要意义。我国有一部分制药工程专业设置在农业院校[1],其学科基础是农药学,对我国农药制药人才培养具有重要作用。目前这些专业“化学制药工艺学”教学缺乏农药实例,难以满足农药特色教学需求。虽然有介绍农药生产技术的著作如《农药生产与合成》等,但其大多以工具书的形式编写,具体实例理论知识较少,如缺乏合成路线设计及选择、合成工艺原理及工艺过程研究等,作为教学内容感觉不足。烟嘧磺隆(下图结构Ⅰ)是一种高效低毒磺酰脲类除草剂[2],其结构特征性强,使用广泛。作者在自己前期研究的基础上,结合文献,介绍其合成工艺知识,这可为农药特色制药工艺学教学提供一个范例。
1.工艺路线的设计与选择
根据药物结构剖析原则[3],(1)烟嘧磺隆结构左边为吡啶环,中间为磺酰脲,右边为嘧啶环。(2)吡啶环3-位酰胺基是易拆键,2-位磺酰基左边连接吡啶环,右边是磺酰胺键,都是易拆键。嘧啶环2-位脲键是易拆键。(3)常见吡啶衍生物较多,有烷基吡啶、氯代吡啶等,可以选择合适吡啶衍生物通过官能团转化来构建。嘧啶环衍生物较少,可供选择的嘧啶环原料不多,可通过反应构建;该嘧啶环右边含丙二酸二甲酯结构,左边含脲结构,不难设计其合成方案。
根據上述结构解析,烟嘧磺隆结构构建思路如下:(1)吡啶环3-位酰胺可以通过烟酸经烟酰氯与二甲胺反应制备。(2)吡啶环2-位磺酰基易让人联想到磺化反应,但其亲电取代反应类似于硝基苯,再加上3-位酰胺基吸电作用,磺化反应只能发生在β位(即5-位)上;同理,吡啶2-位电子云密度较小(2-氯吡啶与2-硝基氯苯相似),易与亲核试剂作用,可以2-氯吡啶先与Sx-反应,引入硫原子后再氧化成磺酰基。(3)磺酰脲从左至右可以依次看作磺酰胺、酰胺结构,磺酰胺可通过磺酰氯与氨基反应制备,脲可以通过氨基与光气或碳酸二酯反应,也可以通过氨基与异氰酸酯加成制备。(4)嘧啶环3-位含有氨基,可以通过胍与丙二酸酯缩合一步形成。
从上述逆合成分析可以看出,烟嘧磺隆的合成可以分4步完成。第一步,先由2-氯烟酸制得2-氯烟酰氯,再与二甲胺反应制得N,N-二甲基-2-氯烟酰胺(Ⅳ);第二步,(Ⅳ)先经巯基化反应制得N,N-二甲基-2-巯基烟酰胺,巯基再经氯磺化、磺酰胺化制得N,N-二甲基-2-氨基磺酰基-烟酰胺(Ⅲ);第三步,(Ⅲ)再转化为较活泼的N,N-二甲基-2-烷氧甲酰基氨基磺酰基-烟酰胺(Ⅱ);第四步,Ⅱ再与氨基嘧啶缩合得烟嘧磺隆(Ⅰ)。
2.N,N-二甲基-2-氯烟酰胺的合成
2.1工艺原理及过程
2.1.1 工艺原理
羧酸常见酰氯化试剂[5]有:卤化磷(PX3、PX5、POX3)和SOX2,五氯化磷活性高,适于具吸电子基芳酸的反应,反应会生成POCl3,需分馏除去,要求与产物沸点有较大差距。三氯化磷和POCl3活性依次减弱,适用于脂肪酸和活性更高的羧酸盐反应制备酰氯。氯化亚砜是最常用而有效的试剂,它沸点低、易蒸馏回收,反应生成的二氧化硫和氯化氢易逸去,反应无残留副产物。
用羧酸和氯化亚砜制备酰氯,羧酸中羟基上的氧首先进攻氯化亚砜中的硫原子,形成中间体,接着另一个氯原子进攻羰基碳,生成酰氯[4]。二甲胺是一个强亲核试剂,首先进攻羰基碳形成四面体结构中间体,然后发生电荷转移,生成酰胺。
2.1.2工艺过程
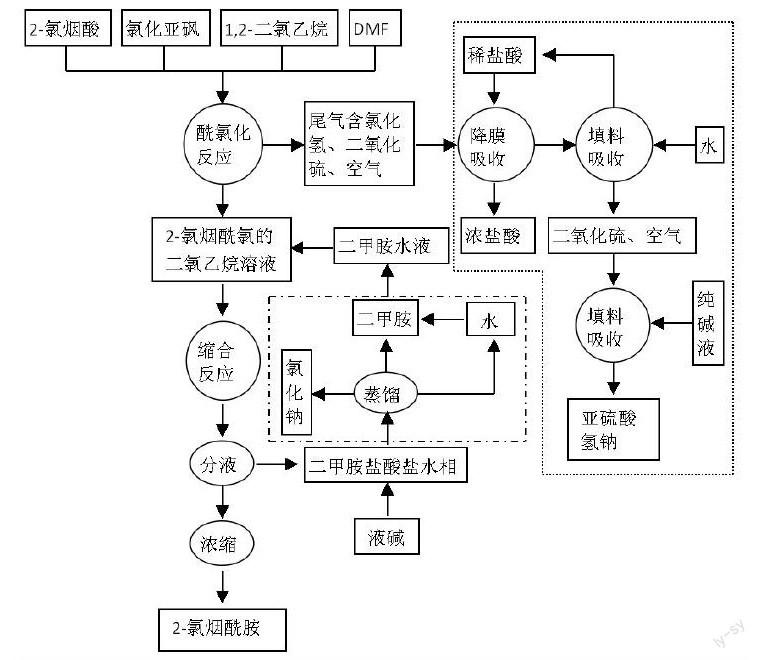
将2-氯烟酸、稍过量氯化亚砜、催化量DMF及1,2-二氯乙烷悬浮体系在干燥环境下搅拌加热回流,直至2-氯烟酸完全转化酰氯。(注:反应中有大量酸性气体SO2和HCl产生,需分离吸收)取过量二甲胺水溶液,冰浴冷却至5 ℃以下,搅拌下将上述酰氯二氯乙烷溶液滴入其中,控制过程温度低于5 ℃。滴完后,反应混合物自然升至室温,继续搅拌1h。分出有机相,减压浓缩,回收二氯乙烷套用。水相含大量二甲胺盐酸盐,需回收利用。[6]
2.2 反应条件及影响因素
2.2.1物料配比及浓度
物料配比对可逆反应、平行反应等影响较大,会影响反应方向、选择性及收率,需根据反应具体情况选择合适配料比。酰氯化反应简单,在适宜反应条件下基本无副反应,2-氯烟酸价格较高,要尽量使其完全转化,另氯化亚砜遇水易分解,故配料比要大于理论值。文献[6]中氯化亚砜既是反应物,又兼做溶剂,使用量3:1(氯化亚砜:2-氯烟酸)。酰胺化反应会生成一分子氯化氢,其也会与二甲胺反应,故二甲胺需2倍量以上,文献[6]使用量2.5:1(二甲胺:2-氯烟酰氯),消耗量较大,这会增加成本及三废处理负担,可加入适量氢氧化钠等缚酸剂替代二甲胺与氯化氢反应。
2.2.2 溶剂
氯化亚砜氯化反应可用石油醚、苯类、二硫化碳、氯代烃等溶剂。本反应原料2-氯烟酸活性较弱,反应需在较高温度下进行,选择溶剂时要考虑溶剂沸点。文献[6-8]选择氯化亚砜兼做溶剂,或以氯仿、甲苯作溶剂。以氯化亚砜兼做溶剂,减少了物料种类,但消耗量增加;氯仿沸点较低,反应温度受到限制,反应耗时较长;用甲苯作溶剂,反应温度较高,反应时间可缩短。
為避免酰氯水解,应选择对酰氯溶解度大且不溶于水的有机溶剂,文献有使用甲苯或二氯甲烷作溶剂的。由于酰氯不稳定,可将酰氯化与酰胺化连起来进行,如选择甲苯或1,2-二氯乙烷作溶剂,使用稍过量氯化亚砜,酰氯化结束后,直接将其滴入二甲胺水溶液,或向其中通入二甲胺气体,这样可简化第一步后处理步骤。
2.2.3 催化剂
吡啶、DMF、ZnCl2等都可作为氯化亚砜酰氯化的催化剂,吡啶有恶臭味,氯化锌易潮解,DMF是常用溶剂,性质稳定,水溶性强,反应后易水洗除去。作者研究发现,用DMF作催化剂,在二氯乙烷中加热回流,反应体系约20min即可澄清(表明反应基本进行完全),无催化剂反应则需要3-4h。
2.2.4温度
2-氯烟酸为具吸电子取代基的芳香羧酸,氯代反应活性较弱,反应需在较高温度下进行,文献工艺在氯化亚砜(bp 79 ℃,反应时间4h)、氯仿(bp 61 ℃,反应时间6h)或甲苯(bp 110 ℃,催化下反应时间2h)中回流,反应温度高,反应速度快。酰氯酰胺化反应较容易,该反应为放热反应,为了避免酰氯水解等副反应发生,反应过程需在较低温度下进行(低于5℃)。
2.2.5反应终点判定
酰氯化反应中,如选择1,2-二氯乙烷作溶剂,2-氯烟酸在其中溶解度较小,反应开始时为悬浮体系;产物2-氯烟酰氯溶解度大,随着反应进行,悬浮物逐渐减少,反应接近完成时,反应液澄清。也可用硅胶薄层检测,2-氯烟酸极性强于2-氯烟酰氯,比移值较小,用二氯甲烷:甲醇(15:1)展开,紫外灯(254 nm)下观察,如果体系中2-氯烟酸消失,表明反应结束。
2.2.6注意事项
氯化亚砜及产物酰氯均易水解,反应过程及后处理应尽量保持物料处于干燥状态。酰氯易水解,为了保证和二甲胺反应,需将酰氯二氯甲烷溶液滴入二甲胺水溶液中,不能颠倒加料顺序,这样可保证二甲胺始终处于过量状态,降低了酰氯水解机会。
2.2.7存在问题及解决方法
用氯化亚砜氯化,会生成二氧化硫和氯化氢混合气体,这两种气体均呈酸性,对设备及环境影响较大,需回收处理。理论上讲,反应生成的二氧化硫和氯化氢的摩尔比为1:1,要回收利用,需将二者分离处理,比较麻烦。
三光气[CO(OCCl3)]化学名称二(三氯甲基)碳酸酯,熔沸点较高,毒性低,反应条件温和,选择性强,使用方便,可替代光气发生多种反应,其中酰氯化反应生成副产物为氯化氢和二氧化碳,直接用水吸收可得盐酸溶液,后处理简单[9]。作者以固体光气为氯化试剂,摸索了将2-氯烟酸制成2-氯烟酰氯的工艺,反应收率可达94%,纯度99%。
2.3 三废及治理
第一步反应生成二氧化硫和氯化氢气体混合物,专利[10]利用二者在水中溶解度不同,先用水吸收氯化氢制备盐酸,再用碳酸钠溶液吸收二氧化硫制备亚硫酸氢钠。第二步反应结束,有机相浓缩回收二氯甲烷,下次反应套用;水相含二甲胺及二甲胺盐酸盐,用烧碱碱化后蒸馏,可回收套用,废水蒸馏,回收氯化钠,水可套用。
2.4 工艺流程
参考文献:
[1]郝双红, 赵传德. 农业院校制药工程专业建设浅见, 考试周刊, 2009. (37):67-68
[2]翁建全,谭成侠,沈德隆. 高效除草剂烟嚓黄隆的合成综述.2003,34(4):5-6
[3]赵临襄.化学制药工艺学.北京:中国医药科技出版社,2003,14
[4]邢其毅, 裴伟伟, 徐瑞秋, 裴坚. 基础有机化学(第二版). 北京: 高等教育出版社, 1997, 591
[5]闻韧.药物合成反应(第二版). 北京:化学工业出版社, 2003,40
[6]杨荣国. 超高效磺酰脲类除草剂烟嘧磺隆的合成研究. 杭州: 浙江工业大学, 2006
[7]李翔,王耀良,张海虹,朱新荣,朱长武. 烟嘧嘧隆的合成. 现代农药,2006,5(3):13-16
[8]孙健,彭学伟. 烟嘧磺隆中间体2-氨基磺酰基-N,N-二甲基烟酰胺的合成研究. 化学与生物工程,2011,28(9):47-48
[9]邢凤兰,徐孙见,徐群.三光气法合成丙酰氯的研究,精细与专用化学品,2006,14(13):14-15,25
[10] 褚平忠,孟云龙.一种氯化氢和二氧化硫混合气体的分离回收方法,CN201110316612,2011.10.18

