反胶束固定化醇脱氢酶的制备及应用研究
柳畅先*, 何进星
(中南民族大学化学与材料科学学院,分析化学国家民委重点实验室,湖北武汉 430074)
反胶束是表面活性剂分散于连续有机相中自发形成的与正常胶束结构相反的一种含水聚合体。研究者在酶的分离纯化和固定化方面进行了深入探讨,发现反胶束体系能较好地模拟酶的天然环境,因而大多数酶能保持活性和稳定性[1]。反胶束体系在酶的定位和结构[2,3]、动力学特征[4,5]、催化活性[6 - 9]等方面的理论研究,进一步拓宽了反胶束技术的应用领域。Kamyshny等[10]用乙基己基琥珀酸酯磺酸钠(AOT)-辛烷反胶束体系固定化葡萄糖氧化酶,研究显示酶在反胶束溶液中的活力和稳定性远大于水溶液,且活力决定于含水量。Hirakawa等[11]用AOT-异辛烷反胶束体系固定化酵母醇脱氢酶,发现该体系可增加酶的稳定性,并延长辅酶的再生使用寿命。
作者曾经以十六烷基三甲基溴化铵(CTAB)-辛烷-己醇反胶束体系分离纯化醇脱氢酶(ADH)[12]。本文从酶法测定的角度探讨以该体系固定化ADH,考察了含水量、表面活性剂和助溶剂用量对于ADH固定化的影响,并对游离酶和固定化酶进行催化动力学性质研究。应用该体系测定了试样中微量组分。
1 实验部分
1.1 仪器与试剂
UV1100紫外可见分光光度计(北京瑞利分析仪器公司);FA2004分析天平(上海精科天平);pHS-3C精密pH计(上海雷磁仪器厂);WH-1微型旋蜗混合仪(上海沪西分析仪器厂);CS-501恒温水浴槽(重庆银河实验仪器有限公司)。
乙醇标准溶液(1.7 mol/L,用99.7%的无水乙醇配制),ADH(Sigma公司),氧化型烟酰胺腺嘌呤二核苷酸(NAD,上海伯奥生物科技有限公司),CTAB(国药集团化学试剂有限公司),辛烷(国药集团化学试剂有限公司),己醇(天津市博迪化工有限公司),三羟甲基氨基甲烷(Tris)-HCl缓冲溶液(0.05 mol/L)。
1.2 实验方法
1.2.1反胶束固定化ADH的制备于锥瓶中加入0.6 g CTAB,再加入己醇、辛烷共5.0 mL,然后边振荡边加入含有乙醇标准溶液和ADH的缓冲液,最终形成均一透明的反胶束固定化ADH溶液。
1.2.2酶活力及底物浓度的测定于比色皿中加入3.0 mL反胶束溶液,20 μL 0.2 mol/L NAD溶液,混匀后立即在340 nm处测定吸光度变化值,计算酶活力:v=△A×V/(△t×ε×b)。式中,v为酶活力(酶促反应速度,μmol/min或U);△A为吸光度变化值;V为反应液体积(mL);△t为时间变化值(min);ε为摩尔吸收系数(L/(mol·cm));b为光程(cm)。相对酶活力=(酶活力/酶活力最大值)×100%。
根据米氏方程可求出底物浓度:1/v=Km/vmaxc+1/vmax。式中,v为酶促反应速度(μmol/min);Km为米氏常数(mmol/L);vmax为最大酶促反应速度(μmol/min);c为底物浓度(mmol/L)。
2 结果与讨论
2.1 反胶束固定化酶体系的形成条件
含水量(W0)是反胶束体系中的重要参数,决定反胶束水池的大小和性质,且导致酶活力的变化。当W0值较小时,酶不能充分水化,所以酶活力较低;当W0值过大时,可能是由于胶束液滴中的水量增大,酶的构象变化,不适于底物的结合,使酶活力下降。增加表面活性剂CTAB的浓度可以增加反胶束的数量和体积,增大对ADH的溶解能力,使ADH更多地进入反胶束。但CTAB浓度过大时,可能在溶液中形成较复杂的聚合体,对蛋白质的作用力减弱,而使ADH进入反胶束的量减少。CTAB为单链阳离子表面活性剂,其非极性尾部较双链表面活性剂小,所以需要加入助溶剂己醇才能形成稳定的反胶束溶液。但随着己醇含量的增加,反胶束中ADH活力逐渐降低,可能是己醇量过大使酶失活所致。固定化最佳条件为:W0=13,CTAB浓度0.35 mol/L,己醇浓度13%,见图1。

图1 含水量(a)、CTAB浓度(b)和己醇浓度(c)对酶固定化的影响Fig.1 Effects of W0,(a) concentraction of CTAB (b) and hexanol (c) on the immobilization of ADH
2.2 酶学性质
2.2.1溶液pH值和温度对酶活力的影响在不同pH值的水溶液和反胶束溶液中分别对游离酶和固定化酶活力进行测定,由于反应介质不同,会影响酶活性部位中重要基团、酶-底物复合物以及底物的解离状态,从而影响酶活力的变化范围,游离酶和固定化酶动力学反应的最适宜pH值分别为8.2和8.8,见图2。可看出固定化酶对pH的变化很敏感,但只需在酶法测定时控制好测定条件就能得到准确结果。在温度5~50 ℃范围内测定温度对酶活力的影响。如图3所示,游离酶和固定化酶随温度变化的趋势相似,即随温度升高酶的活力增大,温度过高时则酶变性使其活力降低,但变化的温度范围不同,游离酶和固定化酶的最适反应温度分别为31 ℃和20 ℃,与游离酶相比,固定化酶适宜于在较低的温度范围内进行催化反应。

图2 pH对酶活力的影响Fig.2 Effect of pH on the enzymatic activity1.free enzyme;2.immobilized enzyme.
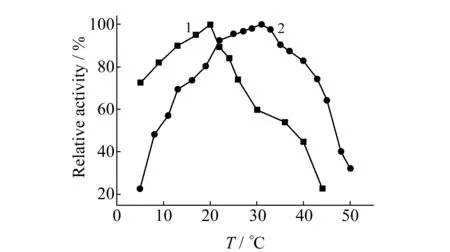
图3 温度对酶活力的影响 Fig.3 Effect of temperature on the enzymatic activity 1.immobilized enzyme;2.free enzyme.
2.2.2米氏常数以乙醇为底物,在游离酶和固定化酶的最适条件下测定酶促反应速度,绘制Lineweaver-Burk曲线,测出游离酶和固定化酶的米氏常数(Km)分别为12 mmol/L和7 mmol/L,见图4。Km是反映酶与底物结合力的参数,Km越小则酶与底物亲和力越大。固定化以后酶的Km减小,表明酶和底物的亲和力有所增加,有利于其进行酶促反应,若采用速度法测定底物含量,Km越小,保持一定的初始速度所需酶量越少。
2.2.3酶的活力稳定性在温度10 ℃、30 ℃及最佳介质条件下测定了游离酶和固定化酶的活力稳定性。由图5所示,30 ℃下游离酶150 min后失活90%,固定化酶失活50%,可见ADH在反胶束中较稳定。这是由于反胶束能更好地模拟酶的天然环境,所以能较好地保持酶的活性和稳定性。但过高的温度会破坏反胶束,使固定化酶失活很快。因此,在常温下用反胶束固定化酶进行酶法测定是可行的。
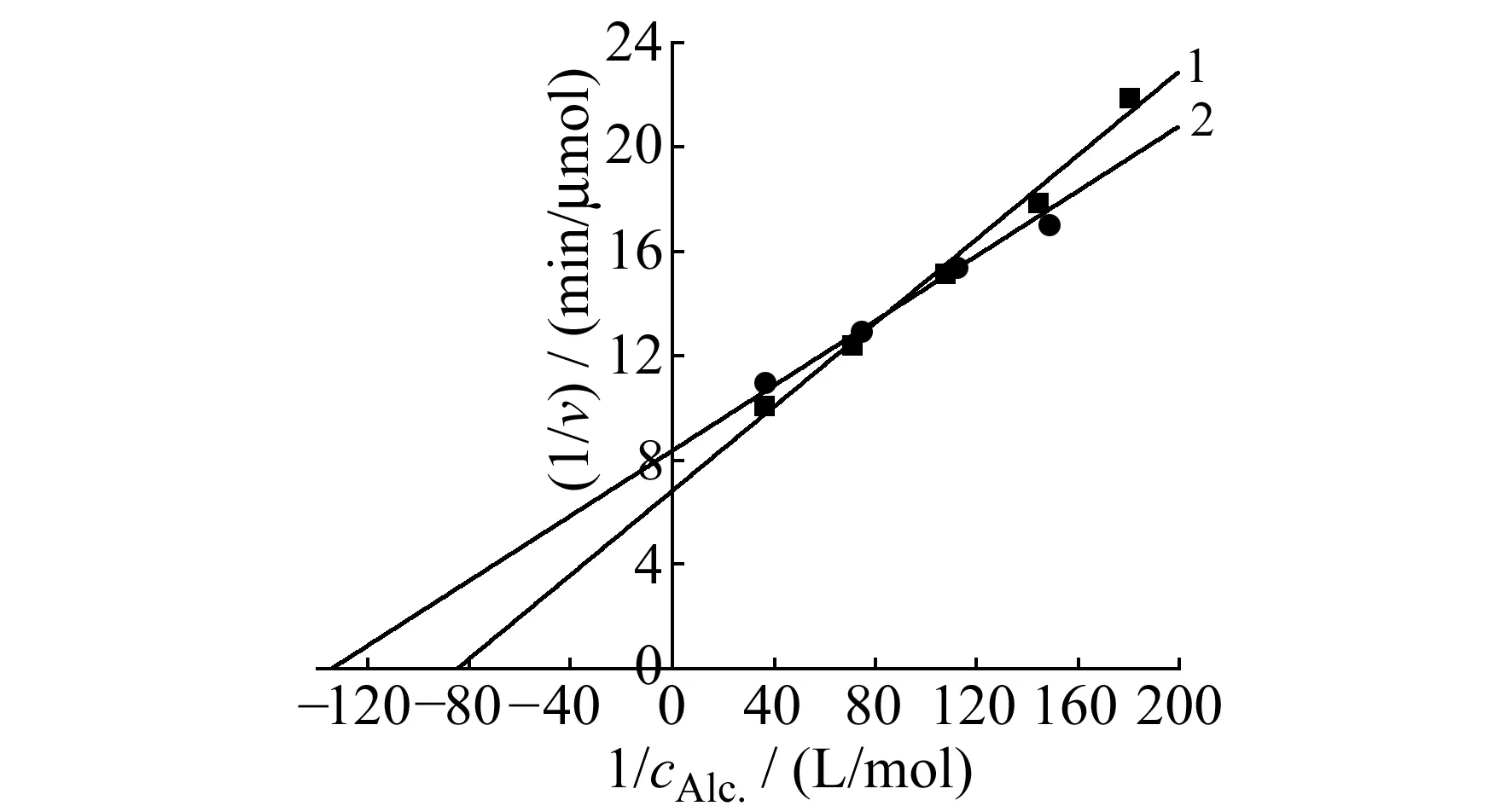
图4 Lineweaver-Burk曲线Fig.4 Lineweaver-Burk curves1.free enzyme;2.immobilized enzyme.
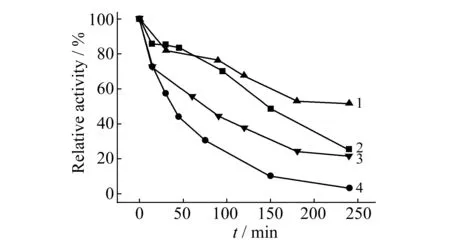
图5 酶的活力稳定性 Fig.5 The active stability of enzymes 1.immobilized enzyme,10 ℃;3.free enzyme,10 ℃; 2.immobilized enzyme,30 ℃;4.free enzyme,30 ℃.
2.3 用固定化酶进行试样测定

2.3.2标准曲线按实验方法测出乙醇标准溶液的酶促反应速度,绘制1/v~1/c标准曲线,在2.5~57 mmol/L范围内具有线性关系。回归方程为:1/v=1.05/c+2.80,r=0.9954。检出限为13 μmol/L。
2.3.3试样测定及加标回收测定了小牛血清试样中乙醇的含量,并进行加标回收,结果见表1。
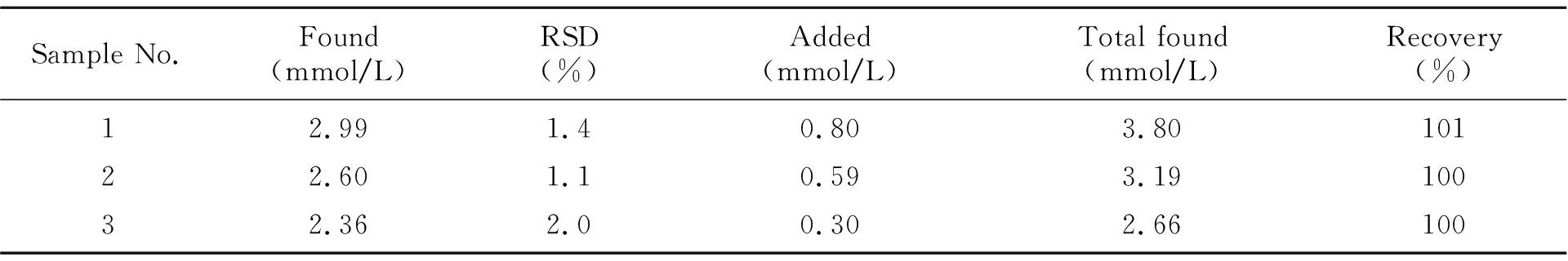
表1 试样测定及加标回收结果(n=5)
3 结论
由实验结果可知酶的最佳固定化条件为:含水量13,CTAB浓度0.35 mol/L,己醇浓度13%。对游离酶和固定化酶的催化动力学性质研究表明:游离酶与固定化酶的最适反应pH分别为8.2与8.8,最适宜的反应温度分别为31 ℃和20 ℃。由Lieweaver-Burk曲线测出游离酶和固定化酶的米氏常数分别为12 mmol/L和7 mmol/L。在30 ℃及最佳介质条件下测定了游离酶和固定化酶的活力稳定性,游离酶存放150 min失活90%,而固定化酶失活50%,可见ADH在反胶束中更稳定。

