玉米麸皮多糖对人结肠癌HT-29细胞增殖的抑制作用
徐伟丽,崔鹏举,鲁兆新,张兰威
(哈尔滨工业大学食品科学与工程学院,150090哈尔滨)
玉米生产加工过程中会产生大量的副产物玉米麸皮,其得率约为玉米原料量的10%~15%.因此,由玉米麸皮制备的多糖备受关注.目前,对于玉米麸皮多糖的研究主要集中于制备方法、降血糖、减肥降脂、抗便秘作用等[1-4].有研究表明玉米皮多糖还可作为治疗结肠癌的辅助手段[1],但是还不清楚其确切的分子机制.本研究探讨了玉米麸皮多糖体外对结肠癌HT-29细胞的抑制作用,为进行下一步的机制研究提供实验依据,为开发肿瘤化学预防剂和保健食品的新资源奠定了理论基础.同时,促进了玉米加工副产物的深度开发利用,对于合理利用粮食资源、全面提高玉米加工产业的社会及经济效益有重要意义.
1 实验
1.1 实验材料
人结肠癌HT-29细胞购自协和医科大学基础所细胞中心.玉米麸皮多糖:以玉米麸皮为原料,采用超临界方法去除玉米麸皮中的油脂,采用淀粉酶、蛋白酶去除玉米麸皮中的淀粉、蛋白质.以水为提取溶剂,提取玉米麸皮多糖,滤液低温减压浓缩,醇沉,得水提玉米麸皮多糖.以水提后的水不溶物为原料,分别采用碱液和碱性过氧化氢溶液为提取剂,中和滤液,低温减压浓缩,醇沉,得碱提玉米麸皮多糖和碱性H2O2提玉米麸皮多糖.
1.2 实验试剂
四氮唑蓝(MTT)、RNA 酶、HEPES、DMSO、丙烯酰胺(Sigma Aldrich,美国);L-谷氨酰胺(原平皓公司,中国);RPMI 1640培养基、小牛血清(Gibco公司,美国);Giemsa Stain(Amresco,美国);其余试剂均为分析纯.
1.3 实验仪器
Labo AutoCLAve高压灭菌器、Program Oven干热灭菌箱,日本SANYO公司;IX70倒置显微镜,日本Olympus公司;ELX800酶标仪,Bio-Tek公司;MODEL 5410 CO2培养箱,NAPCO公司.
1.4 细胞培养和处理
HT-29细胞在含有1%谷氨酰胺、10%胎牛血清的RPMI 1640完全培养液中,于37℃、5%的CO2培养箱中常规培养,用0.02%EDTA/0.25%胰酶消化后进行传代,取对数增殖期的细胞用于实验.
对3种方法得到的玉米麸皮粗多糖(水提、碱提和碱性H2O2提玉米麸皮多糖)进行体外抗肿瘤作用研究.将多糖用改良型RPMI-1640培养液分别配制成10 g/L的溶液,0.22 μm滤膜过滤除菌,密封并于-20℃下保存,备用,使用时用培养基稀释到所需质量浓度.根据预实验结果确定用于培养人结肠癌HT-29细胞的水提玉米麸皮多糖为 0.01,0.02,0.03,0.04,0.05,0.10 g/L 6个剂量组,碱提和碱性H2O2提玉米麸皮多糖为0.02,0.10,0.50,2.50,10.00 g/L 5 个剂量组,肿瘤细胞加培养液为对照组.
1.5 细胞毒性检测
细胞毒性参考文献[5]进行检测.取对数生长期HT-29细胞,用含10%胎牛血清的RPMI 1640培养液制成2.5×104mL-1的单细胞悬液,接种于96孔板中,每孔5×103个细胞.另设对照组.置于37℃、5%CO2培养箱中培养24 h后,换成含不同质量浓度玉米麸皮多糖的培养液,从加药第1天起,每天各取1块96孔板进行MTT检测,连续2 d,测出OD值.检测玉米麸皮多糖对HT-29细胞生长的抑制情况及IC50.
1.6 细胞形态学观察
将细胞接种于培养瓶中,待细胞贴壁并达40%以上融合时,分别更换含有不同质量浓度玉米麸皮多糖的培养液,继续培养指定的时间.在Olympus相差倒置显微镜下观察细胞的形态变化,并进行拍照.
1.7 细胞核分裂指数
细胞核分裂指数参考文献[5]进行检测.将HT-29细胞接种于24孔培养板内,每孔1.0×104个细胞,每个剂量4个平行孔.细胞贴壁后,更换含不同质量浓度玉米麸皮多糖的无血清培养液,分别培养24,48 h后,75%乙醇固定,Giemsa染色(称Giemsa粉末0.5 g,加几滴甘油研磨,再加入甘油33 mL.56℃保温90~120 min.加入33 mL甲醇,置棕色瓶中保存,此为Giemsa原液.按要求用PBS稀释10倍使用).计数1 000个细胞中所含分裂相的细胞数,求出分裂指数,并与对照组比较,计算抑制率.
分裂指数=分裂细胞数/细胞总数×100%;抑制率=(1-给药组分裂指数/对照组分裂指
数)×100%.
1.8 集落形成实验
集落形成实验参考文献[5]进行.常规培养细胞,将HT-29细胞接种于24孔培养板内,每孔200个细胞,每组4个平行孔.培养24 h后更换含不同质量浓度玉米麸皮多糖的培养液,再分别培养24和48 h后,换正常培养液继续培养10 d,甲醇固定,Giemsa染色,镜下计数每孔>50个细胞以上的集落数目,按下式计算:
集落形成率(%)=(每皿集落数/每皿接种细胞数)×100;
集落形成抑制率(%)=(1-加药组集落形成率/对照组集落形成率)×100.
1.9 统计分析
采用SPSS 13.0软件进行统计分析,组间差异采用方差分析进行处理,P<0.05表示差异具有统计学意义.
2 实验结果
2.1 玉米麸皮多糖对HT-29细胞的毒性作用
采用不同质量浓度的玉米麸皮多糖处理HT-29细胞24和48 h,结果如图1~3所示.随着水提玉米麸皮多糖质量浓度的增加和作用时间的延长,HT-29细胞的存活率呈下降趋势(图1).0.01 g/L的水提玉米麸皮多糖处理24 h,HT-29细胞的抑制率为6.9%,0.02 g/L的水提玉米麸皮多糖作用24和48 h对HT-29细胞抑制率分别为33.1%和60.6%,24 h的IC50值为0.053 g/L,48 h的IC50值为0.038 g/L.其他两种多糖处理24和48 h对HT-29细胞的毒性作用不显著(图2,3).
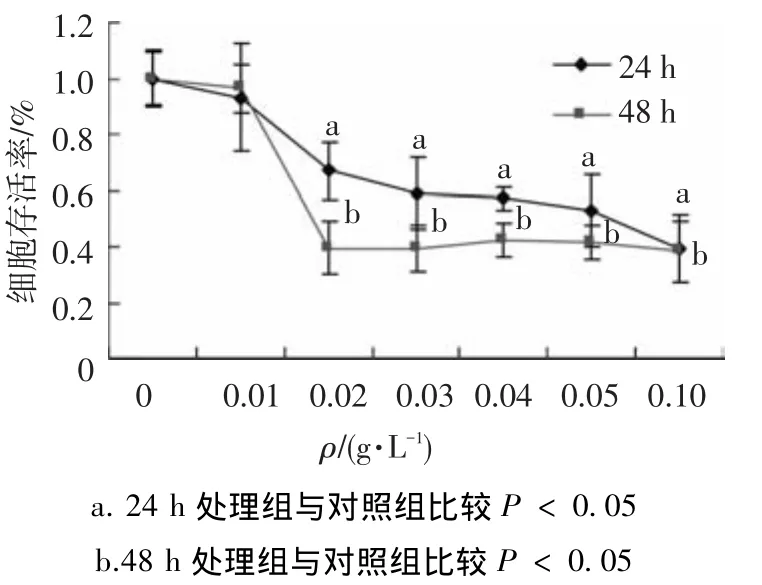
图1 水提玉米麸皮多糖对HT-29细胞存活的影响(x±s,n=5)
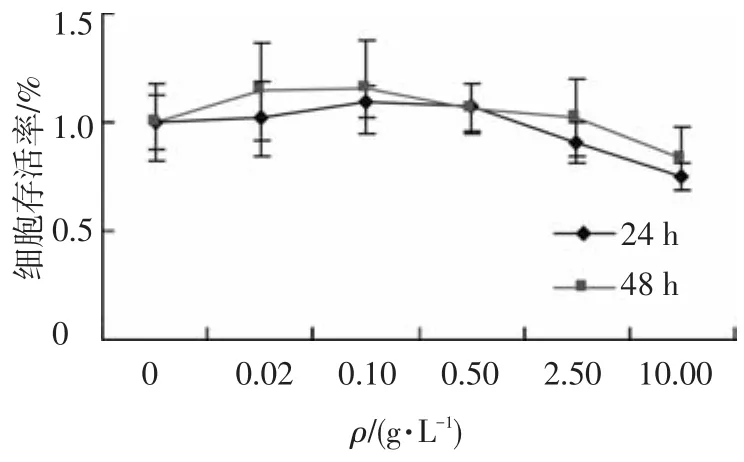
图2 碱提玉米麸皮多糖对HT-29细胞存活的影响(x±s,n=5)
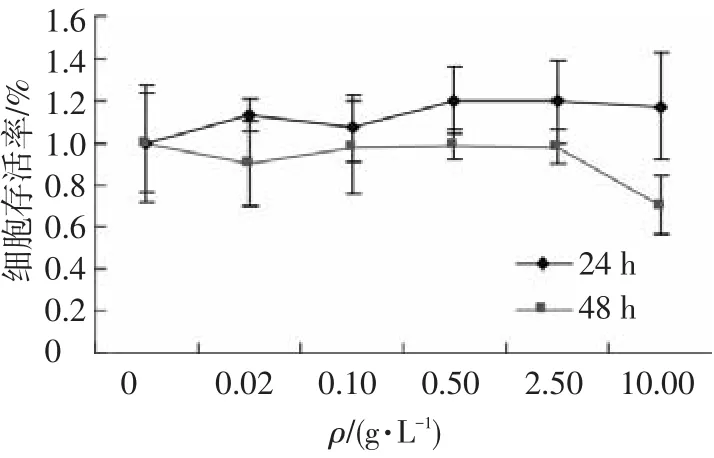
图3 碱性H2O2提玉米麸皮多糖对HT-29细胞存活的影响(x±s,n=5)
2.2 细胞形态观察结果
采用倒置显微镜观察不同方法获得的多糖对细胞形态的影响,结果如图4~6所示.对照组细胞形态正常,细胞呈菱形或不规则形,细胞体积大,生长紧密,细胞间隙小(图4(a));经过水提玉米麸皮多糖处理后,细胞体积和密度逐渐变小,附壁疏松、变圆.随着多糖处理时间的延长和质量浓度的增大,细胞贴壁能力明显下降,脱落增加,飘浮于培养液中,细胞破裂、坏死增多.在低质量浓度下(0.02 g/L)处理HT-29细胞96 h,细胞克隆形态多样,多数呈团块状、岛状或巢状,随时间的延长愈明显(图4(b)~(d)).碱提玉米麸皮多糖和碱性H2O2提玉米麸皮多糖 对HT-29细胞的抑制作用不明显,10 g/L处理96 h才表现出抑制作用,细胞形态略有变化(图5(f)和图6(f)).根据MTT实验和形态学观察结果,后面实验仅对水提玉米麸皮多糖进行检测.

图4 水提玉米麸皮多糖对HT-29细胞生长形态的影响(100×)
2.3 细胞核分裂指数结果
细胞核分裂指数结果见表1,不同质量浓度的水提玉米麸皮多糖处理24和48 h抑制率分别为9.0%~41.0%和19.8%~67.9%.随着剂量的增加和时间的延长,水提玉米麸皮多糖对细胞有丝分裂的抑制作用增强.
2.4 细胞的集落形成结果
细胞的集落形成结果见表2.水提玉米麸皮多糖各剂量组与对照组相比,对结肠癌HT-29细胞集落形成均有抑制作用,且随剂量的增加抑制作用增强.0.1 g/L的水提玉米麸皮多糖作用48 h,集落形成抑制率达88.1%.该结果显示水提玉米麸皮多糖能够有效抑制HT-29细胞的集落形成.

图5 碱提玉米麸皮多糖对HT-29细胞生长形态的影响(100×)

图6 碱性H2O2提玉米麸皮多糖对HT-29细胞生长形态的影响(100×)
表1 水提玉米麸皮多糖处理对HT-29细胞分裂指数的影响±s,n=4)
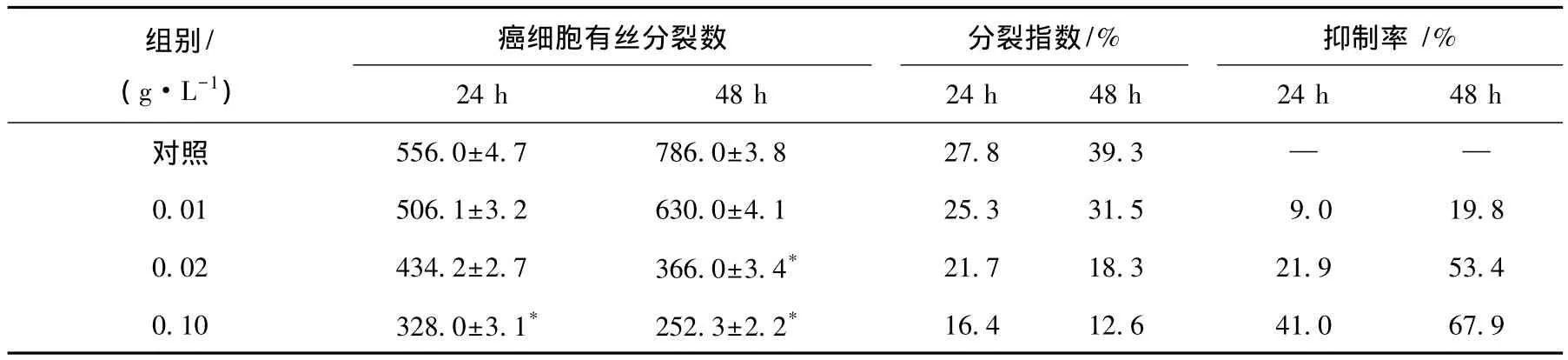
表1 水提玉米麸皮多糖处理对HT-29细胞分裂指数的影响±s,n=4)
* P<0.05与对照组相比.
组别/(g·L-1)癌细胞有丝分裂数24 h 48 h分裂指数/%24 h 48 h抑制率 /%24 h 48 h对照 556.0±4.7 786.0±3.8 27.8 39.3 — —0.01 506.1±3.2 630.0±4.1 25.3 31.5 9.0 19.8 0.02 434.2±2.7 366.0±3.4* 21.7 18.3 21.9 53.4 0.10 328.0±3.1* 252.3±2.2* 16.4 12.6 41.0 67.9
表2 水提玉米麸皮多糖处理对HT-29细胞集落形成能力的影响±s,n=4)

表2 水提玉米麸皮多糖处理对HT-29细胞集落形成能力的影响±s,n=4)
* P<0.05与对照组相比.
组别/(g·L-1)集落数/孔24 h 48 h集落形成率/%24 h 48 h抑制率/%24 h 48 h对照 28.5±4.0 29.6±3.3 15.1 15.9 — —0.01 22.0±3.1 18.1±2.1* 11.5 10.1 23.8 36.5 0.02 13.1±2.6* 9.7±1.1* 8.6 6.9 43.0 56.6 0.10 7.6±1.9* 4.6±1.3* 3.1 1.9 79.5 88.1
3 讨 论
流行病学统计表明[6-7]:全谷物食品中的多糖可以保护机体免受自由基的伤害,还可抵抗一些慢性疾病,如冠心病、糖尿病和癌症等.大多数动物实验和流行病学资料也表明,高纤维膳食可明显降低结肠癌的发病率[8].各种来源的纤维素都具有预防结肠癌的作用,半纤维素也有抗癌作用,但由于成分较复杂,目前对其单一成分的研究报道不多.玉米多糖包括玉米麸皮、玉米子粒、玉米须和玉米花粉多糖.玉米麸皮多糖因其制备原料丰富而备受关注,可将其作为保健食品或保健食品原料使用[9].
目前,关于玉米麸皮多糖的研究主要集中在提取[10-11]、纯化[12-14]、化学结构[14-16]及生理活性.国内外的研究已证实玉米麸皮多糖具有抑制肝损伤、减肥降脂、抗便秘及降血糖等生物活性[1-4].迄今为止,关于玉米麸皮多糖对肿瘤的抑制作用及其机制的研究均未见报道.
前期实验结果表明,水提玉米麸皮多糖具有良好的抗氧化活性,在一定质量浓度范围内,抗氧化性与质量浓度呈正相关;本研究中MTT实验表明,水提玉米麸皮多糖的抗增殖作用与质量浓度呈正相关,碱提法和碱性H2O2法提取的玉米麸皮多糖对HT-29细胞的毒性作用不明显.HT-29细胞经不同质量浓度(0,0.02,0.1,0.5,2.5 和10 g/L)的水提玉米麸皮多糖处理后,细胞生长缓慢,附壁疏松、变圆,细胞体积减小;经0.1 g/L以及高于此质量浓度的多糖处理后的HT-29细胞,镜下观察发现细胞脱落增加,飘浮于培养液中,细胞破裂、坏死增多.细胞发生这一系列变化可能与玉米麸皮多糖作用肿瘤细胞后,引起肿瘤细胞的细胞器和细胞膜的变化,如线粒体肿胀、糖原合成分泌增加有关.同时,水提玉米麸皮多糖能够抑制HT-29细胞有丝分裂数和集落形成率,并呈时间和剂量效应.综上,在抗氧化性和抗肿瘤作用方面水提玉米麸皮多糖均优于碱提法和碱性H2O2法提取的玉米麸皮多糖,这可能是由于在采用碱和/或碱性H2O2提取的过程中,多糖的某些功能部分的活性丧失或减弱,因此,拟采用水提玉米皮多糖进行后续实验.本研究为下一步对水提玉米麸皮多糖抑制HT-29细胞生长作用机理的研究奠定了实验基础.
[1]DAIZO A,EGASHIRA Y,SANADA H.Suppressive effect of corn bran hemicellulose on liver injury induced by D-galactosamine in rats[J].Nutrition,2005,21(10):1044-51.
[2]张艳荣,刘婷婷,王大为.玉米活性多糖减肥降脂作用的研究[J].食品科学,2006,27(5):227-230.
[3]张艳荣,张雁南,王大为.玉米皮活性多糖的抗便秘作用[J].吉林大学学报:医学版,2005,31(4):509-511.
[4]张艳荣,陈丽娜,王大为.玉米活性多糖对糖尿病小鼠的降血糖作用[J].吉林大学学报:医学版,2005,31(6):846-848.
[5]XU Weili,LIU Jiaren,LIU Huikun,et al.Inhibition of proliferation and induction of apoptosis by γ-tocotrienol in human colon carcinoma HT-29 cells[J].Nutrition,2009,25(5):555-566.
[6]DECKER E,BEECHER G,SLAVIN J.Whole grains as a source of antioxidants [J].Cereal Foods World,2002,47(8):370-373.
[7]GOODLAD R A,ENGLYST H N.Redefining dietary fibre:potentially a recipe for disaster [J].Lancet,2001,358:1833-1834.
[8]LUP T J.Is fibre protective agaist colon cancer?Where the research is leading us[J].Nutrition,2000,16:558-561.
[9]CLEMENS R.Redefining fiber[J].Food Technology,2001,55(2):100-101.
[10]BENKO Z,ANDERSSON A,SZENGYEL Z,et al.Heat extraction of corn fiber hemicellulose[J].Appl Biochem Biotechnol,2007,137-140(1-12):253-265.
[11]LEATHERS T D,NUNNALLY M S,PRICE N P.Price co-production of schizophyllan and arabinoxylan from corn fiber[J].Biotechnol Lett,2006,28(9):623-626.
[12]YADAV M P,PARRIS N,JOHNSTON D B,et al.Fractionation, characterization, and study of the emulsifying properties of corn fiber Gum [J].J Agric Food Chem,2008,56(11):4181-4187.
[13]ALLERDINGS E,RALPH J,STEINHART H,et al.Isolation and structural identification of complex feruloylated heteroxylan side-chains from maize bran[J].Phytochemistry,2006,67(12):1276-1286.
[14]张艳荣,刘相阳,于君,等.玉米皮多糖的组成及结构[J].食品科学,2011,32(3):64-67.
[15]芦菲,李波,李春阳,等.玉米皮多糖的制备方法及结构研究[J].安徽农业科学,2008,36(17):7445-7446,7495.
[16]SAULNIER L,CREPEAU M J,LAHAYE M,et al.Isolation and structural determination of two 5,5'-diferuloyl oligosaccharides indicate that maize heteroxylans are covalently cross-linked by oxidatively coupled ferulates[J].Carbohydrate Research,1999,320(1):82-92.

