不同预氧化剂对铜绿微囊藻细胞的灭活
殷娣娣,陆纳新,袁 君,高乃云,戎文磊,周圣东
(1.污染控制与资源化研究国家重点实验室(同济大学),200092上海;2.无锡市自来水总公司,214031江苏无锡)
水体富营养化问题日益严重,由此引发的鱼类大量死亡,藻毒素(MCs)、异嗅物质及其他藻源有机质(AOM)释放等问题对人类的生产生活造成了严重危害,也对饮用水安全构成了重大威胁[1-2].预氧化强化混凝除藻是国内外研究热点.其主要目的是通过预氧化降低藻的活性,强化藻的混凝沉淀能力.另外,预氧化对于藻细胞外溶解性有机质(EOM)如藻毒素等也有一定的去除作用.微囊藻毒素(MC-LR)在自然水体中相对稳定,但其具有较多的不饱和结构,尤其是Adda结构中的共轭双键结构不稳定,故能被多种氧化剂氧化,常用的预氧化剂包括高锰酸钾、氯化合物和臭氧等.
由于一般水处理工艺对于藻细胞外溶解性有机质去除效果的限制,混凝工艺前的预氧化要求在降低藻细胞活性、改善藻细胞混凝沉降性能的同时,避免因藻细胞壁的破裂导致藻毒素、异嗅物质等有毒有害藻细胞胞内代谢有机质(IOM)释放到细胞外,进入后续水处理工艺中.国外已有使用氯、臭氧及高锰酸钾作为氧化剂氧化MCs的相关动力学研究[3-5],但有关预氧化对铜绿微囊藻细胞叶绿素破坏影响的比较研究尚未见报道.已有文献表明[6-7],采用高锰酸钾作预氧化剂时,当氧化剂暴露值介于细胞灭活临界点与毒素释放临界点之间时可以迅速灭活藻细胞并使细胞保持其相对完整性,控制细胞内MC-LR的释放.本文以铜绿微囊藻为研究对象,考察次氯酸钠及臭氧的投加量和氧化时间对铜绿微囊藻细胞灭活效果的影响,建立数学模型进行动力学拟合,并与前期高锰酸钾的动力学拟合结果进行比较.采用扫描电子显微镜辅助分析这3种常见预氧化剂对铜绿微囊藻细胞的处理效果,为实际生产除藻提供理论依据.
1 实 验
1.1 藻种的培养
铜绿微囊藻(Microcystis aeruginosa)藻种,编号FACHB-912,购自武汉水生生物研究所,采用培养基BG11进行培养.铜绿微囊藻采用批量式培养,于(25±1)℃、光照度为2 400 lx、光暗周期为12 h:12 h的恒温培养箱中培养.取藻密度为6.4×106个·mL-1处于对数期的藻液进行氧化实验.
1.2 臭氧发生装置
臭氧发生采用完全混合间歇式反应器,装置流程如图1所示.氧气经臭氧发生器反应形成臭氧,产生的臭氧量通过管路上的流量计精确计量调整.将超纯水装入反应柱,并通入臭氧计时.臭氧由反应柱底部曝气头均匀曝气进入反应柱中,于超纯水中渐渐趋于饱和.臭氧通入一定时间后由反应柱上的取样口直接取样,取出的水样立即测定水中臭氧浓度.
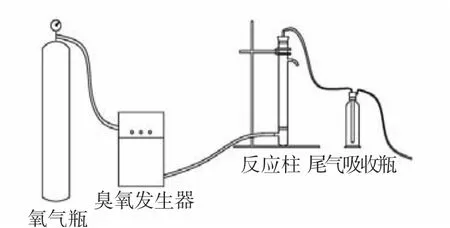
图1 臭氧发生装置流程
1.3 实验方法
实验在(20±2)℃的室温中进行,反应初始pH用二氧化碳调节至7.5±0.1.配置一定浓度的氧化剂与藻悬浊液在250 mL的玻璃摇瓶中进行反应,在预定的反应时间点取样,分别测定水中剩余的自由氯(臭氧)浓度和细胞光合活性.
1.4 测定方法与药剂
藻的光合活性参数采用叶绿素荧光脉冲仪PHYTO-PAM(Walz公司)测定,藻密度采用UV-765型紫外/可见分光光度计(上海精密科学仪器有限公司)测定,水中余氯经0.7 μm玻璃纤维膜过滤后采用袖珍式比色计TMII氯(HACH公司)和DPD自由氯试剂包测定,水中臭氧浓度采用靛蓝比色法测定[8],预氧化后藻细胞的形态采用扫描电子显微镜(Philips公司)测定.
实验用药剂除次氯酸钠(Sigma公司)为色谱纯,其余均为化学纯;实验配水采用Milli-Q型超纯水制水机(Millipore公司)制取.
2 结果与讨论
2.1 次氯酸钠对铜绿微囊藻细胞的灭活
2.1.1 氯的衰减
选取藻密度为6.4×106个·mL-1的铜绿微囊藻藻液,投加不同浓度次氯酸钠(有效游离氯浓度 56.4 ~ 225.7 μmol·L-1,即 质 量 浓 度 2 ~8 mg/L),反应时间600 s.次氯酸钠氧化过程中游离氯在藻液中的衰减情况如图2所示.

图2 不同次氯酸钠投量下剩余游离氯随反应时间变化
由图2可以看出,游离氯在氧化过程中前100 s内迅速衰减,之后逐渐趋缓.这是由于次氯酸钠的氧化性较强,投入铜绿微囊藻液后迅速与EOM反应,同时氧化藻细胞.另外,次氯酸钠的不稳定性导致其在藻液中降解很快,故在100 s内氧化剂消耗显著.反应100 s后,随着能被氧化剂氧化的EOM浓度的减少,游离氯的降解速度趋缓.次氯酸钠对于藻细胞的灭活非常迅速,基本在600 s内完成,故对游离氯的衰减仅考虑600 s内的过程.
2.1.2 次氯酸钠对铜绿微囊藻活性影响的动力学分析
藻液的初始活性Y0为0.43.当次氯酸钠投加量为 56.4 μmol·L-1(2 mg/L)时,活性基本稳定在Y0,说明56.4 μmol·L-1的次氯酸钠基本不影响藻细胞活性,即藻体没有遭到破坏.56.4~225.7 μmol·L-1(2~8 mg/L)次氯酸钠下,藻细胞活性前60 s在Y0附近波动,随后迅速下降,直至藻体的生命特征基本丧失.次氯酸钠对藻活性的影响符合二级动力学,其方程可以表达为
采用游离氯剩余浓度c与反应时间t的积表示藻细胞在次氯酸钠下的暴露剂量(ct),得次氯酸钠灭活藻细胞反应动力学方程与高锰酸钾相同,可以表达为
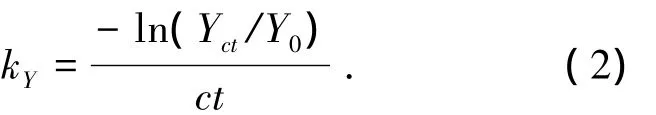
通过作图得出不同次氯酸钠投加量下氧化剂灭活藻细胞的二级反应速率常数,即细胞灭活速率常数.由于 56.4 μmol·L-1游离氯下藻细胞活性基本没有变化,故取 84.6~225.7 μmol·L-1游离氯对细胞活性的破坏拟合反应动力学.二级反应动力学的拟合结果见图3及表1.
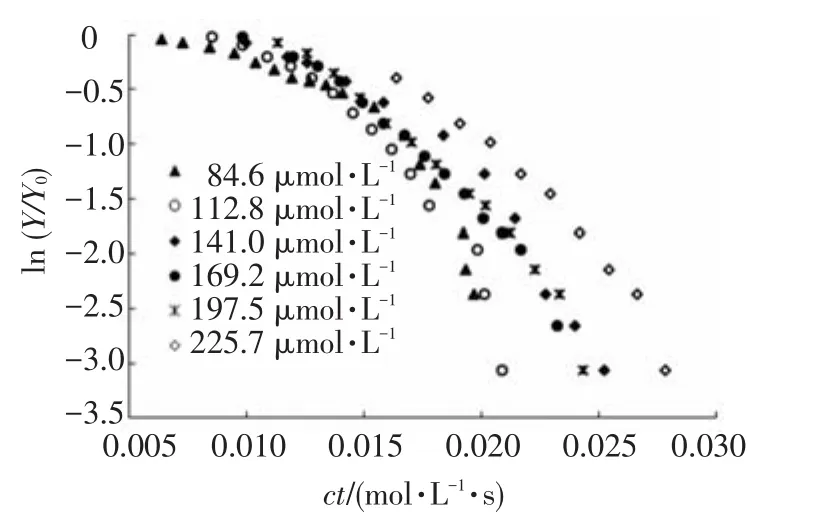
图3 不同次氯酸钠投加量下游离氯暴露剂量ct对铜绿微囊藻活性的影响
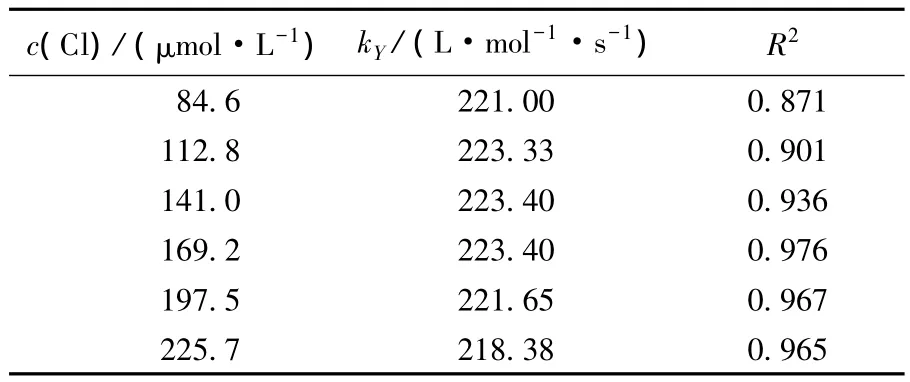
表1 游离氯暴露剂量ct对铜绿微囊藻活性影响的动力学模型拟合参数
由表1可知,次氯酸钠对藻细胞的灭活较好地符合了二级反应动力学模型.84.6~225.7 μmol·L-1初始游离氯浓度下藻细胞灭活速率常数kY均为(220±3)L·mol-1·s-1,表明初始游离氯浓度对kY影响不大.但低浓度下的反应动力学拟合R2较低,这可能是由于低氧化剂投加量下,细胞壁对游离氯氧化的阻碍导致灭活过程中细胞活性的降低有一个先慢后快的过程.
比较氯氧化藻细胞与前期对高锰酸钾氧化藻细胞过程的研究[6-7],发现氯氧化过程中并没有出现高锰酸钾下kY随投加量增大而减小的现象,这是由于氯穿透力较强,不同投加量下氧化剂作用至细胞壁的时间没有明显区别.此外,比较高锰酸钾与次氯酸钠下细胞灭活速率常数kY,发现氯对藻细胞的灭活效率远大于高锰酸钾,这是由次氯酸钠较强的细胞穿透性所致,因此,也容易导致IOM的大量释放.加之预氯化还会带来含氮和含碳消毒副产物等问题[8-10],需严格控制其投加量.
2.2 臭氧对铜绿微囊藻细胞的灭活
2.2.1 臭氧的衰减
取藻密度为6.4×106个·mL-1的铜绿微囊藻藻液,投加不同浓度臭氧(22.4~60.6 μmol·L-1,即质量浓度 1.073~2.909 mg/L),反应时间500 s.臭氧在藻液中的衰减情况如图4所示.

图4 不同臭氧投加量下臭氧剩余质量浓度随反应时间的变化
由图4可知,臭氧在氧化过程中前40 s内迅速衰减,之后逐渐趋缓.这是由于臭氧有着极强的氧化性,投入铜绿微囊藻液后迅速与EOM反应,同时破坏藻细胞.另外,由于臭氧极不稳定,一加入藻液即迅速降解,故在前40 s内氧化剂消耗非常显著.此外,臭氧的降解速度非常快,氧化剂在1.073,1.184和1.426 mg/L的投加量下分别于100,180和300 s左右消耗完全.
2.2.2 臭氧对铜绿微囊藻活性影响的动力学分析
藻液的初始活性Y0为0.45.当臭氧投加量为22.4 和 24.7 μmol·L-1(1.073,1.184 mg/L)时,反应1 800 s后活性分别降低且稳定至0.3和0.25附近,说明24.7 μmol·L-1以下的臭氧投加量不足以灭活藻细胞,藻细胞在氧化剂作用后受到一定程度的破坏,但其生命体征并没有完全丧失.29.7~60.6 μmol·L-1(1.426~2.909 mg/L)臭氧下,藻细胞活性迅速下降.随着臭氧投加量的增加,藻细胞失活速度加快,完全失活时间由1.426 mg/L下的330 s降低到2.909 mg/L下的90 s.对比不同投加剂量高锰酸钾、次氯酸钠及臭氧下藻光合活性的变化可知,臭氧下藻细胞光合活性的降低速度最快,说明臭氧的氧化性最强,最易破坏藻细胞,引起IOM释放.此外,臭氧下光合活性的下降并不存在高锰酸钾、次氯酸钠下的反应滞后期,这可能是由于臭氧具有极强的氧化性,一旦投加进藻液便与EOM迅速反应,即直接作用至藻细胞.
通过作图得出不同臭氧投加量下氧化剂灭活藻细胞的二级反应速率常数,即细胞灭活速率常数.由于 22.4,24.7 μmol·L-1下藻细胞没有完全失活,29.7 μmol·L-1下藻细胞在完全失活前臭氧已经完全被消耗,故取33.5~60.6 μmol·L-1臭氧对细胞活性的破坏拟合反应动力学.二级反应动力学的拟合结果见图5及表2.
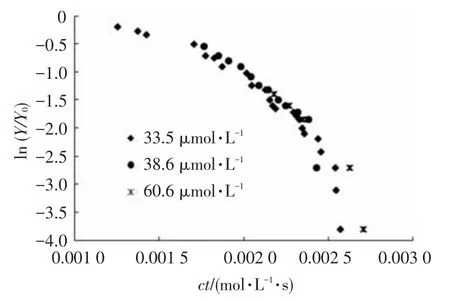
图5 不同臭氧投加量下剩余臭氧暴露剂量ct对铜绿微囊藻活性的影响

表2 臭氧暴露剂量ct对铜绿微囊藻活性影响的动力学模型拟合参数
由表2可知,臭氧对藻细胞的灭活较好地符合了二级反应动力学模型.33.5~60.6 μmol·L-1初始臭氧浓度下细胞灭活速率常数kY均为(2 655±15)L·mol-1·s-1,表明初始臭氧浓度对kY影响不大.臭氧灭活藻细胞速率常数是次氯酸钠的近12倍,是高锰酸钾的近137倍.臭氧能在短时间内迅速杀灭藻细胞,但极不稳定,对其投加量的控制较难,极易导致IOM大量释放.
2.3 水处理工艺对预氧化剂的选择
预氧化剂的选择要求对藻细胞有较好的灭活效果,同时氧化剂对藻细胞的破坏最小,避免IOM释放到胞外.高锰酸钾、次氯酸钠和臭氧对于藻细胞的灭活速率常数kY分别为 5.00~19.38[6],(220±3)和(2 655±15)L·mol-1·s-1,表明对铜绿微囊藻细胞的灭活速率遵循臭氧>次氯酸钠>高锰酸钾.臭氧、次氯酸钠及高锰酸钾在氧化过程中均会引起藻细胞破裂及IOM释放,运用扫描电镜观察不同氧化剂对藻细胞破坏的效果,结果如图6所示.
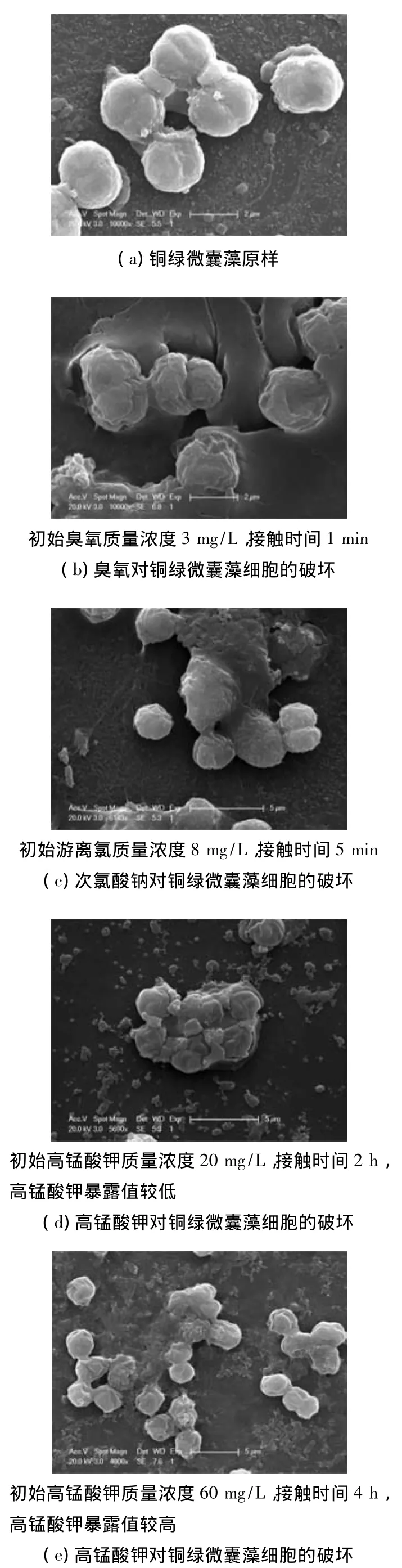
图6 铜绿微囊藻原样及不同氧化剂对藻细胞破坏SEM图
图6表明,在臭氧和次氯酸钠作用下,藻细胞较易发生萎缩破裂甚至溶解;而在高锰酸钾作用下,藻细胞在高锰酸钾暴露值较低时受氧化剂作用发生团聚、形变,但仍保持其相对完整性,细胞并未发生明显破裂(图6(d)),细胞在高锰酸钾暴露值较高时发生明显破裂甚至溶解,IOM大量释放(图 6(e)).这与之前对高锰酸钾的研究[6-7]吻合,说明高锰酸钾对 IOM的释放更可控.
综上,虽然臭氧和次氯酸钠的藻细胞灭活效率均优于高锰酸钾,但它们更易导致IOM的释放,还会带来含氮、含碳消毒副产物或溴酸盐消毒副产物等问题.而高锰酸钾在降低藻细胞活性、改善藻细胞混凝沉降性能的同时,对细胞壁的穿透性较差,可通过对其暴露值的控制避免藻细胞壁的破裂导致藻毒素、异嗅物质等有毒有害AOM的释放.故实际高藻水预氧化技术中优先推荐使用高锰酸钾.
3 结 论
1)次氯酸钠对铜绿微囊藻细胞的灭活符合二级反应动力学,速率常数为 218.38~223.40 L·mol-1·s-1.反应存在较短的滞后期,且低浓度(有效游离氯为 84.6,112.8 μmol·L-1)次氯酸钠下细胞活性的降低表现出先慢后快的过程.不同的氯投加量对藻细胞灭活速率常数无明显影响.
2)臭氧在铜绿微囊藻液中消耗非常迅速,对铜绿微囊藻细胞的灭活符合二级反应动力学,速率常数为 2 641.8~2 666.8 L·mol-1·s-1,反应不存在滞后期.不同的臭氧投加量对藻细胞灭活速率常数无明显影响.
3)氧化剂对铜绿微囊藻细胞的灭活速率为臭氧>次氯酸钠>高锰酸钾.但臭氧与次氯酸钠在氧化过程中对胞内有机物的释放可控性较小,易引起藻细胞破裂及胞内有机物的释放;高锰酸钾可通过对其氧化剂暴露值的控制,避免藻细胞壁的破裂导致藻源有机质释放到细胞外进入后续水处理工艺中.
[1]黎雷,高乃云,殷娣娣,等.控制饮用水原水中藻类、藻毒素的水厂处理工艺[J].中国给水排水,2008,24(6):20-24.
[2]LILei,GAO Naiyun, DENG Yang, etal.Characterization of intracellular& extracellular algae organic matters(AOM)ofMicrocystic aeruginosaand formation of AOM-associated disinfection byproducts and odor& taste compounds[J].Water Research,2012,46(4):1233-1240.
[3]DALY R I,HO L,BROOKES J D.Effect of chlorination onMicrocystis aeruginosacell integrity and subsequent microcystin release and degradation[J].Environmental Science& Technology,2007,41(12):4447-4453.
[4]RODRIGUEZ E,MAJADO M E,MERILUOTO J,et al.Oxidation of microcystins by permanganate:reaction kinetics and implications for water treatment[J].Water Research,2007,41(1):102-110.
[5]张可佳,高乃云,殷娣娣,等.臭氧氧化降解微囊藻毒素-LR的动力学研究[J].同济大学学报:自然科学版,2009,37(7):919-924.
[6]高乃云,沈嘉钰,黎雷,等.高锰酸钾灭活铜绿微囊藻及胞内毒素释放机制[J].同济大学学报:自然科学版,2014,42(5):721-729.
[7]LI Lei,SHAO Chen,LIN Tsairfuh et al.Kinetics of cell inactivation, toxin release,and degradation during permanganation ofMicrocystisaeruginosa[J].Environmental Science& Technology,2014,48(5):2885-2892.
[8]BADER H,HOIGNE J.Determination of ozone in water by the indigo method[J].Water Research,1981,15(4):449-456.
[9]LEE W,WESTERHOFF P,CROUE J P.Dissolved organic nitrogen as a precursor for chloroform,dichloroacetonitrile, N-Nitrosodimethylamine, and trichloronitromethane [J].Environmental Science Technology,2007,41(15):5485-5490.
[10]FANG Jingyun,YANG Xin, MA Jun, etal.Characterization of algal organic matter and formation of DBPs from chlor(am)ination[J].Water Research,2010,44(20):5897-5906.

