吸烟与原发性胆汁性肝硬化发病的关系研究*
陈 晶,贾 桂,高正军,赵世民,朱玉侠,朱疆依,唐亚为,时永全,周新民,韩者艺,韩 英
原发性胆汁性肝硬化(Primary biliary cirrhosis,PBC)是一种发生在肝内小胆管的非化脓性炎症性自身免疫性疾病,以血清抗线粒体抗体(Anti mitochondrial antibody,AMA,M2亚型为主)阳性为主要特征。PBC的主要发病人群为中年女性,有显著的性别差异,男女比例为1:9。近年来,随着人们生活习惯的改变以及对该病认识的提高,PBC的诊断率有所升高。一项基于人群的PBC流行病学调查的综述指出:PBC发病率在0.33~5.8/1000 000/年,患病率在1.91~40.2/1000 000[1]。Selmi C et al[2]研究提出用纬度地理流行病学模式描述PBC的患病分布,指出PBC的发病存在地区差异。目前,已有大量关于PBC危险因素的研究,但PBC的病因及发病机制尚未完全明确。一项Meta分析提出泌尿系感染、吸烟、激素替代治疗、合并其他自身免疫性疾病等[3]可能与PBC发病相关。较多文献报道吸烟可能是PBC的一个重要危险因素,但在PBC发病中发挥的作用尚不明确。目前有关该方面的研究仅局限于欧洲人群,在亚洲人群中关于PBC患者吸烟情况的资料尚无研究报道[4]。本研究小组在中国西北地区进行了一项关于PBC患者吸烟情况的病例对照研究,现将结果报告如下。
1 资料与方法
1.1 研究对象 2010年至2014年期间在我院住院的PBC患者109例,诊断依据2009年欧洲肝病学会发布的关于PBC的诊断标准[5]。2009年欧洲肝病学会发布的关于PBC的诊断标准为生化检查提示淤胆,特别是碱性磷酸酶(Alkaline phosphatase,ALP)升高;血清AMA阳性;组织学显示有非化脓性破坏性胆管炎和小叶间胆管破坏。在这三项中有二项阳性即诊断为PBC[5]。按照1:2配比,以性别(性别相同)、年龄(±2岁)为配比条件,在同期西京医院体检中心健康志愿者中选择218名为对照组。本研究获得西京医院伦理委员会批准,所有研究对象均签署知情同意书。
1.2 研究方法 采用问卷调查形式进行数据采集,缺失数据进行电话回访以完善。问卷调查表内容包括:吸烟史:①是,②否;开始年龄: 岁;每日量:①偶尔,②<5支/日,③5~10支 /日,④10~20支 /日,⑤≧2包/日;是否经常暴露于吸烟的环境:①是,②否;开始暴露于吸烟环境的年龄: 岁;暴露于吸烟环境的平均浓度:①<5支/日,②5~10支/日,③10~20支/日,④>20支/日。在进行统计时,将偶尔吸烟定义为0支,每日吸烟量<5支/日为2.5支;5~10支/日为7.5支;10~20支/日为15支;>20支/日为25支。通过乘法计算总吸烟量,单位为支,即每年吸烟支数×年数。暴露吸烟环境的计算方法同主动吸烟。
1.3 检测 采用基于IFCC(2007配方)试剂盒检测ALP(四川迈克生物科技公司);采用欧蒙印迹法或间接免疫荧光法检验AMA(欧蒙医学实验诊断公司)。
1.4 肝活检检查 肝组织切片采用苏木精-伊红(Hematoxylin-eosin)染色及EnVision免疫组化染色,由经验丰富的专科医生阅片。
1.5 统计学方法 应用SPSS 19.0统计学软件,计量资料以()表示,采用单样本K-S拟合优度检验判断数据是否为正态分布。对正态分布的资料采用t检验,对非正态分布的资料采用Mann-Whitney U检验。计数资料比较采用x2检验。双侧P<0.05定义为差异具有统计学意义。
2 结果
2.1 两组人群一般资料情况 对性别和年龄进行成组配比后,两组人群性别、年龄、身高、体质量、BMI差异无统计学意义(表1)。
表1 两组人群一般资料()比较

表1 两组人群一般资料()比较
PBC 正常人 P值性别(男/女) 12/97 24/194年龄(岁) 48.8±8.3 48.6±8.4 0.85身高(m) 1.6±0.6 1.6±0.6 0.34体质量(kg) 58.0±9.9 58.8±9.2 0.48 BMI(kg/m2)22.3±3.3 22.4±2.9 0.71
2.2 连续性变量检验 经单样本K-S拟合优度检验,平均每日吸烟支数、吸烟总量、开始暴露吸烟年龄、平均每日暴露吸烟支数、暴露吸烟总量、主动+被动吸烟总量为非正态分布变量(表2)。
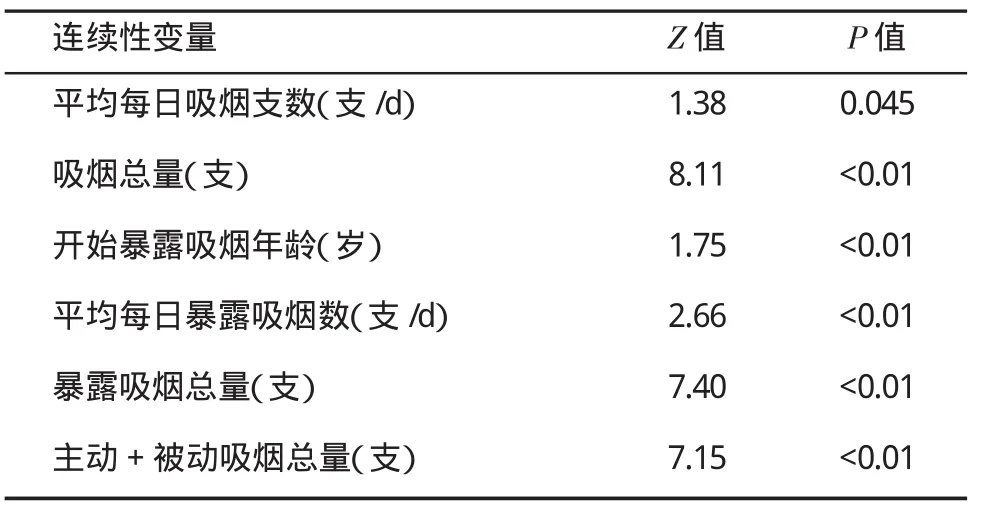
表2 连续性变量K-S拟合优度检验分析
2.3 两组吸烟情况的比较 经过上述换算及分析后,将平均每日吸烟支数、吸烟总量、开始暴露吸烟年龄、平均每日暴露吸烟支数、暴露吸烟总量、主动+被动吸烟总量六项进行Mann-Whitney U检验,结果用四分位数(P25,P75)表示(表3)。对开始吸烟年龄、吸烟总时间、暴露吸烟总时间三者进行两独立样本t检验,结果以()表示(表4)。其中,病例组吸烟总量(32393.8,134137.5)与对照组(22356.3,104025.0)比,差异具有显著性意义(P<0.01),而吸烟史、开始吸烟年龄、吸烟总时间、平均每日吸烟支数、吸烟暴露史、开始暴露吸烟年龄、暴露吸烟总时间、平均每日暴露吸烟支数、暴露吸烟总量、主动+被动吸烟总量差异无统计学意义。

表3 两组人群吸烟量和初始吸烟年龄(P25,P75)比较
表4 两组人群主被动吸烟史及时间()比较

表4 两组人群主被动吸烟史及时间()比较
PBC 正常人 P值吸烟史 11/104 21/162 0.56吸烟暴露史 38/82 68/151 0.85主动+被动吸烟史 41/107 73/178 0.65吸烟开始年龄(岁) 19.5±2.7 23.7±6.4 0.09吸烟总时间(年) 24.3±8.1 23.1±9.3 0.77暴露吸烟总时间(年) 23.1±10.0 25.9±11.2 0.37
3 讨论
PBC是一种以肝内小胆管进行性损伤为特征的自身免疫性肝病,可进一步发展至肝纤维化和肝硬化,最终导致肝功能衰竭。随着对PBC认识的提高,血生化检测的普遍使用及AMA的检测,PBC已不再是罕见的疾病[7]。熊去氧胆酸是目前唯一由美国食品药物管理局批准的用于治疗PBC的药物。PBC的预后已明显改善,但仍存在显著个体差异[8],因此明确PBC的病因及发病危险因素仍是当下重要的研究内容。目前,在有关PBC发生的危险因素研究方面,提出较为公认的假设是基因与环境危险因素共同引起PBC的发病。Set C et al[9]在对同、异卵双胞胎PBC发病情况的研究中提示在同卵双胞胎中PBC的共患率高达63%,在目前已报道的自身免疫性疾病共患率中最高;同样,PBC患者的一级亲属发病率也显著增加。环境因素中的化学物质及细菌感染等可能启动PBC的发病。
一项包含1032例PBC患者的问卷调查研究发现,化学物质中的香烟可能导致PBC遗传易感的个体发病[10]。近年来,吸烟在自身免疫性疾病中发挥的作用也越来越得到了人们的重视[11]。PBC是一种好发于女性的自身免疫性疾病,具体机制尚未明确,可能与雌激素受体及避孕药的使用相关[10]。目前关于吸烟与PBC发病关系的研究主要集中于欧洲人群。鉴于各地区女性吸烟率的不同,欧洲例如匈牙利,女性吸烟率为29%,但在中国女性吸烟相对较少。根据中国吸烟危害健康报告,我国女性吸烟率为2.4%。因此,有必要调查吸烟在中国PBC患者中的分布情况。
本研究结果提示吸烟可能是PBC的一个重要危险因素。PBC患者吸烟总量(32393.8,134137.5)显著大于对照组(22356.3,104025.0,P<0.01)。Howel D小组[12]在对PBC危险因素的问卷调查研究中提出,吸烟超过20年可能是PBC发病的危险因素(OR 3.5,95%CI 1.9~6.3),认为吸烟可能在PBC的发病中通过不断刺激,达到一定累积量后促使疾病的发生。Claudia O Z et al[13]研究提示,≥10包/年与进展期PBC之间有显著性相关(OR 13.3,95%CI 4.3~49.3),与本研究结果相似,提示吸烟累积量在PBC发病及疾病进展中发挥重要作用。环境因素可能通过剂量累积诱使PBC发病。本研究通过对主动吸烟进行剂量化的研究分析提示,烟雾的不断连续刺激可能促进了PBC的发病。烟草中的某些化学物质,例如尼古丁等,在疾病的发生中可能通过分子模拟机制导致机体免疫功能的紊乱,同时对肝胆管细胞造成损害,进一步导致PBC的发病。但这一假设仍需动物实验等来证实。本研究发现吸烟史在PBC病例组与对照组之间差异无显著意义。
吸烟在PBC发病中发挥的具体作用尚不明确。有研究显示,吸烟为PBC患者发生肝纤维化的独立危险因素,同时在PBC疾病进展过程中促进肝纤维化的发展[4,14]。文献报道,吸烟可导致免疫功能和激素分泌的改变;促进自由基的产生以及氧化应激的发生,在PBC的发病及疾病进展过程中发挥重要作用[14]。在动物模型的研究中,慢性尼古丁暴露能激活胆管上皮细胞,促其增殖、表达纤维化相关基因,导致胆管纤维化,可能参与了PBC等胆管疾病的发病机制[15]。Costa C et al[16]在对PBC患者肺功能变化的研究中提出肺泡弥散功能损害在PBC患者中比较常见,尤其在缺乏临床症状的PBC患者,这种改变主要出现在PBC合并系统性硬化病的一种亚型(CREST综合征)患者,即出现手指软组织钙化、雷诺现象、食道运动功能障碍、指端硬化、毛细血管扩张等症状。PBC较常合并多种自身免疫性疾病,包括风湿性关节炎、系统性红斑狼疮、系统硬化病等。同时,也有文献报道PBC患者肝组织病理学分期和Mayo风险评分与肺弥散功能显著相关[17]。大量研究提示,吸烟在多方面对PBC的发病发挥重要作用。
本研究未提示暴露吸烟,即被动吸烟在PBC病例组与对照组间有显著性统计学差异,可能由于被调查人群对于被暴露吸烟认识不够充分。关于被动吸烟与PBC发病关系的研究较少,有人发现在家庭或工作环境中持续暴露于吸烟环境是PBC发病的重要危险因素。二手烟与主动吸烟的烟雾中化学物质不尽相同,对人体的危害也并非完全一致。暴露吸烟对被动吸烟者的危害不亚于主动吸烟者。因此,对PBC患者及高危人群进行暴露吸烟危害的宣传教育也很重要。
本研究采用性别和年龄(±2岁)进行成组配比,通过对年龄进行严格配比,在很大程度上降低了生活年代等混杂因素。对连续性变量进行正态性检验,减少了统计方法的误差。我国女性吸烟率较低,本研究纳入研究的病例数尚少,仍需扩大样本量,进行多地区多中心研究以进一步分析。本研究为单中心、病例对照研究,主要系回顾性资料,可能存在信息偏倚和选择偏倚。
本研究发现,吸烟可能是PBC发病的重要危险因素,控制吸烟量可能是预防PBC发病的重要措施,尤其在有PBC家族史的健康人群。同时,对PBC患者进行戒烟教育可能减缓疾病发展。本问卷调查主要人群为中国西北地区,有待更多地区、大样本及多中心的调查研究。本小组将进一步对PBC患者进行分期,探讨不同分期PBC患者吸烟情况,从而分析吸烟在PBC进展中的作用。我国PBC患病率呈逐年上升趋势,PBC患者的治疗及预后也得到了很大的改善。在疾病预防方面,本研究小组希望能为PBC的预防提供一定的科学依据。
[1]Boonstra K,Beuers U,Ponsioen CY.Epidemiology of primary sclerosing cholangitis and primary biliary cirrhosis:a systematic review.J Hepatol,2012,56(5):1181-1188.
[2]Selmi C,Invernizzi P,Zuin M.Genetics and geoepidemiology of primary biliary cirrhosis:following the footprints to disease etiology.Semin Liver Dis,2005,25(3):265-280.
[3]Liang Y,Yang Z,Zhong R.Smoking,family history and urinary tract infection are associated with primary biliary cirrhosis:A meta-analysis.Hepatol Res,2011,41(6):572-578.
[4]Corpechot C,Gaouar F,Chretien Y.Smoking as an independent risk factor of liver fibrosis in primary biliary cirrhosis.J Hepatol,2012.56(1):218-224.
[5]Lindor KD,Gershwin ME,Poupon R.Primary biliary cirrhosis.Hepatology,2009.50(1):291-308.
[6]Flores A,Mayo MJ.Primary biliary cirrhosis in 2014.Curr Opin Gastroenterol,2014,30(3):245-252.
[7]Marlyn J,Mayo MJ.Natural history of primary biliary cirrhosis.Clin Liver Dis,2008,12(2):277-288;viii.
[8]Selmi C,Mayo MJ,Bach N.Primary biliary cirrhosis in monozygotic and dizygotic twins:genetics,epigenetics,and environment.Gastroenterology,2004,127(2):485-492.
[9]Gershwin M E,Selmi C,Worman HJ.Risk factors and comorbidities in primary biliary cirrhosis:a controlled interview-based study of 1032 patients.Hepatology,2005,42(5):1194-1202.
[10]Costenbader KH,Karlson EW.Cigarette smoking and autoimmune disease:what can we learn from epidemiology.Lupus,2006,15(11):737-745.
[11]Howel D,Fischbacher CM,Bhopal RS.An exploratory population-based case-control study of primary biliary cirrhosis.Hepatology,2000,31(5):1055-1060.
[12]Zein CO,Beatty K,Post AB.Smoking and increased severity of hepatic fibrosis in primary biliary cirrhosis:A cross validated retrospective assessment.Hepatology,2006,44(6):1564-1571.
[13]Smyk DS,Riqopoulou EI,Muratori L,et al.Smoking as a risk factor for autoimmune liver disease:what we can learn from primary biliary cirrhosis.Ann Hepatol,2012,11(1):7-14.
[14]Jensen K,Afroze S,Ueno Y,et al.Chronic nicotine exposure stimulates biliary growth and fibrosis in normal rats.Dig Liver Dis,2013,45(9):754-761.
[15]Costa C,Sambataro A,Baldi S,et al. Primary biliary cirrhosis:lung involvement.Liver,1995,15(4):196-201.
[16]Krowka MJ,Grambsch PM,Edell ES,et al.Primary biliary cirrhosis:relation between hepatic function and pulmonary function in patients who never smoked.Hepatology,1991,13(6):1095-1100.
[17]Corpechot C,Chretien Y,Chazouilere O,et al.Demographic,lifestyle,medical and familial factors associated with primary biliary cirrhosis.J Hepatol,2010,53(1):162-169.

