慢性HBV感染者外周血白细胞GRP78、CHOP和XBP1 mRNA水平变化*
潘高峰,郜玉峰,叶娇娇,姜同翠,沈玉君,沈玉先
乙型肝炎病毒(Hepatitis B virus,HBV)感染可引起多种慢性肝病。内质网应激(Endoplasmic reticulum stress,ERS)是一种细胞自我防御机制,适度的ERS有益于细胞的存活,但持续的ERS则会导致细胞不可逆的损伤,甚至细胞凋亡。研究证实[1,2],HBV在肝细胞内的持续复制可触发ERS,或者说ERS与慢性HBV感染后疾病进展密切相关。各种病理因素触发ERS后,激活肌醇酶(Inositol-requiring enzyme 1,IRE1)-X 盒结合蛋白 l(X-box binding protein-1,XBP1)轴、RNA依赖的蛋白激酶样激酶-真核翻译始动因子 2-α(Protein kinase RNA-like ER kinase-eukaryotic initiation factor 2α,PERK-Eif2α) 轴和活化转录因子 6(Activating transcription factor 6,ATF6)轴三条信号通路,从而调控ERS相关基因的转录及表达,以维持细胞内环境的稳定。糖调节蛋白78(Glucose regulated protein 78,GRP78)、CCAAT增强子结合蛋白同源蛋白(CCAAT-enhancer-binding protein homologous protein,CHOP)和 XBP1基因均为 ERS相关基因,ERS发生时它们的转录及表达增强。GRP78蛋白为热休克蛋白70(Hsp70)家族的一员,在细胞保护、神经变性疾病进展和肿瘤的防治中起关键作用[3]。CHOP广泛分布于组织细胞中,与细胞的增殖、分化、凋亡以及能量代谢密切相关[4]。XBP1属于碱性亮氨酸拉链蛋白,为未折叠蛋白反应(Unfolded protein response,UPR)中重要的转录调控因子,能够协调细胞内蛋白的分泌、折叠和转运。研究认为,XBP1与肿瘤、神经系统疾病和病毒感染等多种病理状态有着密切的关系[5]。目前,有在转染了HBV的肝细胞株细胞发生ERS的报道[6],但对于慢性HBV感染者体内是否存在ERS却鲜有报道。为此,我们拟对无症状HBV携带者(Asymptomatic hepatitis B virus carriers,ASC)、慢性乙型肝炎(Chronic hepatitis B,CHB)、乙型肝炎肝硬化(Liver cirrhosis,LC)和乙型肝炎相关肝细胞癌(Hepatocellular carcinoma,HCC)患者外周血白细胞GRP78、CHOP和XBP1 RNA水平进行检测,首次探讨了ERS在慢性HBV感染性疾病进展中的作用。
1 资料与方法
1.1 病例来源 选取2012年9月2014年3月我科诊治的ASC 43例,男30例,女13例;平均年龄(35.0±10.4)岁。CHB47例,男 39例,女8例;平均年龄(36.5±11.5)岁。LC 41例,男29例,女12例;平均年龄(52.3±10.6)岁;HCC 35例,男28例,女7例;平均年龄(51.5±10.7)岁。诊断参照2010年《慢性乙型肝炎防治指南》[7]和有关标准。所有病例均无重叠其它肝炎病毒感染、自身免疫性肝病、药物性肝损伤、酒精性肝病及其它疾病。同时选取40例体检健康人(Normal healthy controls,NC)作为对照,男28例,女12例;平均年龄(31.0±12.0)岁。本研究方案经医院伦理委员会审核通过,所有研究者均签署知情同意书。
1.2 外周血白细胞GRP78、CHOP和XBP1 mRNA的检测 采集空腹外周血1 ml,加入红细胞裂解液,混匀后离心,弃上清液,留白细胞沉淀,加入TRIzol混匀,提取RNA(美国Invitrogen公司),在1%琼脂糖电泳鉴定RNA。使用Quawell Q5000微量紫外分光光度计测定RNA水平及纯度。按照TaKaRa PrimScript逆转录试剂盒说明书进行反转录反应,总体积为10 μl,反应条件为37℃ 15 min,85℃ 15 s。按照GenBank数据库提供的 GRP78、CHOP和 XBP1和GAPDH基因序列,用Primer Premier 5.0软件分别设计人源引物,委托上海生工公司合成,引物序列为:GAPDH 引物:上游 5′-CCACTCCTCCACCTTTG-3′,下游 5′-CACCACCCTGTTGCTGT-3′;GRP78 引物: 上游 5′-GCACAGACGGGTCATTCCAC-3′,下游5′-CCTATGTCGCCTTCACTCC-3′;CHOP引物:上游 5′-CACTCTTGACCCTGCTTCTC-3′,下游 5′-TCTTCCTCCTCTTCCTCCTG-3′;XBP1引物:上游5′-ATGGATTCTGGCGGTATTG-3′,下游5′-GGGAAGGGCATTTGAAGA-3′。以逆转录获得的cDNA为模版,按照SYBR Green PCR试剂盒(日本TaKaRa公司)说明书采用实时定量PCR法(美国Thermo公司)进行扩增,反应条件如下:95℃ 30 s预变性,95℃ 5 s,60℃ 30 s,40个循环。1%琼脂糖电泳,鉴定目的基因片段,GAPDH作为内参,采用2-ΔΔCT法计算基因相对水平[8]。
1.3 统计学处理 应用SPSS 16.0软件进行统计学分析。先对定量数据进行对数转换(ln基因水平),结果以()表示,两组间比较采用独立样本 t检验,三组和三组以上比较时,先采用单因素方差分析,再采用LSD检验,检验水准α=0.05,以P<0.05为差异具有统计学意义。
2 结果
2.1 不同HBV感染者外周血白细胞GRP78、CHOP和 XBP1 mRNA水平变化 结果显示,NC、ASC、CHB、LC和HCC五组之间GRP78 mRNA水平差异有统计学意义(F=8.593,P=0.00);进一步进行两两组间分析显示,ASC、CHB、LC和HCC组 GRP78 mRNA水平均高于NC组(P=0.01),其余任意两组之间比较,差异均无统计学意义(图 1);NC、ASC、CHB、LC和HCC五组之间CHOP mRNA水平差异无统计学意义,进一步进行任意两组之间比较,差异均无统计学意 义 ;NC、ASC、CHB、LC和 HCC五 组 之 间 XBP1 mRNA水平差异有统计学意义(F=7.666,P=0.00)。进一步进行两两组间分析显示,ASC、CHB、LC和HCC组XBP1 mRNA水平均高于NC组(P<0.05),其余任意两组之间比较差异均无统计学意义(图2)。
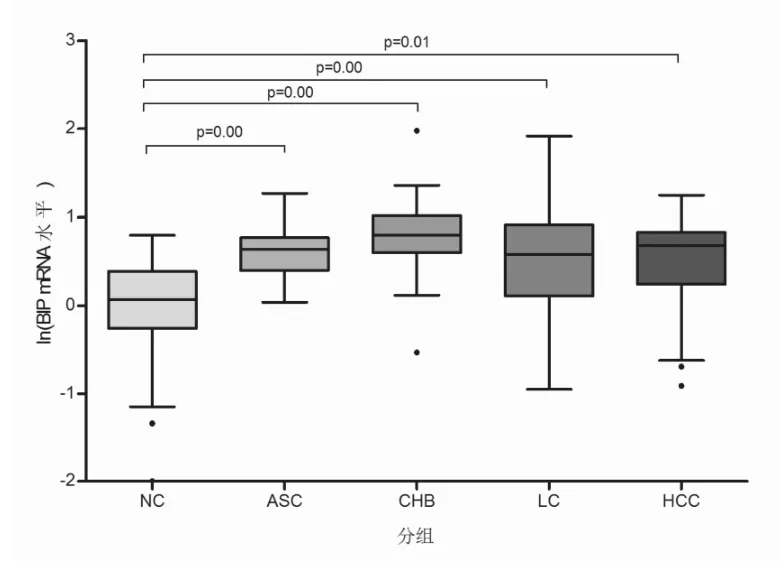
图1 慢性HBV感染者外周血白细胞GRP78 mRNA水平比较 ASC、CHB、LC和HCC组 GRP78 mRNA水平均高于NC组(P≤0.01),其余任意两组之间比较,差异无统计学意义

图2 慢性HBV感染者外周血白细胞XBP1mRNA水平比较ASC、CHB、LC和HCC组 XBP1mRNA水平均高于NC组(P<0.05),其余任意两组之间比较,差异均无统计学意义
2.2 外周血白细胞GRP78、CHOP和XBP1 mRNA水平与临床指标的相关性 根据HBsAg水平、丙氨酸氨基转移酶(Alanine aminotransferase,ALT)水平、天门冬氨酸氨基转移酶(Aspartate aminotransferase,AST)水平、乙型肝炎病毒表面抗原(Hepatitis B virus e antige n,HBeAg) 定性、HBV DNA 以及总胆红素(Total bilirubin,TBIL)水平,将146例HBV感染者进行分组,结果发现,GRP78 mRNA在不同水平HBsAg分组之间的差异具有统计学意义(F=4.552,P=0.012)。进一步进行两两组间比较发现,HBsAg<1500IU/ml组与>20000IU/ml组之间的差异有统计学意义(P=0.01);HBV DNA 定量=(103~105) copies/ml组 XBP1 mRNA水平低于>105copies/ml组(t=-2.127,P=0.036);CHOP mRNA水平在不同临床指标分组之间差异均无统计学意义;GRP78 mRNA 水平在不同 ALT、AST、TBIL、HBV DNA和HBeAg定性分组间差异均无统计学意义;XBP1 mRNA 水平在不同 ALT、AST、TBIL、HBsAg 和HBeAg定性分组间差异均无统计学意义(表1~表3)。
表1 不同临床指标HBV感染者外周血GRP78 mRNA水平()比较

表1 不同临床指标HBV感染者外周血GRP78 mRNA水平()比较
指标 分组 GRP78 mRNA P值HBsAg(IU/ml) <1500 0.48±0.59 0.012 1500~20000 0.76±0.56>20000 0.74±0.56 HBeAg 阳性 0.70±0.58 0.075阴性 0.53±0.59 ALT(IU/ml) <80 0.01±0.61 0.607 80~250 0.67±0.72>250 0.70±0.41 AST(IU/ml) <80 0.64±0.60 0.579 80~250 0.58±0.69>250 0.50±0.50 HBVDNA(lg copies/ml) <1×3 0.54±0.60 0.398 1×3~5 0.70±0.57>1×5 0.65±0.61 TBIL(μmol/l) <17.1 0.69±0.53 0.11 17.1 0.54±0.67
表2 不同临床指标HBV感染者外周血CHOP mRNA水平()比较
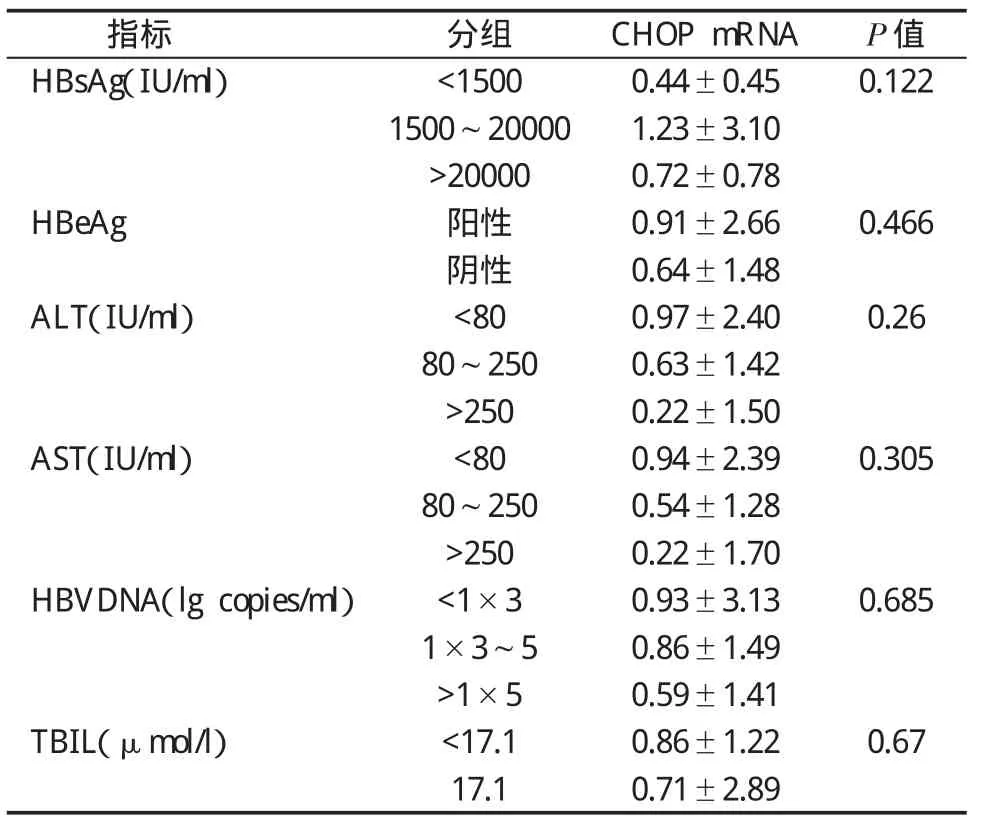
表2 不同临床指标HBV感染者外周血CHOP mRNA水平()比较
指标 分组 CHOP mRNA P值HBsAg(IU/ml) <1500 0.44±0.45 0.122 1500~20000 1.23±3.10>20000 0.72±0.78 HBeAg 阳性 0.91±2.66 0.466阴性 0.64±1.48 ALT(IU/ml) <80 0.97±2.40 0.26 80~250 0.63±1.42>250 0.22±1.50 AST(IU/ml) <80 0.94±2.39 0.305 80~250 0.54±1.28>250 0.22±1.70 HBVDNA(lg copies/ml) <1×3 0.93±3.13 0.685 1×3~5 0.86±1.49>1×5 0.59±1.41 TBIL(μmol/l) <17.1 0.86±1.22 0.67 17.1 0.71±2.89
表3 不同临床指标HBV感染者外周血XBP1mRNA水平()比较
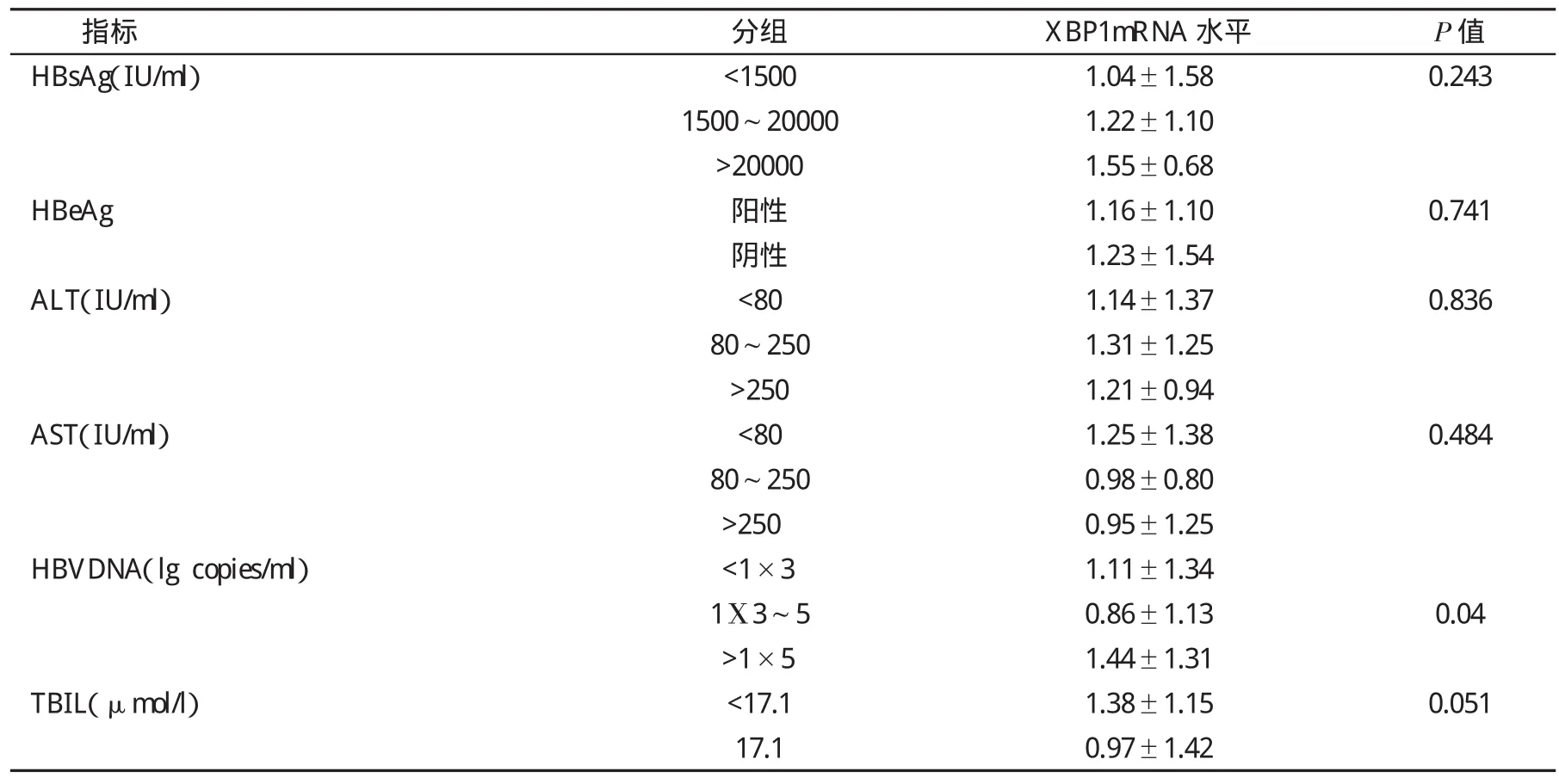
表3 不同临床指标HBV感染者外周血XBP1mRNA水平()比较
分组 XBP1mRNA水平 P值HBsAg(IU/ml) <1500 1.04±1.58 0.243 1500~20000 1.22±1.10>20000 1.55±0.68 HBeAg 阳性 1.16±1.10 0.741阴性 1.23±1.54 ALT(IU/ml) <80 1.14±1.37 0.836 80~250 1.31±1.25>250 1.21±0.94 AST(IU/ml) <80 1.25±1.38 0.484 80~250 0.98±0.80>250 0.95±1.25 HBVDNA(lg copies/ml) <1×3 1.11±1.34 1Χ3~5 0.86±1.13 0.04>1×5 1.44±1.31 TBIL(μmol/l) <17.1 1.38±1.15 0.051 17.1 0.97±1.42指标
3 讨论
GRP78、CHOP和XBP1基因是从30000个基因中筛选出来的ERS相关基因,ERS能上调它们的表达。病毒感染、缺氧、钙离子超载等各种病理因素均可触发 UPR,启动 IRE1-XBP1、PERK-eIF2a和 ATF6三条通路,促使GRP78、CHOP和XBP1基因表达上调。适度的ERS为细胞的一种自我保护反应,过度的ERS则会导致细胞凋亡。CHOP作为促凋亡因子,参与了ERS诱导的细胞凋亡。GRP78和XBP1在多种疾病中可以保护相关细胞免受损伤,推测它们在HBV感染后疾病进程中可能保护肝细胞免受损伤。大量研究证实,HBV本身、HBV相关蛋白及病程中产生的炎症和氧化应激均可触发 ERS[2,6,9,10]。ERS与 HBV感染后肝脏非可控性炎症的发生发展与恶性转换密切相关,但确切的调控机制尚未明确。进一步研究ERS与HBV慢性感染后肝脏疾病进展的关系对于肝脏疾病的防治具有重要的临床意义。因此,我们检测了慢性HBV感染者外周血ERS标志基因GRP78、CHOP和XBP1 mRNA水平,结果表明:与NC组相比,GRP78 mRNA和XBP1 mRNA在慢性HBV感染后疾病进展的各个阶段均呈高水平。GRP78和CHOP的显著上调是发生ERS的主要特征,提示HBV感染后各阶段存在ERS,证实了ERS参与CHB发病过程。
肝硬化是肝纤维化的后期表现,慢性HBV感染可引起肝纤维化。目前认为,ERS诱导的凋亡、炎症和上皮细胞间质转化等作为一种刺激因素参与了组织损伤和纤维化的发生发展[11,12]。细胞外基质(Extracellular matrix,ECM)是产生肝纤维化的中心环节。TGF-β1作为人体内TGF-β的主要亚型,一方面能促进ECM的形成,另一方面可通过多种途径抑制ECM的降解,从而参与肝纤维化的形成和发展[13]。UPR诱导的凋亡可以导致TGF-β的释放,进一步刺激纤维化的发生发展[14],推测ERS参与肝硬化的形成,LC患者XBP1和GRP78 mRNA水平上调支持这种推断。ERS可通过诱导氧化应激、DNA损伤和COX-2表达,激活Akt/mTOR信号通路,激活ERS相关基因ATF6、XBP1和CHOP的表达,抑制ERS相关凋亡途径等参与HBV相关性肝癌的形成[15]。此外,ERS可诱导上皮细胞间的转化,而后者与肝癌的侵袭转移密切相关[16]。临床研究证实 ,肝癌患者体内GRP78自身抗体水平显著高于慢性乙型肝炎患者和肝炎肝硬化患者[17]。另外,已有研究证实,与正常肝脏及肝硬化组织比较,肝癌组织中GRP78蛋白高表达[18],与本实验发现肝癌组外周血白细胞GRP78 mRNA高水平结果相符。此外,GRP78的高表达还可以对抗细胞凋亡及化疗药物对癌细胞的损伤,并促进肿瘤血管的生成[19],因此其高表达有助于肝癌的发生发展及耐药,我们的结果进一步证实了GRP78与肝癌形成的关系。研究证实,肝细胞癌中剪切型XBP1 mRNA水平与肿瘤的恶性程度呈正相关[20]。本实验肝癌组XBP1 mRNA高水平,亦提示XBP1可能参与肝癌的形成,但有待进一步研究其剪切型 mRNA的表达情况。
按HBsAg水平分组,三组间GRP78 mRNA水平存在差异(F=4.552,P=0.01),进一步比较发现>20000 IU/ml组要高于<1500 IU/ml组(P=0.01)。HBsAg水平越高,所导致的ERS越强烈,GRP78的表达量就越高,但XBP1和CHOP在不同HBsAg水平分组上未见差异,尚有待于后续扩大样本明确。XBP1 mRNA水平在低水平病毒载量组要低于高病毒载量组(t=-2.127,P=0.036),可能是因为高载量的HBV会导致更强烈的ERS,从而导致XBP1的高水平。一般而言,HBeAg阳性、胆红素持续升高和转氨酶升高往往提示肝脏损伤持续加重,可能发生严重的ERS,最终导致ERS相关基因的高表达。
HBV感染后的多种因素可以触发ERS。本研究首次证实慢性HBV感染者体内存在ERS,并证实ERS参与慢性HBV感染后的疾病进展,但确切的调控机制仍不明确。深入研究ERS在慢性HBV感染后疾病进展中的作用机制有着非常重要的临床意义,藉此可以筛选及鉴定肝脏炎症、纤维化及恶性转化过程中的关键节点及靶点。
[1]Dara L,JC,Kaplowitz N.The contribution of endoplasmic reticulum stress to liver diseases.Hepatology,2011,53(5):1752-1763.
[2]Montalbano R,Di Fazio P,Quint K,et al.Induction of endoplasmic reticulum-mediated stress pathways in liver cancer cell lines after overexpression of hepatitis b virus envelope proteins.Z Gastroenterol,2012,50(1):539.
[3]He B.Viruses,endoplasmic reticulum stress,and interferon responses.Cell Death Differ,2006,13(3):393-403.
[4]Pereira RC,Stadmeyer LE,Smith DL,et al.CCAT/enhancerbinding protein homologous protein(chop)decreases bone formation and causes osteopenia.Bone,2007,40(3):619-626.
[5]张霞丽,万福生.X-盒结合蛋白 1的生理及病理生理学作用.基础医学与临床,2011,31(11):1289-1292.
[6]Wang LH,Huang W,Lai MD,et al.Aberrant cyclin a expression and centrosome overduplication induced by hepatitis b virus pre-s2 mutants and its implication in hepatocarcinogenesis.Carcinogenesis,2011,33(2):466-472.
[7]中华医学会肝病学分会和感染病学分会.慢性乙型肝炎防治指南(2010年版).实用肝脏病杂志,2011,14(2):81-89.
[8]陈莹,李成锦,杨文,等.MANF对内质网应激诱导的细胞凋亡的保护作用. 安徽医科大学学报,2013,48(11):1308-1312.
[9]Zhang K.Integration of er stress,oxidative stress and the inflammatory response in health and disease.Int J Clin Exp Med,2010,3(1):33.
[10]Cho HK,Cheong KJ,Kim HY,et al.Endoplasmic reticulum stress induced by hepatitis b virus x protein enhances cyclooxygenase 2 expression via activating transcription factor 4.Biochem J,2011,435(2):431-439.
[11]Tanjore H,Lawson WE,Blackwell TS.Endoplasmic reticulum stress as a pro-fibrotic stimulus.Biochim Biophys Acta,2013,1832(7):940-947.
[12]Lenna S,Trojanowska M.The role of endoplasmic reticulum stress and the unfolded protein response in fibrosis.Curr Opin Rheumatol,2012,24(6),663-668.
[13]徐超,马勇.转化生长因子1在乙型肝炎病毒感染相关肝病发病中的作用研究进展.实用肝脏病杂志,2012,17(2):206-209.
[14]Minicis S,Candelaresi C,Agostinelli L,et al.Endoplasmic reticulum stress induces hepatic stellate cell apoptosis and contributes to fibrosis resolution.Liver Int,2012,32(10):1574-1584.
[15]潘高峰,李旭,郜玉峰.内质网应激在慢性HBV感染发病中的作用. 中华临床感染病杂志,2013,6(5):316-319.
[16]吴冬,柯爱武,郭传勇.上皮间质转化在肝纤维化和肝细胞癌发病中的作用研究进展.实用肝脏病杂志,2011,14(6):475-477.
[17]Shao Q,Ren P,Li Y,et al.Autoantibodies against glucoseregulated protein 78 as serological diagnostic biomarkers in hepatocellular carcinoma.Int J Oncol,2012,41(3):1061-1067.
[18]周程敏,董浦江,付小利.Grp78蛋白在肝细胞癌组织中的表达及意义. 国际检验医学杂志,2013,34(7):809-810.
[19]Li J,Lee AS.Stress induction of grp78 and its role in cancer.Curr Mol Med,2006,6(1):45-54.
[20]Shuda M,Kondoh N,Imazeki N,et al. Activation of the atf6,xbp1 and grp78 genes in human hepatocellular carcinoma:A possible involvement of the er stress pathway in hepatocarcinogenesis.J Hepatol,2003,38(5):605-614.

