酒精性肝病患者血清IL-33高水平的临床意义*
郝书理,张纪元,黄 昂,张龙玉,孙 颖,李保森,田 辉,邹正升
酒精性肝病(Alcoholic liver diseases,ALD)是由于长期大量饮酒而导致的肝脏疾病。乙醇可使肝细胞处于氧应激状态,直接造成肝细胞坏死,进而导致原发性肝损伤。此外,脂质过氧化产物和乙醇代谢产物乙醛与机体蛋白结合成新抗原,激发对肝细胞损害的免疫反应。近年来,随着嗜酒人群比例的升高,ALD发病率逐年升高,已成为继病毒性肝炎后的第二大肝损伤性疾病。临床上,将ALD分为轻症酒精性肝病、酒精性脂肪肝、酒精性肝炎(Alcoholic hepatitis,AH)和酒精性肝硬化(Alcoholic liver cirrhosis,ALC)。ALD重症化亦被称为重症酒精性肝炎(Severe alcoholic hepatitis,SAH),或称为酒精性肝衰竭,是酒精性肝病中病情最严重的一种。长期以来,ALD在发展过程中机体的免疫应答如何,其中的相关机制及其临床意义等问题尚缺乏全面的研究。因此,阐明影响ALD病情进展的免疫学机制将有助于临床治疗。白细胞介素 -33(Interlukin-33,IL-33)作为一种新的IL-1家族成员,于2005年被发现[1],在许多非造血细胞分泌,如内皮细胞、成纤维细胞、支气管和上皮细胞及某些免疫细胞(如巨噬细胞和树突细胞)。IL-33通过其受体homolog of sulfotransferase(ST2)发挥生物学作用,在Th2驱动的慢性炎症病变中,如哮喘、类风湿性关节炎、变应性鼻炎或炎症性肠病,IL-33/ST2信号通路的作用已被广泛研究。在肝脏病学领域,IL-33被确定为在乙型肝炎和丙型肝炎发病中导致肝损伤的一种重要因子,而且在体外模型中证实其与肝纤维化密切相关[2]。然而,IL-33及其可溶性受体ST2(sST2)血清水平与ALD患者疾病严重程度关系仍未阐明。本研究分析了ALD患者血清IL-33及其sST2水平,以探讨它们与疾病严重程度的相关性。
1 对象与方法
1.1 研究对象 我中心2013年4月至2014年3月间住院的ALD患者,其中AH患者40例,SAH患者17例和ALC患者75例(Child-Pugh A、B、C级各25例,表1)。诊断符合ALD诊断标准[2],同时满足AH诊断标准[2,3,8]。排除 HBV、HCV或 HIV感染、药物性肝损伤、自身免疫性肝病、肝脏原发或继发恶性肿瘤、肝外梗阻性疾病、孕妇以及合并严重的心、脑、血管、呼吸系统、泌尿系统疾病。另选健康体检者(HC)48例,均为男性。本研究经过我院伦理委员会批准,所有受试者均签署知情同意书。
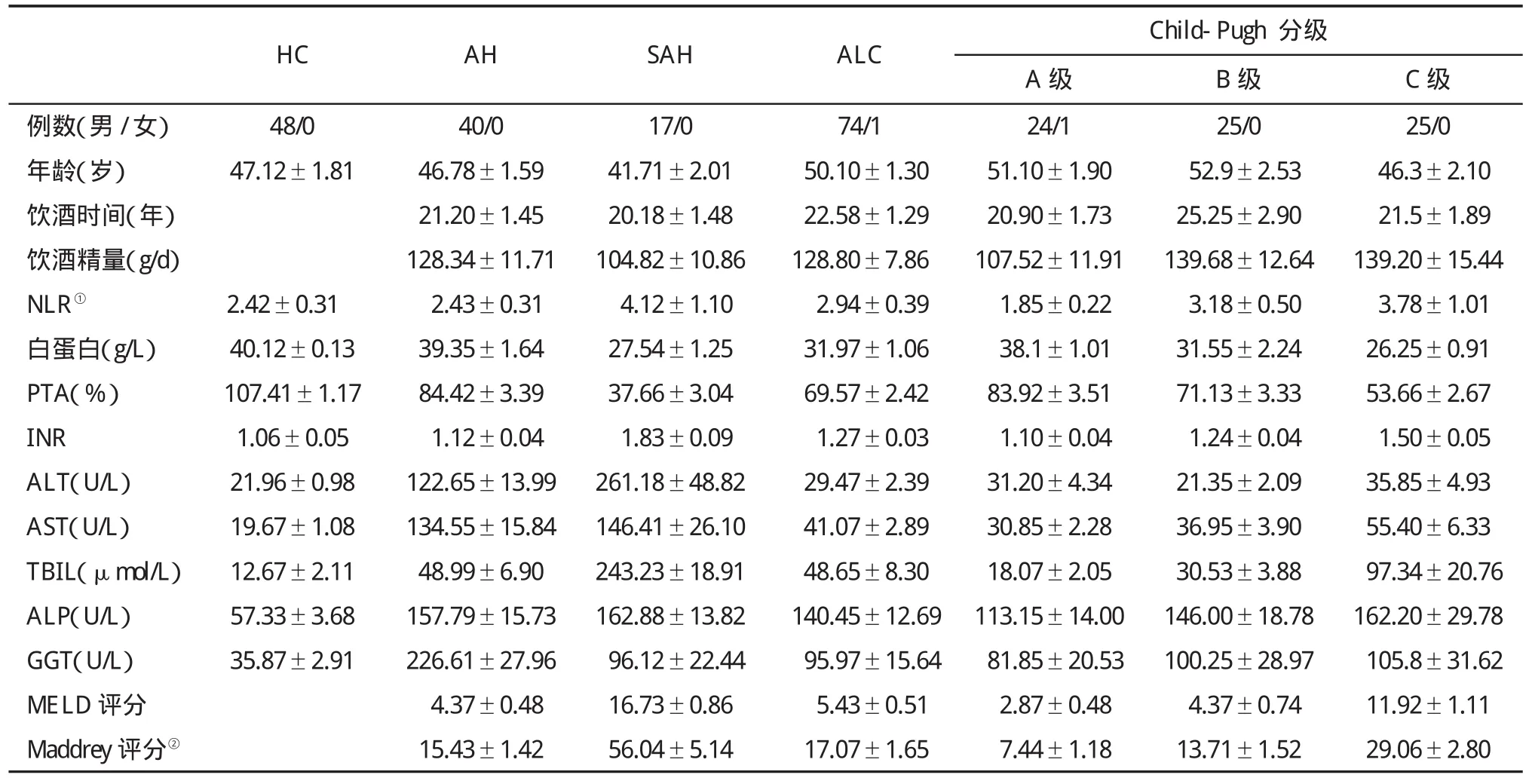
表1 研究对象基线资料
1.2 检测 采用ELISA法检测血清IL-33和sST2(e-Bioscience,Santiago,USA,检测范围分别为 0~720 pg/ml和 0~1000 pg/ml,批内和批间变异系数分别为<5%和<10%),所有样品均进行重复检测。
1.3 统计学分析 应用Windows系统的SPSS 18.0(SPSS Inc.Chicago,IL,USA)统计软件完成。多个组间的多重比较采用Kruskal-Wallis H非参数检验。不同组间的比较采用Mann-Whitney U检验,同组之间的比较采用Wilcoxon rank检验。采用Spearman秩相关,采用双侧检验,P<0.05为差异具有显著统计学意义。
2 结果
2.1 ALD患者外周血浆IL-33和sST2水平明显升高 与HC组比,AH、SAH和ALC患者血清IL-33水平均明显升高 [(42.17±2.41)pg/ml对(85.20±9.44)pg/ml、(68.70±8.14) pg/ml和(64.45±3.78) pg/ml,P<0.001];AH患者较ALC患者IL-33水平明显升高(P<0.05),而Child-Pugh A级、B级和C级ALC患者[(68.50±2.90) pg/ml、(72.47±3.22) pg/ml和(73.68±2.99)pg/ml]无显著性相差(P>0.05)。与 HC 组比,AH、SAH和ALC患者血清sST2水平均明显升高[(43.97±3.01) pg/ml 对 (96.75±11.30) pg/ml、(51.92±11.78)pg/ml和(75.82±6.81) pg/ml,P<0.001];AH 患者血浆sST2水平较SAH和ALC患者均明显升高(P<0.001或 P<0.05);在ALC患者中,Child-Pugh A级血浆sST2水平较B级或C级均明显升高 [(98.37±12.84)pg/ml 对(63.65±5.59)pg/ml和(66.68±15.38)pg/ml,P<0.001]。ALD患者血浆IL-33与sST2水平之间无明显相关(R=0.100,P=0.180,图 1)。
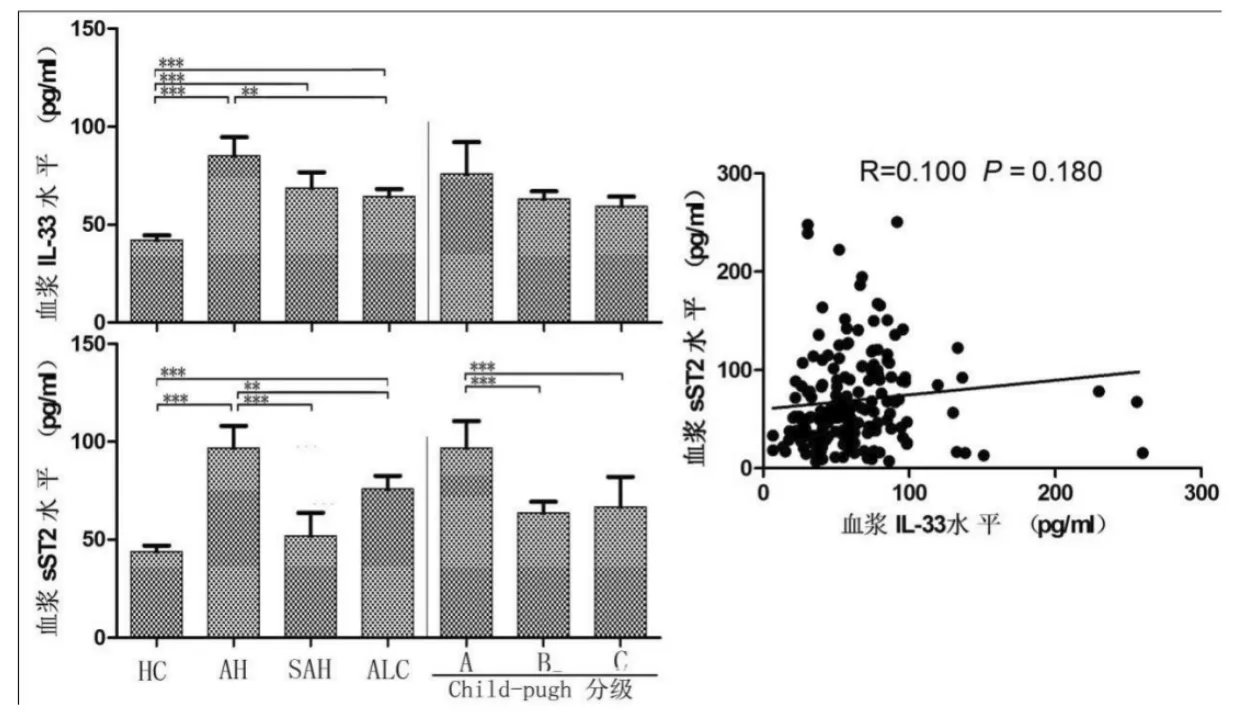
图1 ALD患者与正常人血浆IL-33和sST2水平比较
2.2 ALD患者血清IL-33水平与临床指标的相关性分析 ALD患者血清IL-33水平与淋巴细胞计数(R=0.273,P<0.01)、ALB(R=0.237,P<0.01)、ALT(R=0.462,P<0.001)、AST(R=0.387,P<0.001)和 CHE(R=0.225,P<0.01)水平呈显著正相关,而与中性粒细胞计数(Neutrophils)、TBIL、ALP、GGT、TC和 PTA水平无显著相关性(图2)。
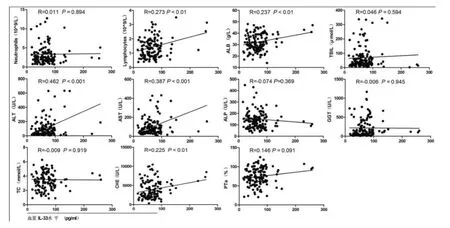
图2 ALD患者血浆IL-33水平与血指标的相关性分析 血浆IL-33水平与淋巴细胞计数(Lymphocytes)、ALB、ALT、AST 和CHE呈显著正相关
3 讨论
IL-33是一个新近发现的IL-1家族细胞因子[3~6],与其它成员有共同的结构域,该结构域由12股B链构成IL-1/成纤维生长因子B的三叶草形折叠[7~12]。与IL-18类似,IL-33产生时是一个缺乏信号肽的前体分子[13],该前体被半胱天冬酶1切割成一个成熟的18×103的蛋白形式,从而使其获得生物学活性。研究表明,可溶性IL-33是一种参与调控TH2免疫反应的调节性炎性细胞因子,在疾病发生中扮演双重角色:即可增强TH2型反应,保护机体免受寄生虫感染和动脉粥样硬化,同时也能加重由TH2和肥大细胞介导的炎症性疾病[14]。近年来,有研究显示IL-33在小鼠和人纤维化的肝中过表达,其表达水平与胶原蛋白的表达水平一致;纤维化的肝脏内活化的肝星状细胞可分泌大量的IL-33,从而诱导肝纤维化的发生和进展[2]。
研究ALD患者不同阶段IL-33水平具有临床意义。本研究收集了不同类型的ALD患者与正常人血清进行ELISA检测,结果发现ALD患者血清IL-33水平明显升高,提示IL-33参与了ALD发病机制中的一种未知机制。IL-33通过结合IL-33受体(ST2和IL-1RAcP)激活MYD88和TRAF-6依赖的信号途径,进一步启动NF-кB和AP-1,导致细胞因子和趋化因子的产生。sST2作为IL-33的拮抗诱饵受体[15],在变态反应性疾病和自身免疫性疾病患者血清ST2和IL-33均升高,同时sST2能够竞争性结合IL-33,从而抑制IL-33/ST2信号途径。ADH患者外周血浆sST2与IL-33水平虽无明显的相关性,但其总体表达相一致,ALD患者sST2升高,进一步支持IL-33在ALD中扮演的重要角色。进一步比较分析发现,IL-33和sST2水平在AH患者中较其他患者明显升高,提示IL-33与疾病的活动存在相关性;ALC患者血浆sST2水平呈显著性下降趋势,随着ALC患者疾病病情的加重,IL-33水平呈现更显著的下降趋势。推测晚期ALC由于肝细胞坏死,纤维细胞增生,IL-33表达水平随之降低。因此,可以应用IL-33作为监测ALD患者疾病进展的评价指标之一。
相关性分析结果则表明ALD患者淋巴细胞计数、ALT和AST与患者血清IL-33水平呈正相关。鉴于免疫系统如Kupffer细胞在ALD发病中扮演了重要作用,推测IL-33可参与ALD炎症反应,加重ALD患者肝脏的病理损害。同时,ALD患者血清IL-33水平与ALB和CHE水平呈正相关,即随着ALD患者外周血浆IL-33水平的降低,其肝脏储备功能也随之降低,即随着疾病进展,IL-33水平降低,推测晚期ALD患者发生肝硬化及其失代偿期,甚至在肝硬化基础上发生SAH,故IL33水平在ALC晚期和SAH患者中趋于降低。本研究发现IL-33在ALD患者血清中呈高水平表达,随着ALD疾病病程的进展,其表达水平则降低。
血浆IL-33及sST2虽然各有变化趋势,且两者在ALD患者的变化趋势大致相同。本研究未显示两者存在明显相关性的可能原因为:IL-33的ST2受体有3个亚型,即ST2L、sST2和ST2V。ST2L为膜锚定形式,限制在Th2细胞和肥大细胞的表面。sST2为分泌性可溶性形式,没有跨膜和胞内结构域。sST2作为IL-33的诱导受体,在变态反应性疾病(如哮喘、过敏性结膜炎、败血症、系统性红斑狼疮)患者血清sST2、IL-33升高。同时,sST2也是IL-33的阻碍受体,能够竞争性结合IL-33,从而抑制IL-33/ST2信号途径。
本研究阐述了IL-33在ALD疾病中的特征及其临床意义,类似研究报道相对较少。研究结论支持IL-33与ALD的发生发展密切相关,参与ALD的发病机制,可作为ALD病情评估的预测指标,为临床医生更加系统地了解和评估ALD提供了参考依据,也为研究人员更加深入的研究ALD的发病机制提供了另一可行方向,IL-33在ALD中的作用还值得后续进一步研究。
[1]Schmitz J,Owyang A,Oldham E,et al.IL-33,an interleukin-1-like cytokine that signals via the IL-1 receptor-related protein ST2 and induces T helper type 2-associated cytokines.Immunity,2005,23(5):479-490.
[2]Marvie P,Lisbonne M,L'helgoualc'h A,et al.Interleukin-33 overexpression is associated with liver fibrosis in mice and humans.J Cell Mol Med,2010,14(6B):1726-1739.
[3]王洪岩,李鑫,徐有青.酒精性肝病发病机制研究进展.实用肝脏病杂志,2014,17(1):5-8.
[4]O'Shea RS,Dasarathy S,McCullough AJ.Alcoholic liver disease.Hepatology,2010,51(1):307-328.
[5]Gao B,Bataller R.Alcoholic liver disease:pathogenesis and new therapeutic targets.Gastroenterology,2011,141(5):1572-1585.
[6]Mello T,Ceni E,Surrenti C,et al.Alcohol induced hepatic fibrosis:role of acetaldehyde.Mol Aspects Med,2008,29(1-2):17-21.
[7]Cruz A,Muntane J.Alcoholic liver disease,oxidative stress,and antioxidants.Rev Esp Enferm Dig,2011,103(8):393-395.
[8]Harrison-Findik DD,Schafer D,Klein E,et al. Alcohol metabolism-mediated oxidative stress down-regulates hepcidin transcription and leads to increased duodenal iron transporter expression.J Biol Chem,2006,281(32):22974-22982.
[9]李鑫,王晨,聂娇,等.酒精性肝炎小鼠肝肠组织变化与内毒素血症的关系探讨.实用肝脏病杂志,2013,16(3):254-256.
[10]Voican CS,Perlemuter G,Naveau S.Mechanisms of the inflammatory reaction implicated in alcoholic hepatitis:2011 update.Clin Res Hepatol Gastroenterol,2011,35(6-7):465-474.
[11]Endo M,Masaki T,Seike M,et al.TNF-alpha induces hepatic steatosis in mice by enhancing gene expression of sterol regulatory element binding protein-1c(SREBP-1c).Exp Biol Med(Maywood),2007,232(5):614-621.
[12]Barksby HE,Lea SR,Preshaw PM,et al.The expanding family of interleukin-1 cytokines and their role in destructive inflammatory disorders.Clin Exp Immunol,2007,149(2):217-225.
[13]Werman A,Werman-Venkert R,White R,et al.The precursor from of IL-alpha is an intracrine proinflammatory activator of transcription.Proc Natl Acad Sci USA,2004,101(8):2434-2439.
[14]谢莉,朱平.IL-33在免疫相关疾病中的研究进展.免疫学杂志,2013,29(6):535-539.
[15]Hayakawa H,Hayakawa M,Kume A,et al.Soluble ST2blocks interleukin-33 signaling in allergic airway inflammation.J Biol Chem,2007,282(36):26369-26380.

