应用454测序技术评价非酒精性脂肪性肝病患者肠道菌群结构差异*
沈 峰,陈建能,郑瑞丹,王晓颖,潘 勤,陈光榆,章瑞南,徐雷鸣,范建高
非酒精性脂肪性肝病(Non-alcoholic fatty liver disease,NAFLD)是指除酒精和其他明确病因以外的因素所致的,以弥漫性肝细胞大泡性脂肪变性为主要特征的临床综合征。其疾病谱包括单纯性脂肪肝(Simple fatty liver,SFL)、非酒精性脂肪性肝炎(Nonalcoholic steatohepatitis,NASH)及其相关肝纤维化或者肝硬化,严重时可进展为肝癌。随着肥胖和代谢综合征的全球化流行趋势,NAFLD已成为当今发达国家和中国富裕地区慢性肝病的首要病因[1]。肠道含有人体最大的贮菌库及内毒素池,其微生物总量达到10~100万亿,总质量约1000克,其基因组更是人体细胞基因组的150多倍[2]。早在80年前Hoefert首次描述了慢性肝病患者肠道菌群种类的改变,揭示了肠道菌群在“肝-肠循环”中所起的重要作用。肠源性物质通过门静脉进入体内,肝脏作为门静脉的首过器官,与肠道微生态不仅在解剖上,而且在功能上都有着密切的联系[3]。近年来研究显示,肠道菌群失衡在SFL、NASH及其相关纤维化或肝硬化进程中发挥着非常重要的作用。随着高通量测序技术及人体肠道菌群宏基因组学研究的进展,肥胖相关的肠道菌群结构特征已逐渐清晰[4],而与肥胖相关的NAFLD患者肠道菌群组成尚不明确。本研究采用454测序技术,对NAFLD患者肠道菌群结构改变的生物学特征进行了初步分析,现报道如下。
1 资料与方法
1.1 研究对象 收集2012年7月至2012年12月在新华医院消化内科进行“肝活检”确诊的成年(>18周岁)NAFLD患者,诊断标准符合《非酒精性脂肪性肝病诊疗指南2010年修订版》[5]。排除标准:过渡饮酒(折合乙醇量大于>140 g/w,女性>70 g/w)、病毒性肝炎(如慢性乙型或丙型肝炎)、药物性肝损伤、全胃肠外营养、HIV感染、自身免疫性肝炎等疾病。同期招募健康体检者作为正常对照组,完成受控衰减参数(Controlled attenuation parameter,CAP) 检 查 ,以CAP<215 dB/m为依据排除肝脂肪变(超过5%)[6]。排除健康人有过渡饮酒、糖尿病、高血压及高脂血症等病史。所有研究对象在入组前2月内停止使用抗生素、微生态调节剂、酸奶、胃肠道动力药物及其他可影响肠道菌群的药物。入组当天空腹完成身高、体质量、腰围等测量,留取肘静脉血5 ml,置-20℃冰箱保存,备血清学测定。本研究方案经新华医院伦理委员会备案,所有研究对象签署知情同意书。
1.2 肝活检 使用MaxCore一次性肝活检穿刺针(18G,美国BARD生物系统公司),在B超引导下行肝活检术。肝组织长度>1.6 cm,每份标本的汇管区数≥6个。将肝组织条立即置于4%中性甲醛溶液中固定,采用改良法脱水、包埋、切片,分别行苏木素-伊红、Masson三色及网状纤维染色,由同一名有经验的病理科医师阅片。参照美国国立卫生研究院关于NASH临床研究网提供的病理工作组指南,进行NAFLD活动度积分(NAFLD activity score,NAS)和纤维化分期评定[7]。NAS包括肝脂肪变(0~3)、小叶内炎症(0~3)及肝细胞气球样变性(0~2),总分为8分。NAS>4分,确诊NASH;脂肪含量分为S0(<5%)、S1(5%~33%)、S2(34%~66%) 和 S3(>66%)。
1.3 粪便总DNA抽提 采集晨起新鲜粪便约1~2 g,立即置于无菌采样盒内,-80℃低温冷冻保存。取200 mg冰冻样品,采用QIAamp DNA Stool Mini Kit试剂盒(德国QIAGEN公司)快速提取和纯化DNA,在完成浓度测定及琼脂糖凝胶电泳评定后,保存于-20℃冰箱。
1.4 16S DNA V3~V5测序 采用聚合酶链反应和焦磷酸测序法,使用16 s V3~V5区通用引物926 F(5’-CCGTCAATTCMTTTGAGTTT-3’) 和 338 R (5’-ACTCCTACGGGAGGCAGCAG-3’),在 5’末端,采用Roche/454特异性接头和(或)多重标签(multiplex identifier,MID)修饰,其PCR产物覆盖V3~V5可变区。配置反应体系50μL,每个反应体系包括PFX DNA 聚合酶(250U)0.8 μL,10×PFX 缓冲液(Mg2+)5 μL,dNTP 混合物(各 10 mM)2 μL、引物 6 μL(各 10 μM),DNA 模板(20 ng)1 μL 和三蒸水 35.2 μL,共50μL。采用AXYGEN磁珠法纯化PCR产物,PCR反应条件为95°C预变性2 min,然后,在95°C条件下变性 20 s,50°C 退火 30 s,72°C 延伸 30 s,扩增 30个循环。使用Roche 454 GS FLX系统(深圳华大基因公司)和焦磷酸测序。
1.5 统计学处理 应用Mothur软件(Version 1.31.2)在97%序列相似度下将非冗余的读长(Reads)进行物种注释,并聚类成可操作分类单元(Operation taxonomy unit,OTU),在每个OTU内51%以上reads的注释结果为该OTU的分类[8]。应用QIIME(Version 1.50,http://qiime.org/index.html)软件,计算样品Alpha多样性相应Shannon指数稀释曲线。应用SPSS 13.0软件对其余数据进行统计学处理,计量资料以()表示,各组之间均数的比较采用t检验;计数资料用率(%)表示,各组之间的比较采用x2检验。以P<0.05表示差异具有统计学意义。
2 结果
2.1 患者一般特征 本研究共纳入经“肝活检”证实的NAFLD患者47例,男性35例,女性12例;年龄(37.7±11.9)岁)。健康人34例,男性27例,女性7例;年龄(40.0±8.0)岁。两组在性别和年龄方面无显著性差异(P>0.05)。NAFLD患者伴有糖尿病5例(10.6%)、高血压6例(12.8%)。肝组织学脂肪变性诊断S1 24例(51.1%)、S2 19例(40.4%)、S3 4例(8.5%);NASH 25例(53.2%);轻度纤维化27例(57.4%)、中度纤维化4例(14.8%)、重度纤维化3例(6.4%)。NAFLD患者体质指数(Body mass index,BMI)、腰围、丙氨酸氨基转移酶(Alanine aminotransferase,ALT)、天门冬氨酸氨基转移酶(Aspartate aminotransferase,AST)、甘油三酯和低密度脂肪蛋白-胆固醇等显著高于健康人(表1,P<0.01)。
表1 非酒精性脂肪性肝病与健康人一般资料()比较
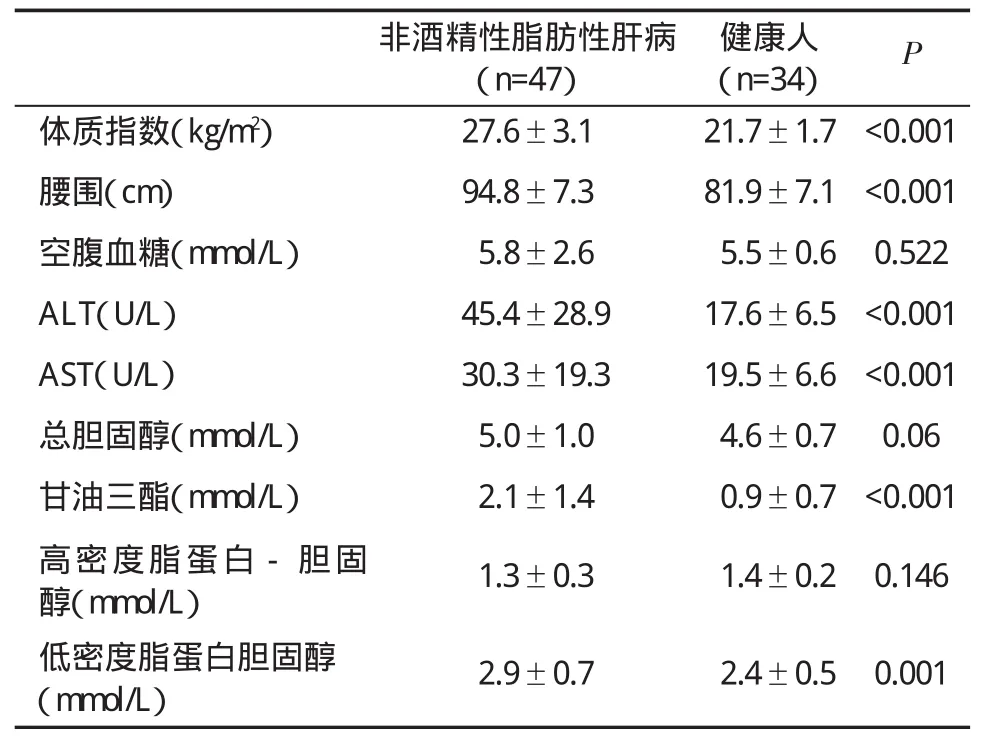
表1 非酒精性脂肪性肝病与健康人一般资料()比较
非酒精性脂肪性肝病(n=47)健康人(n=34) P体质指数(kg/m2) 27.6±3.1 21.7±1.7<0.001腰围(cm) 94.8±7.3 81.9±7.1<0.001空腹血糖(mmol/L) 5.8±2.6 5.5±0.6 0.522 ALT(U/L) 45.4±28.9 17.6±6.5<0.001 AST(U/L) 30.3±19.3 19.5±6.6<0.001总胆固醇(mmol/L) 5.0±1.0 4.6±0.7 0.06甘油三酯(mmol/L) 2.1±1.4 0.9±0.7<0.001高密度脂蛋白-胆固醇(mmol/L) 1.3±0.3 1.4±0.2 0.146低密度脂蛋白胆固醇(mmol/L) 2.9±0.7 2.4±0.5 0.001
2.2 肠道菌群多样性比较 两组人群均完成了测序。在排除与已知序列相似度小于75%的序列后,平均每个样本获得3784条序列。通过序列比对及进行距离矩阵计算后,在97%(即种)水平上进行OTU划分,提示47例 NAFLD患者OUTs为(88.3±28.3),显著低于34例健康人(109.7±30.7)。通过Shannon指数分析群落的丰度和多样性,结果显示NAFLD患者肠道菌群多样性相对于健康人显著减少。
2.3 物种组成分析 在“门(Phylum)”的水平,NAFLD患者厚壁菌门(Firmicutes)所占比例为(51.2±17.8)%,显著高于健康人的[(46.4±12.8)%,P=0.048],而拟杆菌门(Bacteroidetes)在 NAFLD 组为(31.6±18.9)%,显著低于健康人的[(43.3±14.4)%,P<0.001,图 1];在“纲(Class)”的水平上,NAFLD 组厚壁菌门中 Erysipelotrich i纲占(3.2±5.1)%,显著高于健康人的[(1.0±1.2)%,P=0.009],而拟杆菌门中 Bacteroidia纲占(31.0±18.8)%,显著低于对照组的[(42.3±14.0)%,P=0.004,图 2];在“属(Genus)”的水平上,NAFLD 组乳球菌(Lactococcus)占(0.0038±0.0001)%,低于健康组的[(0.0145±0.001)%,P=0.003,图 3A];NAFLD患者普氏菌属(Prevotella)同样也显著减少(P=0.022,图 3B),而链球菌(Streptococcus)在NAFLD占(1.50±0.03)%,显著高于对照组[(0.21±0.24)%,P=0.004,图 3B]。
3 讨论
在SFL、NASH及相关肝纤维化或肝硬化发病中涉及肠道菌群的变化,但过去限于技术条件的限制,对于NAFLD患者肠道菌群的变化仍然知之甚少。近年来,随着技术手段的进步,研究肠道微生物的方法已经从早期的细菌分离培养和基于16S基因的PCR-DGGE、RFLP、16S芯片和16S克隆文库测序等,逐渐发展到16S高通量测序和宏基因组测序,从全基因组水平来分析肠道菌群的构成已成为可能。因此,对于NAFLD患者而言,从肠道菌群的总体构成以及寻找某种特殊的菌种,可以为理解NAFLD/NASH的发病以及从源头上解决热量过剩等提供理论支持。本研究纳入47例经“肝活检”确诊的NAFLD患者和34例健康人,对新鲜粪便进行了454测序,结果发现NAFLD肠道内定植菌群发生了显著变化。通过OTUs比较,发现NAFLD患者肠道菌群多样性明显减少,其菌种结构改变是NAFLD发病的诱因还是结果,还需要研究。
超重或肥胖是人类NAFLD的主要危险因素。微生物学研究通过对肥胖或消瘦人群肠道微生物结构进行对比,发现菌群比例存在一定的差异[9]。动物实验同样发现,小鼠肠道菌群中90%以上由拟杆菌门和厚壁菌门组成,两者比例的改变可能影响能量的吸收。例如,与同窝出生的瘦ob/ob小鼠比,肥胖小鼠肠道中厚壁菌门菌群数量较拟杆菌门显著增加,而对无菌小鼠灌注来自于肥胖小鼠的肠道微生物2周后,则能量吸收效率显著加强,并且体质量也增加[10]。本研究通过OTUs比较,发现NAFLD组肠道菌群多样性明显减少。对系统发育分析提示,NAFLD组厚壁菌门所占比例显著增加而拟杆菌门则显著减少,与既往研究结果类似。进一步在纲的水平上探究该两门中细菌的变化,结果发现与健康人比,拟杆菌门水平上的差异主要由Bacteroidia纲导致,而厚壁菌门的差异主要由Erysipelotrichi纲导致的。也有不少研究表明在2型糖

图1 NAFLD患者与健康人(Control)肠道细菌在门(Phylum)水平的菌群差异比较(以百分比表示) NAFLD患者厚壁菌门(Firmicutes)所占比例显著高于健康人,而拟杆菌门(Bacteroidetes)则低于健康人
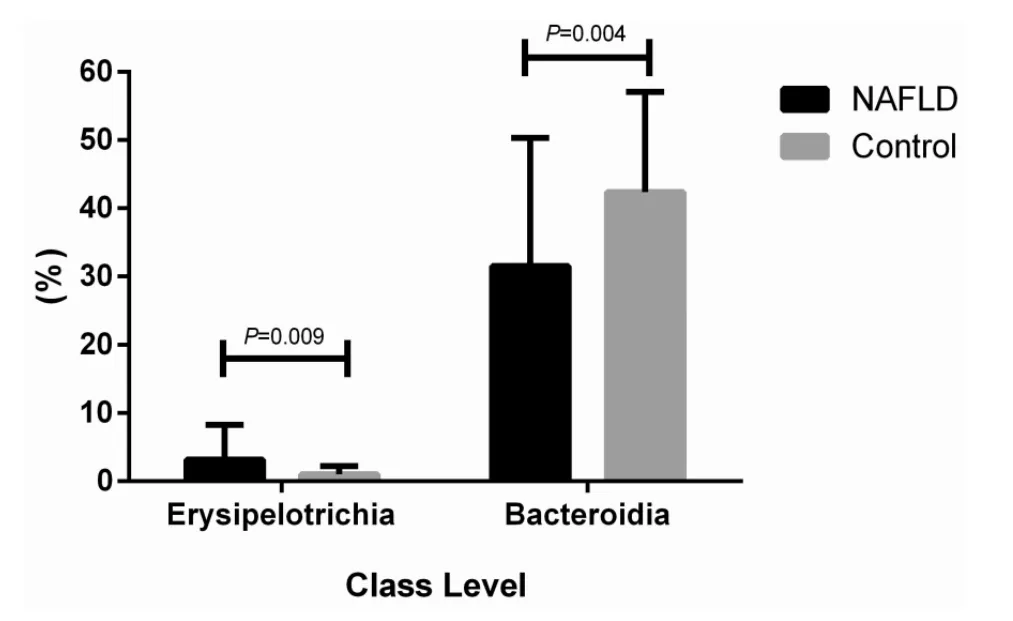
图2 NAFLD与健康人(Control)在纲(Class)水平菌群差异比较(以百分比表示) NAFLD组中Erysipelotrichi纲显著高于健康人,而Bacteroidia纲低于健康人
图3 NAFLD与健康人(Control)在属(Genus)水平菌群差异比较(以百分比表示) NAFLD组乳球菌(Lactococcus)和普氏菌属(Prevotella)比例显著低于健康人,而链球菌(Streptococcus)则显著高于对照组尿病[11]、肥胖人群[12]的肠道菌群表现出了高拟杆菌门和低厚壁菌门的现象,拟杆菌门增加可能与肝脏炎症存在一定的相关性,但目前尚无明确的结论,需进一步研究。
一般来说,人体的肠道粘膜可作为防御外源性物质进入血液的第一道天然屏障。外源性物质在肠道中往往会受到肠道粘膜抗原和炎性因子的免疫监视,一旦逃避其免疫监视,肝脏则充当了第二道屏障的作用。慢性肝病患者常有肝功能异常,导致肝细胞胆汁排泄功能减弱,使得肠道中微生态环境发生变化,肝脏解毒能力降低,造成肠道中有毒物质的蓄积而破坏肠道粘膜屏障,这样容易给过路菌提供接触及吸附黏膜的机会,从而使得环境有害细菌过度的生长,肠壁局部防御能力降低,而这些因素都可以使慢性肝病患者肠道菌群失调加重。本研究在属的水平上研究发现,NAFLD患者Lactococcus属显著减少。Lactococcus属是人体肠道中的一种优势菌,也是益生菌,其数量的减少可能会削弱宿主部分的生理功能,对宿主的健康状态造成不良影响,而其最明显的表现就是让一些外源性的有害菌及条件致病菌数量增加,对肠道的免疫屏障造成损害,最终引起细菌的移位,导致体内多个脏器的严重细菌感染。Streptococcus属广泛存在于自然界及人和动物粪便或鼻咽部,为条件致病菌。该属细菌显著增加的可能原因是由于慢性肝病破坏了肠道的免疫屏障,使得Streptococcus属移位至肠道,导致肠道Streptococcus属数量的上升,从而加剧了肠道菌群的失调。
有关肠道菌群紊乱导致NAFLD发病的可能机制涉及多方面。例如,革兰氏阴性菌产生的脂多糖(lipopolysaccharide,LPS) 导致 Toll样受体(Toll like receptors,TLRs)信号通路活化,后者可能与胰岛素抵抗和NASH发病密切相关[13,14]。LPS还可导致组织胆碱含量减少,增加脂肪聚集肝脏[15],促进内源性乙醇合成[16]和小肠细菌过度生长等有关[17]。动物实验发现经益生菌 (例如 VSL#3、Lactobacillus bulgaricus、Streptococcus thermophilus、Bifidobacterium)或益生元干预后可以改善脂肪肝动物模型肝脏脂肪含量和脂肪酸β氧化。对NAFLD患者进行益生菌干预后也可以发现血清TNF-α、IF-6、ALT、AST和IL-10等水平降低[18]。因此,通过改变肠道微生态(如补充益生菌)来调节肠道能量的吸收或减少肠源性内毒素血症(Intestinal endotoxaemia,IETM)的产生,是 NAFLD临床治疗的新“靶点”,对于NAFLD甚至代谢性疾病的治疗可能是一个很有希望的突破。当然,在临床试验或动物实验中对涉及到的肠道菌群重塑后的稳定性、饮食对于肠道菌群的调控作用、抗生素对于肠道菌群的影响以及粪便移植的方法学等,都需要更多的研究来解决。
本研究还存在一些不足,如样本量较少,尚未分析NASH或肝纤维化程度与肠道菌群失调的关联。这些还有待于今后继续扩大样本量后进行相关研究,从而为丰富NAFLD的发病机制和危险因素预警等机制研究提供重要的循证医学证据。
[1]Fan JG,Farrell GC.Epidemiology of non-alcoholic fatty liver disease in China.J Hepatol,2009,50(1):204-210.
[2]Turnbaugh PJ,Ley RE,Hamady M,et al.The human microbiome project.Nature,2007,449(7164):804-810.
[3]沈峰,范建高.肠道菌群及宏基因组学与非酒精性脂肪性肝病研究现状. 中华肝脏病杂志,2013,21(11):811-814.
[4]Le CE,Nielsen T,Qin J,et al.Richness of human gut microbiome correlates with metabolic markers.Nature,2013,500(7464):541-546.
[5]非酒精性脂肪性肝病诊疗指南(2010年修订版).中华肝脏病杂志,2010,18(3):163-166.
[6]Karlas T,Petroff D,Garnov N,et al.Non-invasive assessment of hepatic steatosis in patients with NAFLD using controlled attenuation parameter and 1H-MR spectroscopy.PLoS One,2014,9(3):e91987.
[7]Kleiner DE,Brunt EM,Van Natta M,et al.Design and validation of a histological scoring system for nonalcoholic fatty liver disease.Hepatology,2005,41(6):1313-1321.
[8]Schloss PD,Westcott SL,Ryabin T,et al.Introducing mothur:open-source,platform-independent,community-supported software for describing and comparing microbial communities.Appl Environ Microbiol,2009,75(23):7537-7541.
[9]Ley RE,Turnbaugh PJ,Klein S,et al.Microbial ecology:human gut microbes associated with obesity.Nature,2006,444(7122):1022-1023.
[10]Turnbaugh PJ,Ley RE,Mahowald MA,et al.An obesityassociated gut microbiome with increased capacity for energy harvest.Nature,2006,444(7122):1027-1031.
[11]Larsen N,Vogensen FK,van den Berg FW,et al.Gut microbiota in human adults with type 2 diabetes differs from non-diabetic adults.PLoS One,2010,5(2):e9085.
[12]Turnbaugh PJ,Hamady M,Yatsunenko T,et al.A core gut microbiome in obese and lean twins.Nature,2009,457(7228):480-484.
[13]Ruiz AG,Casafont F,Crespo J,et al.Lipopolysaccharide-binding protein plasma levels and liver TNF-alpha gene expression in obese patients:evidence for the potential role of endotoxin in the pathogenesis of non-alcoholic steatohepatitis.Obes Surg,2007,17(10):1374-1380.
[14]Shanab AA,Scully P,Crosbie O,et al.Small intestinal bacterial overgrowth in nonalcoholic steatohepatitis:association with tolllike receptor 4 expression and plasma levels of interleukin 8.Dig Dis Sci,56(5):1524-1534.
[15]Dumas ME,Barton R H,Toye A,et al.Metabolic profiling reveals a contribution of gut microbiota to fatty liver phenotype in insulin-resistant mice.Proc Natl Acad Sci U S A,2006,103(33):12511-12516.
[16]Cope K,Risby T,Diehl AM.Increased gastrointestinal ethanol production in obese mice:implications for fatty liver disease pathogenesis.Gastroenterology,2000,119(5):1340-1347.
[17]Soza A,Riquelme A,Gonzalez R,et al.Increased orocecal transit time in patients with nonalcoholic fatty liver disease.Dig Dis Sci,2005,50(6):1136-1140.
[18]Kelishadi R,Farajian S,Mirlohi M.Probiotics as a novel treatment for non-alcoholic fatty liver disease;a systematic review on the current evidences.Hepat Mon,2013,13(4):e7233.

