P2O5催化乙醇脱水反应实验改进
陈雨+丁伟
摘要:使用溴的二氯甲烷溶液检验乙烯,验证了P2O5在乙醇脱水反应中的催化作用。反应过程中P2O5被生成的水消耗,需要当量的作为反应的催化剂。分析实验现象及结果可知,由于P2O5催化下该反应的速率过快,在演示实验中难以及时检验反应生成的产物,容易导致实验失败。将实验装置改进为密闭的体系,不仅实验现象明显,而且能够显著提高实验的成功率。
关键词:P2O5;乙醇脱水;催化剂;中学化学实验教学;实验改进
文章编号:1005–6629(2015)6–0065–03 中图分类号:G633.8 文献标识码:B
在中学化学乙醇脱水制乙烯的实验中,一般使用浓硫酸作催化剂和脱水剂。由于浓硫酸除了具有脱水性以外,还具有强氧化性,常常会将乙醇氧化生成炭黑和其他气体杂质。这些副反应不仅干扰学生对化学实验现象的观察,往往还会影响对实验产物的判断。并且由于副反应“乙醇分子内脱水制乙醚”易于发生,该反应仅仅在实验条件“温度”方面略有差别,使得操控反应条件和产生的反应产物更加复杂。为了克服这些缺点,不少专家学者对此化学实验做了改进,其中应用最广泛的以苏教版《有机化学基础》中的改进为代表,使用五氧化二磷为催化剂和脱水剂制取乙烯气体。五氧化二磷之所以能够代替浓硫酸,是因为它有很好的脱水性和吸水性,能够与水发生反应,减少体系中水分的存在进而促进脱水反应的进行。
对于此种改进王程杰等人利用实验手段验证了其可行性,并通过实验比较了三种催化剂即浓硫酸、五氧化二磷和石棉绒的催化效果,实验表明五氧化二磷的催化效果最佳[1]。随后陆燕海、王强等人发现教材上实验装置的不足,对此进行了改进,并有以下的一些发现[2]:(1)在五氧化二磷上滴加乙醇会发出“吱吱”的响声,并伴有放热现象;(2)在反应过程中有磷酸酯等副产物产生。
与此同时,王金龙等也有类似的发现,并通过实验推理认为五氧化二磷并不能催化乙醇脱水制取乙烯[3]。随后,李先栓也通过实验推断在五氧化二磷和乙醇混合加热的实验中得到的并不是乙烯而是磷酸酯[4]。为了验证这个化学反应,吕亚娟等人又通过实验探究,发现在加热到210~258℃时,五氧化二磷会催化乙醇脱水制取乙烯[5]。尽管证明了五氧化二磷在乙醇脱水制取乙烯反应中的催化作用,但是如此之高的温度使得改进的方案并不是那么理想,同时还有磷酸酯等副产物的产生,使得五氧化二磷作为催化剂和脱水剂与浓硫酸相比较时并不占优势。此外,马春生也同样验证了这一反应,通过使用GC-Mass等精密仪器的检测,确定五氧化二磷在高于200℃的条件下能够催化乙醇脱水生成乙烯,但是在较低温度下并不能生成乙烯气体[6]。
通过以上的分析可见,五氧化二磷与乙醇混合时发生反应较复杂,究竟多少温度才是适合于产生乙烯的化学反应条件呢?五氧化二磷若是作为催化剂和脱水剂,在乙醇不断脱水过程中,体系中的水必然会与五氧化二磷发生反应从而消耗五氧化二磷,这就导致随着化学反应的进行,体系中的催化剂会减少甚至消耗殆尽,那么五氧化二磷与乙醇的配比多少才有利于乙醇的产生而减少磷酸酯副反应的产生?带着这样的问题,进行了以下的实验研究。
1 实验设计
由于在五氧化二磷存在的条件下,乙醇脱水制取乙烯的化学反应过程中生成的水会消耗五氧化二磷,所以五氧化二磷的用量至少与乙醇当量或略过量一些,并且反应使用的乙醇含水量应越少越好,以无水乙醇为宜。实验中使用化学纯无水乙醇,含水量小于0.1%。若反应中取用无水乙醇2mL,根据其密度(0.789 g/mL)及摩尔质量(46 g/mol),可计算出乙醇的物质的量约为0.068mol。假设乙醇完全脱水,产生的水的物质的量应当为0.068mol,产生的水将消耗掉0.068mol五氧化二磷。由于五氧化二磷的摩尔质量为142 g/mol,计算需要的P2O5的量约为2.4g。
2 实验用品
原料:分析纯无水乙醇(国药),分析纯P2O5(国药),二氯甲烷(国药),液溴(国药)
仪器:三颈瓶,球形冷凝管,乳胶管,试管,橡胶塞,20mL针筒(带针头),两通管,玻璃导管,磁力搅拌式加热器,油浴缸
3 实验内容
(1)加热无水乙醇,并将乙醇蒸气通入溴的二氯甲烷溶液中,一段时间后观察现象。
(2)取2.5g P2O5于试管中,加入2mL无水乙醇。测量反应液温度。
(3)取2.5g P2O5于试管中,加入2mL无水乙醇。将反应产物通入溴的二氯甲烷溶液中,观察现象。再分别于100℃、120℃、140℃和160℃的油浴锅中试验,观察现象。
(4)取五只三颈瓶,分别加入2.5g P2O5,将五只三颈瓶分别置于室温、100℃、120℃、140℃和160℃的油浴锅中。如图1搭建好装置,待三颈瓶内温度与油浴锅一致时,分别加入2mL无水乙醇。锥形瓶内盛有溴的二氯甲烷溶液,观察现象。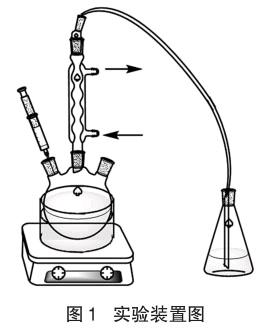
4 实验结果及讨论
通过实验(1)可知,乙醇蒸气并不能使溴的二氯甲烷溶液褪色。那么如果反应产物能使溴的二氯甲烷溶液褪色,则能够说明乙醇脱水反应发生并生成乙烯气体。
实验(2)中,将乙醇滴入到盛有五氧化二磷的试管中时,可以观察到迅速发生剧烈反应,产生大量气泡并且放出大量的热,由于产生大量气体冲出试管,因此能听到“吱吱”的声音。在实验过程中使用温度计观测反应温度,可知在反应过程中最高可以达到94℃。
实验(3)则是重复实验(2),并将产生的气体通过导管通入到溴的二氯甲烷溶液中,但是并没有观察到溴的二氯甲烷溶液有褪色现象。再次重复实验并将反应温度分别控制在100℃、120℃、140℃和160℃时,依然没有观察到溴的二氯甲烷溶液褪色。但是考虑到在进行实验(2)的过程中,观察到乙醇加入后便迅速发生反应,研究者猜测可能是由于化学反应速率太快,使得产生的乙烯在将橡胶塞塞紧之前便逸出,因此导致未观察到褪色现象。
所以在实验(4)中,将实验装置改成全密闭体系,在三颈瓶中预装好2.5g的五氧化二磷,并使用回流冷凝管将乙醇蒸气冷凝,接着将产生的气体通入到溴的二氯甲烷溶液中。搭建好装置后,使用注射器将无水乙醇加入到三颈瓶中。实验过程中我们发现,反应产生气体非常迅速,滴加乙醇后,不到1s便会产生气体,并且滴加的速度越快,产生气体的速度也越快。我们可以通过控制无水乙醇的滴加速度来控制气体产生的速度,使产生的气流较平稳。实验(4)中的五个实验均可观察到溴的二氯甲烷溶液褪色,因此可以初步判断乙醇发生了脱水反应并生成了乙烯。并且反应速率及溴的二氯甲烷溶液褪色的速率与温度没有任何关系,在室温下反应也可进行。
对比实验(1)和(4)可知,使溴的二氯甲烷溶液褪色的不可能是乙醇蒸气。对比实验(3)和(4)可知,五氧化二磷与乙醇混合时反应速率很快,并且产生的气体能够使溴的二氯甲烷溶液褪色。通过实验(2)和(4)可知,由于在室温下混合五氧化二磷和乙醇,溶液温度能够达到94℃,因此不需加热该反应也能够顺利进行。反应后,三颈瓶内剩余液体为淡黄色的油状液体并带有水果香味,通过文献查阅可以初步判定含有磷酸酯。
反应后将褪色的溴的二氯甲烷溶液收集起来,并通过萃取、干燥、蒸发、浓缩等步骤提纯后得到无色油状液体。使用TMS标记的氯仿做内标,经NMR核磁共振技术测试,得到氢谱进行分析可知产物为二溴乙烷,即乙烯与溴的加成产物,因此证明了乙醇脱水产物乙烯的存在,说明五氧化二磷能够催化乙醇脱水并生成乙烯。
由于乙醇脱水后产生水分子能与五氧化二磷发生反应生成磷酸,这时磷酸会与乙醇反应生成磷酸酯,因此与乙醇脱水反应形成竞争关系。由于酯化反应所需温度较高,所以为了降低竞争反应,且考虑到节约能源,可以不使用油浴锅进行加热,只在室温下让其发生反应。这样不仅降低了酯化反应的速率,还能够起到节能减排的作用。又由于五氧化二磷催化乙醇脱水反应速率很快,推测副反应即酯化反应进行的程度应当很小。
由于反应速度快,可以推测,反应并不是由于五氧化二磷与水反应生成的磷酸所电离出的氢离子催化进行,通过查阅文献可知五价磷也具有一定的酸性,可以催化该反应进行。
5 实验结论
综上所述,可以得到以下几个结论:
(1)五氧化二磷能够作为催化剂催化乙醇分子内脱水反应的发生,并且该反应在五氧化二磷的催化下进行得十分迅速。随着反应的进行,反应体系内产生的水会消耗催化剂五氧化二磷,因此为保证在乙醇完全消耗之前有足够的催化剂,所以在反应中应当使用与乙醇用量当量的五氧化二磷。由于在五氧化二磷存在下,乙醇脱水的反应速率远大于乙醇发生酯化的反应速率,因此为抑制乙醇发生酯化反应,在实验中应当使用反应物五氧化二磷与乙醇的物质的量之比为1:1的用量。
(2)在100℃、120℃、140℃和160℃温度下,乙醇脱水反应均能够顺利进行,在常温下,加入五氧化二磷后乙醇也能够脱水生成乙烯。但是若将反应体系温度控制在25℃时,反应并不能够顺利进行,说明该反应需要一定的反应温度,即100℃。由于五氧化二磷加入到乙醇中时迅速放出大量的热能够将体系温度升高到100℃,所以该反应在常温下也能进行。
由于五氧化二磷催化乙醇脱水速度非常快,因此日常的实验难以将生成的乙烯捕捉,导致中学演示实验中没有明显的实验现象。对此,可以对反应装置进行改进,使用Y形管为反应容器,将五氧化二磷和无水乙醇分别放入Y形管的两端并塞紧橡胶塞。由于反应放热,在反应结束后会导致倒吸现象,为防止这一现象的发生可以在发生装置和检验装置之间加一个干燥球作为缓冲装置。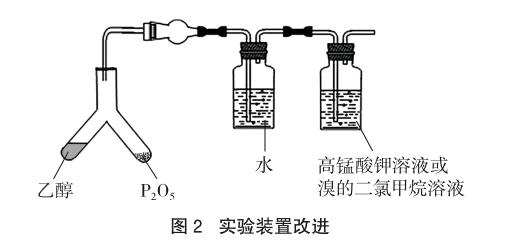
通过以上分析可知,在五氧化二磷存在下乙醇能够迅速脱水而生成乙烯,由于在实验演示的过程中,迅速产生的乙烯无法被捕捉和检验到,因此常常会导致实验失败使得一些教师怀疑该实验的可行性。通过对实验产物的检测,可以看到该反应确实能够发生,为了解决课堂演示中出现的问题,改进实验装置为全密闭体系,在体系中预装两种反应物,当需要反应发生时可以将两种物质混合,密闭体系能够避免乙烯逸散,学生可以明显地观察到实验现象。
参考文献:
[1]刘波,王程杰.对乙醇脱水制乙烯实验的新研究[J].化学教学,2007,(5):12~14.
[2]陆燕海,王强. P2O5催化乙醇制乙烯实验反应条件的探究[J].化学教学,2010,(8):14~16.
[3]王金龙.五氧化二磷使乙醇脱水的实证探索与反思[J].化学教学,2010,(1):68~70.
[4]李先栓.“五氧化二磷使乙醇脱水”实验方案的调研报告[J].广州化工,2011,(16):190~193.
[5]吕亚娟.对五氧化二磷催化乙醇制取乙烯的再研究[J].化学工业,2011,(36):112.
[6]马春生.对五氧化二磷催化乙醇脱水反应的研究[J].化学教学,2011,(6):68~71.

