两株抗肝癌细胞单链抗体三维结构的同源模建
叶 刚 钟 健 汤绍辉 黄 卫 周 旻 卢筱华 杨冬华
(暨南大学附属第一医院消化内科,广东 广州 510632)
噬菌体抗体库技术的发展使重组抗体的研究突飞猛进。其中,单链抗体(scFv)以其许多的优点而在肿瘤的诊断和治疗方面引起广泛重视。单链抗体是由抗体轻链和重链可变区通过一个短肽连接而成,具有亲本抗体全部抗原结合特异性,其分子量小,容易进入病灶组织的周围循环及在肾内清除快;缺少恒定区(Fc段),不与具有Fc受体的非靶细胞结合,因此在体内定位诊断时背景低、图像清晰,在肿瘤的影像分析、导向治疗、新药设计等多个领域具有巨大的应用价值。2001年本课题组采用噬菌体表面展示技术构建了库容为2.1×105抗肝癌噬菌体单链抗体库〔1〕,随后在此基础上成功将库容扩大至5.3×107,并采用固相筛选法筛选出一株特异性抗肝癌的单链抗体HscFv 4-16〔2〕(GenBank 登录号:DQ640759)。以 原始克 隆HscFv 4-16为模板,联合采用错配PCR、DNA改组和定点突变技术,获得了高亲和力的抗肝癌单链抗体DM〔3〕。为了解二个scFv三维结构的异同,本研究采用同源蛋白结构模建技术,模拟构建特异性抗肝癌单链抗体的三维结构,为进一步提高抗体亲和力和人源化改造奠定基础。
1 材料与方法
1.1 材料 肝癌细胞特异性单链抗体HscFv4-16和进行亲和力成熟后的单链抗体DM的核苷酸序列均由本课题组提供。同源蛋白分析借助基因数据库(EMBL+Genbank+DDBJ),参考蛋白的结构坐标来源于蛋白质晶体结构数据库(PDB)。所有分子模建、能量优化均在Sgi图形工作站上,采用Accelrys公司的InsightⅡ98商用软件包完成。
1.2 方法
1.2.1 确定抗体的一级结构 将肝癌细胞特异性单链抗体HscFv 4-16和DM的核苷酸序列转变为氨基酸序列,并确定开放阅读框(ORF),去除载体序列的污染。
1.2.2 搜索同源结构参考蛋白 将VH、VL基因序列与基因数据库(EMBL+Genbank+DDBJ)中已知的基因做同源性分析,确定VH和VL的同源结构参考蛋白。
1.2.3 确定VH和VL结构域的SCR区和LOOP区 用InsightⅡ的HOMOLOGY程序包,进行结构比对,通过主链碳原子Cα均方根位移(RMS)比较,结构叠合RMS<1Å的区域确定为参考蛋白的结构保守区(SCR),结构叠合RMS>1Á的区域确定为结构可变区(LOOP区)。
1.2.4 scFv空间结构模建 将参考蛋白的SCR坐标赋值给目标蛋白相应的SCR;在环区结构库中搜寻目标蛋白的非保守结构;完成侧链安装,修复N、C末端结构;在模建结构的两对Cys残基之间加上二硫键。
1.2.5 结构优化 采用能量极小化和分子动力学两种方法使预测的结构在能量和物化上趋于合理。用InsightⅡ的DISCOVER程序包进行优化。对环区先后采用最陡下降法(Steepest Descent)和共轭梯度法(Conjugate gradient method))优化200步和5000步;再采用最陡下降法对侧链进行优化。然后用 Dynamics进 行动 力学 模 拟,设 Equilibration=50,Temperature=300 K,Step=2000。最后用 Prostat〔4〕对优化后的结构进行合理性验证。
2 结果
2.1 抗体的一级结构 HscFv 4-16和DM基因均为729 bp,均为一开放阅读框,各编码243个氨基酸。VH基因长363 bp,编码121个氨基酸,VL基因长321 bp,编码107个氨基酸,二者由编码(Gly4Ser)3的45 bp的连接肽连接成VH-linker-VL。VH和VL基因中均有四个框架区(FRs)和三个互补决定区(CDRs),以及维持抗体结构所必需的特征性的两个半胱氨酸残基,HscFv 4-16和DM的VH、VL的氨基酸序列均符合鼠抗体可变区特征。
2.2 同源结构参考蛋白的确定 综合考虑同源性(ID)、分辨率、蛋白功能等,VH选择了1A6W等10条重链作为候选结构模板,ID从70% ~74%,分辨率在1.5~2.7 Å。VL候选结构模板选择了1AY1等7个抗体结构,ID在76% ~85%,分辨率在1.95~2.65 Å。蛋白类别均为抗体。将候选模板做结构比对,通过结构叠加,以RMS<1 Å和m-block为标准,去除结构不匹配的模板。H1A6W、H1IQW和 H1QAX三者的 RMS为0.464 Å,m-block 包含 92.3% 残基;L1AY1、L1BQL 和 L2IFF 三者的 RMS为0.466 Å,m-block包含91.6%残基,最终分别被确定为HscFv 4-16和scFvDM的VH和VL的结构参考蛋白。通过序列比对,确定HscFv 4-16和scFvDM的VH和VL分别有个2个SCR区和1个LOOP区(图1和图2)。
2.3 模建VH和VL的空间构象 VH和VL各SCR区的主链坐标直接由同源性最高的同源蛋白相应的SCR区结构赋值生成。LOOP区主链碳原子Cα的空间构象是参照LOOP区前后保守区的Cα距离矩阵及LOOP区中氨基酸数目和类型,从结构数据库搜索获得。
2.4 模建完整scFv的空间构象 将已模建VH和VL的坐标赋值给scFv;再通过Loop Generate产生linker,linker从外侧连接VH和VL,不影响结构;最后在结构中的CysH24与CysH98,CysL159与CysL223之间加上二硫键。这样,就获得了scFv4-16和scFvDM的初始三维结构。
2.5 结构优化 对初始结构进行分子力学和动力学优化后,scFv 4-16和scFv DM的RMS Derivative分别为0.0000538和0.0000463;测定结构的二硫键键长,优化前scFv 4-16的为3.1 Å和 2.54 Å 和 scFv DM 的为2.98 Å 和 2.81 Å,优化后前者的为 2.0 Å 和 1.99 Å,后者的为 1.99 Å 和 1.98 Å;用 Prostat验证,模建的三维结构scFv 4-16和scFv DM的81.3%和79.8%的Φ和Ψ分布于Ramachandran图的核心区域,模板1NQB的为83.2%,说明结构合理。
2.6 scFv 4-16和scFv DM的三维结构 按同源模建步骤模建获得HscFv 4-16的三维结构(如图3所示)与已知晶体结构的抗体结构类似,结构显示VH和VL紧密结合在一起,Linker从结构的外侧连接VH的C端和VL的N端,不影响抗体的构象(如图4所示);链内由二硫键固定,VH和VL的二硫键分别位于CysH24与CysH92,CysL23与CysL88(Kabat编号)。图5可见,HscFv 4-16结构六个CDR襻位于Fv段的N端,CDRL3和CDRH3,CDRL2和 CDRH2,CDRL1和CDRH1相对,围成一个与抗原结合的疏水口袋,口袋深 15.6 Å。其中 CDRL3和CDRH3与抗原最接近,有较多接触。scFvDM和HscFv 4-16的三维结构相似,scFv DM的CDRL3和CDRH3两个襻比scFv 4-16的更靠近中央,口袋深16.1 Å。
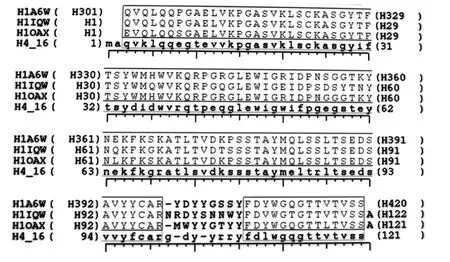
图1 VH与结构模板的序列比对
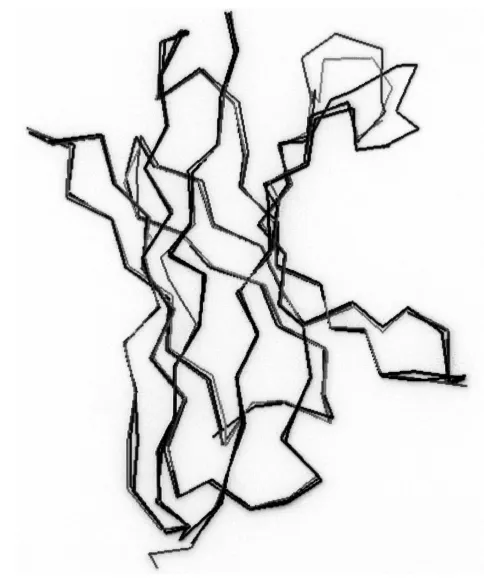
图2 VH结构模板的结构叠加

图3 HscFv 4-16三维结构飘带图侧面观(黄色为轻链FR区,蓝色为重链FR区,紫色为CDR区,红色为Linker)
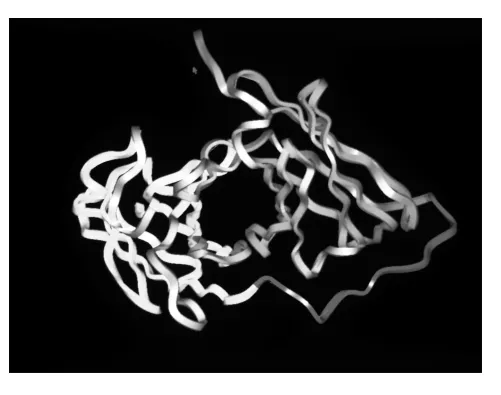
图4 HscFv 4-16三维结构飘带图顶面观(黄色为轻链FR区,蓝色为重链FR区,紫色为CDR区,红色为Linker)

图5 HscFv 4-16和scFv DM三维结构线形图 (红色为HscFv 4-16,蓝色为scFv DM)
3 讨论
蛋白质的功能与其空间结构有着密切的关系,因此,掌握蛋白质的结构信息对于研究蛋白质的功能及作用机制具有重要意义。X射线晶体学方法和多维核磁共振技术是目前测定蛋白质结构的主要方法,然而蛋白质结构的测定远远赶不上基因组测序速度。分子模拟技术为蛋白质的结构预测和功能测定提供了一种崭新的手段,它在蛋白质的结构预测和模建工作中占有举足轻重的地位〔5〕。蛋白质同源模建是目前公认最实用和可靠的蛋白结构预测技术。同源模建的理论依据是Anfinsen原理,即蛋白质分子的一级序列决定其三维空间结构。如果能在蛋白质结构数据库中找到序列同源性大于30%的已知结构作模板,即可以进行一定程度的预测,特别是结构域部分的预测。
本实验模建的HscFv 4-16的立体构象显示,VH和VL分别由10个和9个β折叠组成两个片层结构,由一个链内二硫键固定,六个CDR襻位于Fv段的N端,形成一个与抗原结合的空腔,深 15.6Á。CDRH3和 CDRL3相对而立,位居中央,说明CDR3对抗体抗原结合的影响最大。因此选择该区域的氨基酸残基进行定点突变可能会对抗体功能产生重大影响。
本课题组以原始克隆HscFv 4-16为模板,经过4个重叠延伸PCR反应,依次引入 四个突变(按Kabat编号):CDRH1区H31(Phe→Ser)、CDRH3区 H100(Arg→Leu)、CDRL1区 L30(Ile→Thr)、CDRL3区L91(Trp→Arg),从而获得新突变体scFv DM。在对新突变体scFv DM相对亲和力和特异性进行测定后发现,DM的抗原结合特异性不变,相对亲和力则为原始克隆scFv 4-16的3.9倍〔3〕。研究已证实抗原与抗体结合的部位总在CDR表面的中央。从二者三维结构的重叠图看,scFv DM的CDRL3和CDRH3两个襻比HscFv 4-16的更靠近中央,疏水口袋比scFv 4-16的更深,其他区域几乎完全重叠。由此可以从结构上解释DM与抗原结合得更紧密,相对亲和力较原始克隆scFv 4-16提高。
抗体和抗原的结合除了空间结构的相互适应外,疏水作用和静电引力也起到重要的作用。Arg的侧链在一般情况下都带有电荷,常存在于蛋白质分子表面,能与相反电荷的基团形成盐键,特别是容易与Glu或Asp形成盐键,经常涉及活性位置〔6〕。CDRL3区 L91由 Trp→Arg,相邻的 L90和 L92分别是Glu和Ser,它们之间产生的盐键有助加强疏水作用。Ser和Thr具有短链的-OH基团的侧链,而-OH基团可作为氢键的受体或者供体,因而它们(尤其是Ser)是化学上活泼的,常作为活性部位的残基而具有十分重要的功能〔7〕。CDRH1区H31由Phe→Ser、CDRL1区 L30由Ile→Thr,亲和力的提高可能还与Ser和Thr与相邻骨架肽键基团-NH-或-C=O形成氢键有关。
本实验采用蛋白质同源模建技术成功模建特异性抗肝癌单链抗体HscFv 4-16和scFv DM的三维结构。HscFv 4-16和scFvDM的抗原抗体结合部位由CDRH3和CDRL3,CDRH1和CDRL1围成,其中CDRH3和CDRL3与抗原有较大接触,功能氨基酸残基应位于这一部位,因此选择该区域的氨基酸残基进行定点突变可能会对抗体功能产生重大影响。亲和力成熟的实验结果亦证实了这一推论,为抗体的人源化改造,和进一步提高抗体亲和力打下了基础。
1 毕向军,杨冬华,崔 俊,等.抗肝癌单链抗体的构建及其结合特性〔J〕.上海免疫学杂志,2001;21(5):289-92.
2 周 旻,杨冬华,汤绍辉,等.集落挖掘法在抗肝癌噬菌体单链抗体库筛选中的应用〔J〕.中国病理生理杂志,2005;21(6):1246-8.
3 卢筱华,杨冬华,汤绍辉,等.错配PCR和DNA改组技术提高抗肝癌单链抗体亲和力〔J〕.中国病理生理杂志,2006;22(6):1203-6.
4 Zhang Y,Li ZS,Sun M,et al.Molecular simulation studies of a seleniumcontaining scFv catalytic antibody that mimics glutathione peroxidase〔J〕.Biochim Biophys Acta,2005;1747(1):27-34.
5 刘 伟,丁祖泉,王 海.蛋白质结构与功能研究中的分子模拟技术〔J〕.上海生物医学工程,2006;26(1):20-5.
6 Germain N,Mérienne K,Justin SZ,et al.Molecular and structural basis of the specificity of 6a neutralizing acetylcholine receptor-mimicking antibody,using combined mutational and molecular modeling analyses〔J〕.J Biol Chem,2000;275(28):21578-86.
7 Huang MD,Furie BC,Furie B.Crystal structure of the calcium-stabilized human factorⅨgla domain bound to a conformation-specific anti-factor IX antibody〔J〕.J Biol Chem,2004;279(14):14338-46.

