海藻糖对异氟烷诱导转APP基因小鼠海马氧化应激损伤的影响
裴爱月 朴美花 刘 楠 徐珊珊 冯春生 (吉林大学第一医院麻醉科,吉林 长春 130021)
动物实验和临床研究表明,全麻能够增加阿尔茨海默病(AD)发病的风险,加重AD的神经病理改变〔1〕。研究发现氧化应激和自由基损伤与AD神经元凋亡密切相关〔2〕;临床相关浓度的吸入麻醉药异氟烷能够诱导神经细胞凋亡,加剧AD神经病理进程〔3〕,但其机制是否与氧化应激损伤有关还有待进一步研究。海藻糖是一种天然的细胞保护剂,具有抗氧化应激损伤能力,可以保护细胞对抗多种有害刺激和损伤(如脱水、氧化应激、高温等)〔4〕,但海藻糖能否治疗/减轻吸入麻醉药异氟烷对AD的神经毒性作用尚不清楚。本研究拟应用转淀粉样前体蛋白(APP)基因小鼠的体内AD模型,探讨异氟烷对转APP基因小鼠海马氧化应激损伤的影响及海藻糖的干预保护作用。
1 材料与方法
1.1 实验试剂和药品 DNA末端转移酶介异的缺口末端标记法(TUNEL)试剂盒购买于美国Roche公司;海藻糖(trehalose)、二氯二氢荧光素-乙酰乙酸酯(DCFH-DA)购自美国Sigma公司;异氟烷购于美国雅培公司;丙二醛(MDA)、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)、过氧化氢酶(CAT)检测试剂盒均购自南京建成生物工程研究所。二喹啉甲酸(BCA)蛋白定量试剂盒购自Pierce公司。兔抗鼠SOD、GSHPx、CAT多克隆抗体购自 Abcam公司。辣根过氧化物酶(HRP)标记的山羊抗兔IgG抗体购自Santa Cruz公司。
1.2 实验动物分组及处理 12月龄转基因APP小鼠60只(购自中国医学科学院医学实验动物研究所),雌雄各半,体重20~30 g。笼养,自由进水、进食,室温保持在18℃ ~25℃,随机将小鼠分为四组(n=15):正常对照组(Control组)、异氟烷组(Iso组)、异氟烷+海藻糖组(Iso+Tre组)、海藻糖组(Tre组)。Iso组小鼠在自制的透明麻醉箱中实施麻醉,麻醉箱有两个侧孔,一侧孔连接麻醉机,持续通入流量2 L/min的O2,通过调节麻醉挥发罐吸入异氟烷,另一侧孔接气体监测仪监测流出气体中异氟烷、O2和CO2浓度。脉搏血氧饱和度探头贴于小鼠腹部监测血氧饱和度、心率。吸入3%异氟烷麻醉诱导,待翻正反射消失后调节挥发罐使麻醉箱内异氟烷浓度为1.4%,异氟烷麻醉2 h后吸入100%氧气,待动物苏醒后返回饲养笼中;Iso+Tre组,小鼠于麻醉前30 min腹腔注射海藻糖400 μg/kg,然后给予1.4%异氟烷麻醉2 h;Tre组,小鼠腹腔注射海藻糖400 μg/kg处理;正常对照组小鼠不给任何药物,在麻醉箱持续通入流量2 L/min的O2处理2 h。
1.3 Morris水迷宫检测 每组各随机抽取5只转APP基因小鼠于麻醉后24 h开始进行Morris水迷宫实验。实验指标:①定位航行实验。前5 d连续进行,1次/d,分别从四个象限将小鼠头朝池壁入水,自动摄像系统和计算机分析处理系统记录到的每只小鼠找到平台的时间为逃避潜伏期,若90 s后仍不能找到平台,以90 s计算。小鼠如找不到平台应引导小鼠至平台停留15 s。②空间搜索实验。第6天进行空间探索试验,将小鼠按照Ⅰ-Ⅱ-Ⅲ-Ⅳ象限的顺序从各入水点放入水池,记录小鼠120 s内在原平台所在象限的滞留时间,即为空间探索时间。
1.4 海马内活性氧(ROS)测定 各组小鼠麻醉后6 h杀鼠取海马组织,加入匀浆缓冲液冰上匀浆,制成10%组织匀浆,离心,取上清液,加入终浓度为10 μmol/L DCFH-DA荧光探针溶液,在37℃、5%CO2的培养箱中孵育20 min,磷酸盐缓冲液(PBS)清洗3次。细胞经1000 r/min离心5 min,去掉上清后,应用荧光分光光度计在激发波长488 nm,发射波长525 nm处检测细胞内DCFH荧光强度表示ROS水平。
1.5 海马MDA含量和SOD、GSH-Px、CAT活性检测 各组小鼠麻醉后6 h杀鼠取海马组织,加入匀浆缓冲液冰上匀浆,制成10%组织匀浆,离心,取上清液,待测,采用BCA试剂盒进行蛋白定量。海马MDA含量和SOD、GSH-Px、CAT活性的测定操作均按照试剂盒说明书进行。用荧光分光光度仪测定各管吸光度,计算出MDA含量和SOD、GSH-Px、CAT活性。
1.6 免疫组织化学染色检测海马MDA含量和SOD、GSH-Px、CAT的表达 小鼠麻醉后6 h每组随机抽取6只小鼠,制作海马冰冻组织切片。4%多聚甲醛心脏灌流固定后取脑,浸泡在4%多聚甲醛中4℃过夜,蔗糖溶液梯度脱水,液氮速冻30 s后-80℃冰箱保存。-20℃冰箱复温后,取7 μm的冠状位脑片,每隔6片选一片,每只小鼠选用3张脑片,-20℃丙酮固定。将脑片用PBS漂洗3 min×3次,浸入0.01 mol/L(pH6.0)的柠檬酸盐缓冲液中微波修复抗原,中火6 min×4次,自然冷却至室温后PBS洗涤3 min×3次;3%H2O2室温处理10 min,PBS洗涤3 min×3次;1%TritonX-100(三硝基甲苯)处理标本30 min后PBS漂洗3 min×3次;5%羊血清室温封闭30 min,甩去多液体,勿洗;加入一抗50 μl在4℃冰箱内孵育过夜,37℃复温,PBS洗涤5 min×5次;加入二抗(HRP标记的山羊抗兔IgG抗体),37℃孵育 30 min,PBS洗5 min×5次;加入 SP(链霉亲和素-过氧化物酶),室温孵育30 min。二氨基联苯胺(DAB)避光显色,冲洗,苏木素复染2 min,梯度酒精脱水,二甲苯通透2次,中性树胶封片保存。阴性对照用PBS代替一抗,其余步骤相同。计算阳性对照细胞数,每张脑片选取3个区域,在400倍显微镜下,细胞质或细胞核被染成黄色或棕黄色即为阳性细胞,应用病理图像分析系统测量区域内MDA、SOD、GSH-Px和CAT阳性细胞数并拍照。
1.7 TUNEL染色检测海马神经元凋亡 异氟烷麻醉结束后6 h,每组随机抽取6只小鼠,制作海马冰冻组织切片。室温下3%H2O2处理标本10 min,PBS缓冲液洗2 min×3次;蛋白酶K 37℃孵育30 min,PBS洗涤2 min×3 次;加入50 μl TUNEL 反应混合液(2 μl TdT 酶+48 μl荧光素标记的 dUTP),37℃ 于暗湿盒中孵育1 h,PBS洗2 min×3次,加50 μl转化剂过氧化物酶(POD),37℃湿盒中孵育 30 min,PBS 洗涤 2 min×3 次;50 μl DAB显色,苏木素复染1 min,乙醇脱水,中性树胶封片。在400倍显微镜下随机选取5个视野,观察凋亡细胞,以镜下出现凋亡小体,染色质呈块状凝聚或核裂解及核周新月体样聚集的细胞,为阳性染色细胞。细胞凋亡率(%)=(计数凋亡细胞数/计数细胞总数)×100%。
1.8 统计学方法 应用SPSS19.0软件,组间比较采用χ2检验或重复测量设计的方差分析。
2 结果
2.1 各组小鼠Morris水迷宫检测结果 与正常对照组比较,异氟烷组小鼠逃避潜伏期明显延长(P<0.05),空间探索时间明显缩短〔(27.8±5.2)vs(41.2±8.3)s〕(P<0.05);与异氟烷组比较,异氟烷+海藻糖组小鼠逃避潜伏期明显缩短(P<0.05),空间探索时间明显延长〔(38.4±7.4)s〕(P<0.05)。见图 1。海藻糖组空间探索时间为(44.7±8.8)s。
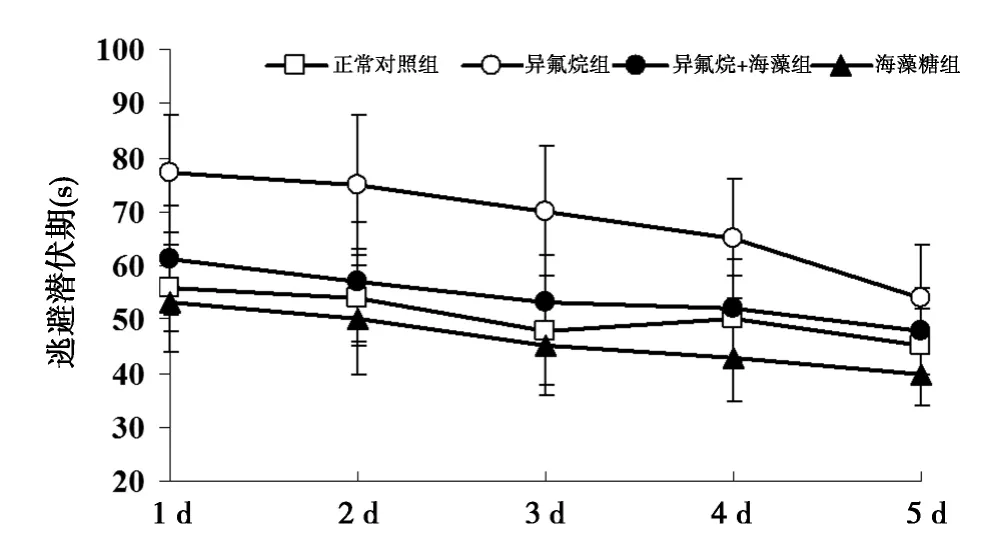
图1 吸入麻醉药异氟烷和(或)海藻糖对转APP基因小鼠逃避潜伏期的影响(Morris水迷宫)
2.2 各组小鼠海马神经元凋亡率的变化 正常对照组和海藻糖组海马神经元凋亡率为5.3% ~0.38%、2.5% ~0.32%;与正常对照组比较,异氟烷组海马神经元凋亡率为28.21% ~0.37%,细胞凋亡率明显增加(P<0.05);异氟烷+海藻糖组海马神经元凋亡率为15.32% ~0.22%,与异氟烷组比较,其细胞凋亡率明显降低(P<0.05)。见图2。

图2 各组小鼠海马神经元凋亡的变化(TUNEL法,×400)
2.3 各组海马组织ROS含量的变化 与正常对照组(710.3±60.4)比较,异氟烷组海马组织ROS水平(920.2±90.3)明显增高(P<0.05),海藻糖组海马组织ROS水平(570.1±40.2)降低(P<0.05);与异氟烷组比较,异氟烷+海藻糖组海马组织ROS水平(759.6±69.8)降低(P<0.05)。
2.4 各组海马组织MDA含量和SOD、GSH-Px、CAT活性的变化 与正常对照组比较,异氟烷组海马组织MDA含量明显增高,SOD、GSH-Px、CAT 活性明显降低(P<0.05),海藻糖组海马组织 MDA 含量降低,SOD、GSH-Px、CAT活性升高(P<0.05);与异氟烷组比较,异氟烷+海藻糖组海马组织MDA含量降低,SOD、GSH-Px、CAT 活性升高(P<0.05)。见表1。
表1 各组小鼠海马MDA含量和SOD、GSH-Px、CAT活性的变化(±s)
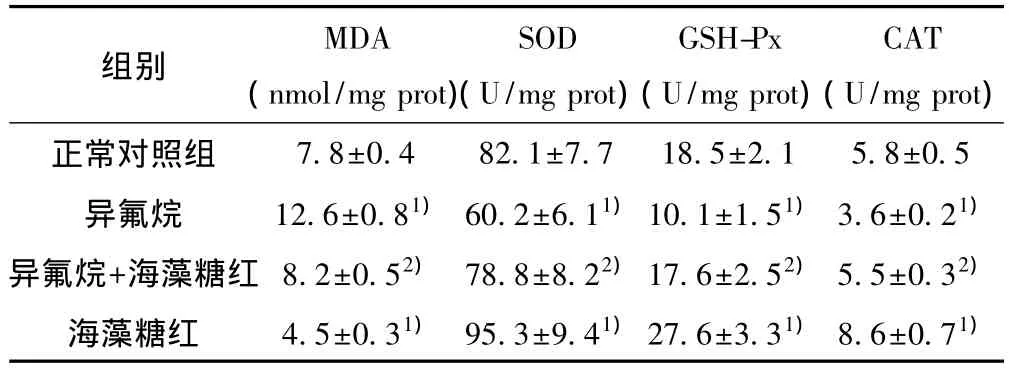
表1 各组小鼠海马MDA含量和SOD、GSH-Px、CAT活性的变化(±s)
与正常对照组比较:1)P<0.05;与异氟烷组比较:2)P<0.05
组别MDA(nmol/mg prot)SOD(U/mg prot)GSH-Px(U/mg prot)CAT(U/mg prot)7.8±0.482.1±7.718.5±2.15.8±0.5异氟烷 12.6±0.81)60.2±6.11)10.1±1.51)3.6±0.21)异氟烷+海藻糖红 8.2±0.52) 78.8±8.22)17.6±2.52)5.5±0.32)海藻糖红 4.5±0.31) 95.3±9.41)27.6±3.31)8.6±0.71)正常对照组
2.5 各组海马SOD、GSH-Px、CAT的免疫组织化学染色结果与正常对照组比较,异氟烷组海马SOD、GSH-Px、CAT表达减少(P<0.05),海藻糖组海马 SOD、GSH-Px、CAT 表达增加(P<0.05);与异氟烷组比较,异氟烷+海藻糖组海马SOD、GSH-Px、CAT表达增加(P<0.05)。见图3~图5。

图3 吸入麻醉药异氟烷和(或)海藻糖对转APP基因小鼠海马SOD活性的影响(免疫组织化学法,×40)
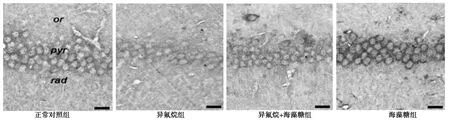
图4 吸入麻醉药异氟烷和(或)海藻糖对转APP基因小鼠海马GSH-Px活性的影响(免疫组织化学法,×40)
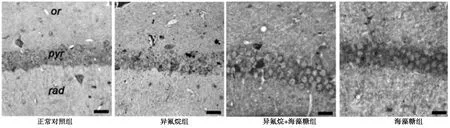
图5 吸入麻醉药异氟烷和(或)海藻糖对转APP基因小鼠海马CAT活性的影响(免疫组织化学法,×40)
3 讨论
氧化应激和自由基损伤与AD发病密切相关〔5〕。研究发现β-淀粉样蛋白(Aβ)的异常聚集、氧化应激的积聚、线粒体的损伤是AD的重要病理因素,它们相互影响,共同促进AD病理进程的进展。线粒体作为细胞能量的主要来源,其在氧化磷酸化的同时产生大量的副产物ROS。蓄积的ROS不仅氧化细胞内的DNA、脂质、蛋白质,还能促进蛋白质聚集(Aβ蛋白聚集)。Aβ在聚集过程可以产生ROS,加重氧化应激反应〔6〕,而Aβ的聚集还能直接损伤线粒体,生成过多的 ROS〔7〕。大量的 Aβ、ROS和Ca2+进入线粒体,能够引起线粒体肿胀和膜电位消失,能量生成减少,ROS生成进一步增加,最后引起线粒体破裂,细胞色素C的释放和凋亡因子的激活,导致神经元凋亡。MDA是氧自由基氧化生物膜中的不饱和脂肪酸而形成的脂质过氧化物的代谢产物,MDA水平能反映出机体氧化应激的程度。SOD、GSH-Px和CAT是体内重要的抗氧化酶类,SOD能清除超氧阴离子自由基,而GSH-Px和CAT能特异性地分解过氧化氢,SOD、GSH-Px和CAT活性高低反映了机体清除氧自由基能力。Morris水迷宫实验是评估啮齿类动物空间学习记忆能力的重要手段之一,对海马结构受损尤其敏感,常用来评价药物作用效果。本研究显示,吸入麻醉药异氟烷不仅能诱导转APP基因小鼠学习记忆能力损害,还能明显加剧海马神经元氧化应激损伤。临床相关浓度的吸入麻醉药异氟烷能够诱导AD小鼠学习记忆损害和神经细胞凋亡,加剧AD神经病理进程。异氟烷能降低细胞存活率,诱导基质金属蛋白酶(Caspase-3)活化,ROS积聚,线粒体功能障碍、减少ATP生成〔8〕。在体外培养的细胞、神经元和正常小鼠脑内研究发现,异氟烷能增加Aβ的生成,促进ROS产生,细胞色素C的释放,降低Bcl-2表达,增加Bax表达,诱导Caspase-3活化和凋亡〔3〕,上述观点支持本研究结果。
海藻糖(C12H22O11)由两个葡萄糖分子以 α,α,1,1-糖苷键构成,是一种化学性质稳定、无毒性的天然非还原性双糖,在自然界中广泛存在于多种植物和非哺乳动物体内。海藻糖是一种天然的细胞保护剂,可以保护细胞对抗多种有害刺激和损伤(如脱水、氧化应激、高温等)〔4〕,还能保存蛋白质药物、人类组织和细胞活性。动物实验研究表明,海藻糖能改善转基因AD鼠的行为学缺陷程度,减少脑内磷酸化Tau和Aβ聚集〔9〕。体内研究显示,给予海藻糖能够抑制亨廷顿病转基因鼠脑内多聚谷酰胺的形成,改善运动功能,并延长寿命〔10〕。Yang等〔11〕报道脑内移植神经干细胞复合海藻糖能够减轻转基因鼠亨廷顿病模型的神经病理过程。本研究结果显示,给予海藻糖治疗能够减轻转APP基因小鼠海马神经元的氧化应激水平,明显减轻异氟烷诱导AD小鼠学习记忆损害和海马神经元氧化应激损伤,提示海藻糖治疗能够拮抗吸入麻醉药异氟烷对AD的细胞毒性。动物实验研究表明,给予抗氧化剂能够阻止转基因AD鼠的空间记忆功能的丧失,保护蛋白质不受氧化应激性损伤,减少脑内Aβ聚集〔12〕。很多研究表明海藻糖能够保护细胞对抗氧化应激损伤〔4〕。细胞内海藻糖能够对抗活性氧自由基的损伤,保护细胞和蛋白质的活性〔13〕。给予海藻糖能够明显增强真菌抵抗 H2O2引起的氧化应激损伤的能力〔14〕。Bleoanca等〔15〕显示海藻糖还能降低由脂质过氧化损伤介导的氧化应激反应,上述观点均支持本研究结果。
1 Lobo FA,Saraiva AP.Playing games with the brain:the possible link between anesthesia and Alzheimer's disease revisited〔J〕.Rev Esp Anestesiol Reanim,2014;61(8):417-21.
2 Turunc-Bayrakdar E,Uyanikgil Y,Kanit L,et al.Nicotinamide treatment reduces the levels of oxidative stress,apoptosis,and PARP-1 activity in Aβ(1-42)-induced rat model of Alzheimer's disease〔J〕.Free Radic Res,2014;48(2):146-58.
3 Zhang Y,Dong Y,Wu X,et al.The mitochondrial pathway of anesthetic isoflurane-induced apoptosis〔J〕.J Biol Chem,2010;285(6):4025-37.
4 Luyckx J,Baudouin C.Trehalose:an intriguing disaccharide with potential for medical application in ophthalmology〔J〕.Clin Ophthalmol,2011;(5):577-81.
5 Borza LR.A review on the cause-effect relationship between oxidative stress and toxic proteins in the pathogenesis of neurodegenerative diseases〔J〕.Rev Med Chir Soc Med Nat Iasi,2014;118(1):19-27.
6 Cai Z,Zhao B,Ratka A.Oxidative stress and β-amyloid protein in Alzheimer's disease〔J〕.Neuromol Med,2011;13(4):223-50.
7 Dowding JM,Song W,Bossy K,et al.Cerium oxide nanoparticles protect against Aβ-induced mitochondrial fragmentation and neuronal cell death〔J〕.Cell Death Differ,2014;21(10):1622-32.
8 Sun Y,Zhang Y,Cheng B,et al.Glucose may attenuate isoflurane-induced caspase-3 activation in H4 human neuroglioma cells〔J〕.Anesth Analg,2014;119(6):1373-80.
9 Rodríguez-Navarro JA,Rodríguez L,Casarejos MJ,et al.Trehalose amelio-rates dopaminergic and tau pathology in parkin deleted/tau overexpressing mice through autophagy activation〔J〕.Neurobiol Dis,2010;39(3):423-38.
10 Tanaka M,Machida Y,Niu S,et al.Trehalose alleviates polyglutaminemediated pathology in a mouse model of Huntington disease〔J〕.Nat Med,2004;10(2):148-54.
11 Yang CR,Yu RK.Intracerebral transplantation of neural stem cells combined with trehalose ingestion alleviates pathology in a mouse model of Huntington's disease〔J〕.J Neurosci Res,2009;87(1):26-33.
12 McManus MJ,Murphy MP,Franklin JL.The mitochondria-targeted antioxidant MitoQ prevents loss of spatial memory retention and early neuropathology in a transgenic mouse model of Alzheimer's disease〔J〕.J Neurosci,2011;31(44):15703-15.
13 Fernandez-Estevez MA,Casarejos MJ,López Sendon J,et al.Trehalose reverses cell malfunction in fibroblasts from normal and Huntington's disease patients caused by proteosome inhibition〔J〕.PLoS One,2014;9(2):e90202.
14 Alvarez-Peral FJ,Zaragoza O,Pedreno Y,et al.Protective role of trehalose during severe oxidative stress caused by hydrogen peroxide and the adaptive oxidative stress response in Candida albicans〔J〕.Microbiology,2002;148(8):2599-606.
15 Bleoanca I,Silva AR,Pimentel C,et al.Relationship between ethanol and oxidative stress in laboratory and brewing yeast strains〔J〕.J Biosci Bioeng,2013;116(6):697-705.

