AM251对糖尿病视网膜病变大鼠ICAM-1及VEGF表达的影响
李甜甜 吕 霄 李 伟 (徐州医学院研究生学院,江苏 徐州 22002)
糖尿病视网膜病变(DR)是一种慢性低度炎症病变,尤其是白细胞黏附到视网膜微血管可能是导致DR复杂病理的最终的共同途径。细胞间黏附分子(ICAM)-1、视网膜血管内皮生长因子(VEGF)作为重要的因子在DR的发生发展中起重要作用〔1〕。大麻素受体(CB)1主要表达于中枢神经系统,在外周组织如肝脏、胰腺、视网膜、脂肪细胞、肌肉细胞等也有表达,对外周组织代谢起着重要的作用〔2〕。AM251〔N-(piperidin-1-yl)-5-(4-iodophenyl)-1-(2,3-dichlorophenyl)-4-methyl-1H-pyrazole-3-carboxamide〕是一种高效的、特异的CB1拮抗药类似物,在结构上与CB1拮抗剂利莫那班非常接近,但与CB1的亲和性更强,具有明显的中枢性阵痛、抑制食欲等作用。研究发现〔3〕,AM251可改善糖尿病模型小鼠的视网膜病变、胰岛素抵抗、葡萄糖耐量异常和血脂紊乱,但其机制不明确。本实验研究AM251对糖尿病大鼠视网膜ICAM-1和VEGF表达的影响。
1 材料与方法
1.1 实验动物 健康、雄性清洁级Sprague-Dawley(SD)大鼠40只〔8周龄,体质量180~220 g,购自徐州医学院实验动物中心,使用许可证号:SCXK(苏)2005-0005〕。实验期间,所有大鼠均单笼饲养于屏障系统,保持室温21℃ ~27℃,湿度40% ~70%,氨浓度<14 mg/m3。12 h光照交替,大鼠自由饮水进食,保持垫料干燥,不给予胰岛素或其他降糖药物。
1.2 试剂 链脲佐菌素(STZ)购自美国Sigma公司(置于-20℃冰箱保存)。AM251购自美国Cayman公司(粉末状固体,分子质量555.2,纯度≥98%,为实验用药),ICAM-1和VEGF酶联免疫吸附试验(ELISA)试剂盒购自武汉博士德公司。血糖仪及血糖试纸购自美国强生公司。
1.3 方法
1.3.1 模型制备与分组 SD大鼠40只适应性喂养1 w后开始实验。随机分为两组,正常对照组10只,糖尿病模型组30只。糖尿病模型组大鼠禁食12 h后,通过腹腔一次性注射STZ 55 mg/kg建立糖尿病大鼠模型,正常组仅注射相同剂量的无菌枸橼酸缓冲液作为对照。3 d后通过断尾取血测血糖>16.7 mmol/L即认为糖尿病大鼠造模成功。所有大鼠均在屏障系统下饲养,自由饮水,觅食。期间每周测血糖。3个月后观察糖尿病大鼠眼底变化,有明显视网膜出血及渗出者视为DR造模成功。成模大鼠共18只,随机分为DR组9只,AM251干预组(DR-C组)9只。正常组随机分为正常生理盐水对照组(NC组)5只,正常AM251干预组(NC-C组)5只。NC-C组及DR-C组每天予AM251腹腔注射0.5 mg/kg,干预12 w。NC组及DR组同期给予等量生理盐水腹腔注射12 w。
1.3.2 血清生化指标检测 AM251干预12 w后,在10%水合氯醛麻醉下,心脏取血,采用7150型生化分析仪检测大鼠血清空腹血糖(FBG)、甘油三酯(TG)、总胆固醇(TC)、低密度脂蛋白(LDL)、高密度脂蛋白(HDL)。
1.3.3 免疫组化检测大鼠视网膜VEGF 采用SP三步法,连续石蜡切片厚度4 μm,石蜡切片脱蜡至水。微波炉中(大火2 min,小火10 min)热抗原修复;3%过氧化氢37℃孵育5~10 min,以消除内源性过氧化物酶活性;磷酸盐缓冲液(PBS)冲洗2 min×3次,按照免疫组化染色试剂盒的说明进行操作。
1.3.4 ELISA检测大鼠视网膜VEGF和ICAM-1 显微镜下,沿角膜巩膜缘切开眼球,去除晶体及玻璃体,剪碎视网膜,加入150 μl预冷的组织裂解液。视网膜在冰浴中超声粉碎2个循环,每个循环5 s,4℃ 14000 r/min 离心 15 min,取上清液2 μl使用二喹啉甲酸(BCA)进行蛋白定量,另取100 μl上清液按试剂盒说明书检测视网膜组织中ICAM-1与VEGF水平。
1.3.5 Western印迹检测视网膜ICAM-1、VEGF表达 新鲜的视网膜超声粉碎离心后,测量蛋白质的浓度。将等量的蛋白质50 μg置十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)进行电泳,再转移至硝酸纤维素膜。应用抗体ICAM-11∶200与VEGF 1∶200稀释,与含有蛋白质的硝酸纤维素膜反应,蛋白质的条带通过加强的光化学发光剂反应后,扫描、评价和分析,应用抗体Actin(Sigma,USA)证实,等量的蛋白质加到SDS-PAGE上。
1.3.6 ELISA测血清sICAM-1水平 大鼠心脏取血,室温2 h,待血液凝固血块收缩后,4000 r/min离心10 min。取上清于干净的Eppendorf管,应用酶联免疫吸附法(ELISA)检测血清中sICAM-1水平,严格按照使用说明操作。
1.4 统计学分析 组间比较行t检验。
2 结果
2.1 大鼠成模情况及死亡率 30只模型组大鼠腹腔注射STZ后,糖尿病成模30只,糖尿病成模率100%,3个月后查眼底,有明显出血及渗出者18只,DR成模率60%,随机分为DR组9只,DR-C组9只。正常组随机分为NC组5只,正常DR-C组5只。实验过程中DR组和DR-C组分别死亡2只大鼠,NC组和NC-C组无大鼠死亡。
2.2 一般情况 正常对照组大鼠每日饮水量少,尿量少,精神良好,反应灵敏,动作敏捷,毛发光泽,体质量随周龄增大而稳步增长。DM造模成功的大鼠均出现多尿、多饮、多食、体重减轻,毛发枯黄无光泽,精神萎靡,生长发育迟缓,符合糖尿病的主要特征。给予AM251后,DR-C组大鼠精神情况、活动、毛色、饮食等情况较前有明显改善。
2.3 各组FBG、体质量、SBP及血脂水平比较 NC组与NC-C组相比,FBG无统计学差异(P>0.05);DR组和DR-C组相比,FBG无统计学差异(P>0.05);与NC组和NC-C组相比,DR和DR-C组大鼠FBG升高,体质量降低(P<0.01)。四组大鼠间SBP差异无统计学意义(P>0.05)。见表1。干预前与干预12 w末,四组大鼠间 TC、TG、HDL-C、LDL-C均无明显差异(P>0.05)。见表2。
表1 各组大鼠FBG、SBP、体质量的变化(±s)
与NC组比较:1)P<0.01;与DR组比较:2)P<0.01
组别 n FBG(mmol/L)SBP(mmHg) 体质量(g)NC 组 55.74±0.682) 103±11385.20±30.922)NC-C 组 55.88±1.402) 101±13385.20±17.772)DR 组 923.46±4.931) 110±12228.00±15.271)DR-C 组 924.33±4.311) 118±14235.44±15.471)
表2 各组大鼠血脂水平比较(±s,mmol/L)
50.62±0.101.61±0.180.77±0.140.44±0.03 NC-C 组 50.63±0.091.63±0.310.76±0.160.47±0.04 DR 组 90.79±0.111.80±0.251.02±0.440.51±0.09 DR-C组TG TC LDL-C HDL-C NC组组别 n 90.81±0.121.82±0.230.94±0.190.48±0.07
2.4 视网膜形态病理变化 NC组及NC-C组视网膜细胞排列整齐,各层结构清晰完整。与NC组相比,DR组视网膜厚度变薄,视神经节细胞的数目明显减少;经AM251干预后,DR-C组与DR组相比,上述表现均明显改善,但与NC组和NC-C组相比,上述指标仍增大。
2.5 免疫组化检测大鼠视网膜VEGF表达 NC组(136±8)与NC-C组(134±9)大鼠视网膜组织有少量VEGF表达,DR组大鼠视网膜组织VEGF表达明显增加(205±10,P<0.01);DR-C组(186±14)较DR组视网膜组织VEGF表达减弱(P<0.01),但较NC组和NC-C组表达仍高(P<0.01)。见图1。
2.6 ELISA检测大鼠视网膜VEGF、ICAM-1的表达 NC组大鼠与NC-C组大鼠ICAM-1与VEGF少量表达;与NC组相比,DR组大鼠ICAM-1与VEGF表达明显增强(P<0.01);DR-C组较DR组ICAM-1与VEGF表达减弱(P<0.01),但较NC组及NC-C组表达仍高(P<0.01)。见表3。
表3 ELISA检测各组大鼠视网膜组织VEGF和ICAM的表达变化(±s)

表3 ELISA检测各组大鼠视网膜组织VEGF和ICAM的表达变化(±s)
与NC组比较:1)P<0.01;与DR组比较:2)P<0.01
组别 n VEGF(μg/g) ICAM-1(μg/g)0.85±0.123.72±0.51 NC-C 组 50.82±0.173.70±0.48 DR 组 92.44±0.221) 7.98±0.321)DR-C 组 91.42±0.191)2) 4.85±0.221)2)NC组5
2.7 ELISA检测大鼠血清sICAM-1的表达 NC组大鼠与NC-C组大鼠血清中 sICAM-1少量表达,与 NC组〔(225.72±70.7)pg/ml〕及 NC-C 组〔(220.55±56.48)pg/ml〕相比,DR 组大鼠 sICAM-1表达明显增强〔(1158.74±243.25)pg/ml,(P<0.01)〕;DR-C 组〔(447.26±85.62)pg/ml〕较DR 组sICAM-1 表达减弱(P<0.01),但较 NC、NC-C 组表达仍高(P<0.01)。
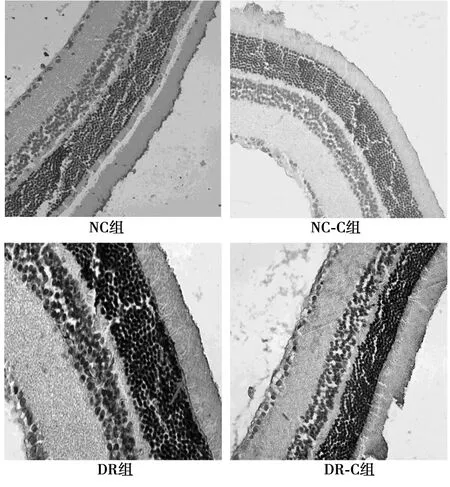
图1 各组大鼠视网膜VEGF免疫组化染色结果(×400)
2.8 免疫印迹检测VEGF、ICAM-1蛋白表达的变化 与NC组相比,NC-C组VEGF、ICAM-1蛋白表达无明显差异(P>0.05);DR组与DR-C组VEGF、ICAM-1蛋白表达明显增加(P<0.01);与DR组相比,DR-C组 VEGF、ICAM-1蛋白表达减少(P<0.01)。见图2。
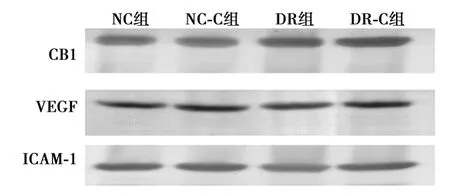
图2 各组大鼠视网膜CB1、VEGF、ICAM-1的表达情况(免疫印迹)
3 讨论
DR的病理特征为视网膜新生血管形成和血-视网膜屏障(BRB)破坏〔4〕。近年来许多研究认为微循环损害是多因素综合作用的结果。早期糖尿病视网膜中白细胞黏附增加,并与DR微血管损伤在时间和空间上一致。同时,ICAM-1及其基因表达上调,VEGF可引起DR中的炎症改变〔5〕。增加视网膜内VEGF可明显增加白细胞黏附和血-视网膜屏障的破坏。
白细胞的黏附与聚集在DR发病机制中起着启动和介质作用。白细胞与内皮细胞的黏附部分是由黏附分子(AMs)调节的。ICAM-1正常情况下呈低水平表达,内毒素、肿瘤坏死因子α等可促进其表达,ICAM-1在活性内皮细胞上的表达是循环白细胞聚集、浸润、停滞,是引起局部组织损伤和炎症反应的关键。白细胞停滞引起微血管无灌注,使视网膜缺血,是促炎症的重要因素,加重DR。
VEGF参与淋巴细胞、单核细胞、嗜碱和嗜酸性粒细胞穿出血管壁到达炎症部位的过程。VEGF是目前所知最强的内皮细胞选择性促有丝分裂因子和血管生成因子〔6〕,与DR新生血管的形成紧密相关。能特异性地刺激血管内皮细胞增殖,参与新生血管的形成过程,VEGF一方面促进微血管内皮细胞增生;另一方面又使细胞通透性增强,大分子物质如纤维蛋白原等进入细胞外基质中。形成纤维蛋白凝胶,允许和支持新生血管和基质细胞的内向生长,引起视网膜新生血管形成和纤维增生,最终导致DR。其次,VEGF上调视网膜局部ICAM-1的基因表达增加视网膜血管ICAM-1的mRNA和蛋白质水平,从而造成视网膜白细胞的淤滞和BRB破坏。
本研究结果提示ICAM-1和VEGF可能参与DR的发病,AM251降低了ICAM-1和VEGF的表达,说明AM251可能是通过减少黏附分子表达,对抗炎症反应,从而发挥延缓DR保护视网膜的作用。
1 Khalfaoui T,Lizard G,Beltaief O,et al.Immunohistochemical analysis of cellular adhesion molecules(ICAM-1,VCAM-1)and VEGF in fibrovascular membranes of patients with proliferative diabetic retinopathy:preliminary study〔J〕.Pathol Biol,2009;57(7):513-7.
2 Katsuyama S,Mizoguchi H,Komatsu T,et al.The cannabinoid 1 receptor antagonist AM251 produces nocifensive behavior via activation of ERK signaling pathway〔J〕.Neuropharmacology,2010;59(6):534-41.
3 Baur R,Gertsch J,Sigel E.The cannabinoid CB1 receptor antagonists rimonabant(SR141716)and AM251 directly potentiate GABA(A)receptors〔J〕.Br J Pharmacol,2012;165(8):2479-84.
4 Barutta F,Piscitelli F,Pinach S,et al.Protective role of cannabinoid receptor type 2 in a mouse model of diabetic nephropathy〔J〕.Diabetes,2011;60(9):2368-96.
5 Zhu Y,Zhang XL,Zhu BF,et al.Effect of antioxidant N-acetylcysteine on diabetic retinopathy and expression of VEGF and ICAM-1 from retinal blood vessels of diabetic rats〔J〕.Mol Biol Rep,2012;39(4):3727-35.
6 Watanabe D,Suzuma K,Suzuma I.Vitreous levels of angiopoietin 2 and vascular endothelial growth factor in patients with proliferative diabetic retinopathy〔J〕.Am J Ophthalmol,2005;139(3):476-81.

