姜黄素对直肠癌CD133+肿瘤干细胞样细胞群放疗敏感性的影响
舒小镭 何笑冬 李 倩 王 颖 李少林 (重庆医科大学,重庆 4033)
姜黄素具有降血脂、抗肿瘤、抗炎、利胆、抗氧化等作用。美国VITY维他命杂志报道,姜黄素的主要药理作用有抗氧化、抗炎、抗凝、降脂、抗动脉粥样硬化、抗衰老消除自由基及抑制肿瘤生长等〔1,2〕。目前直肠癌手术前放疗已经成为癌症治疗的重要组成部分,但是经过研究肿瘤细胞对放疗敏感性不高。本文旨在研究姜黄素对直肠癌CD133+肿瘤干细胞样细胞群放疗敏感性的影响。
1 资料与方法
1.1 试剂与仪器 直肠癌CD133肿瘤干细胞免疫磁珠分选器、阳性分离柱和CD133-PE荧光染色抗体均购自北京泰泽瑞达科技有限公司。二甲基亚砜(DMSO)购自上海强智生物科技有限公司、姜黄素购自上海瑞谷科技有限公司,荧光染料碘化丙啶(PI)购自北京华越洋生物科技有限公司。膜联蛋白V-异硫氮基荧光素(AnnexinV-FITC)试剂盒购自广东省瑞博生物有限公司、噻唑蓝(MTT)试剂盒购自北京天恩泽生物科技有限公司。guava easyCyte 8HT个人型高性能流式细胞仪购自美国默克密理博公司。应用姜黄素溶解于DMSO中,配置成1 mmol/L溶液备用。
1.2 细胞系与实验动物 人直肠癌细胞T84(取自72岁的男性结直肠癌患者的肺部转移灶)购自上海信然实业有限公司
1.3 研究方法
1.3.1 分选CD133+肿瘤干细胞 挑选对数期生长较好的T84细胞,经过胰酶消化、离心(1000 r/min,10 min),直接倒去或者吸出上清液,多元缓冲液交换剂(PBE)液混悬细胞,每108个细胞加入 270 μl PB、150 μl Fc 受体阻断剂及80 μl CD133 抗体磁珠,于孵育箱中孵育30 min;接着3 ml PBE溶液洗细胞1次,再次离心,倒上清,加PBE 500 μl充分混悬细胞,可以轻轻摇晃。将CD133阳性分离柱放于磁场,将细胞悬液慢慢加入分选株,等待自然流尽,重复2次,之后1 ml PBE液到分选柱中,自然流尽,30 min内应用流式细胞仪验证细胞纯度。
1.3.2 细胞增殖检测 将分选出的CD133+肿瘤干细胞调整细胞悬液浓度,每孔加入100 μl,铺板使待测细胞调密度至1000~10000孔,(边缘孔用无菌PBS填充),分为姜黄素组、姜黄素联合放疗组、放疗组,姜黄素均为0.5 μmol/L,放疗组加入等量的生理盐水;5%CO2,37℃孵育,至细胞单层铺满孔底(96孔平底板),直到细胞贴壁,每孔100 μl,设5个复孔;5%CO2,37℃孵育16~48 h,倒置显微镜下观察;每孔加入 20 μl MTT溶液(5 mg/ml,即0.5%MTT),培养4 h。若姜黄素与MTT能够反应,离心后弃培养液,用磷酸盐缓冲液(PBS)冲2~3遍后,再加入含MTT的培养液;终止培养,吸去孔中培养液;每孔加入150 μl DMSO,低速手摇振荡10 min,使结晶物质充分溶解。在酶标仪OD 490 nm处测量各孔的吸光度值;同时设置调零孔(培养基、MTT、DMSO),还要设置相应对照孔(细胞、培养液、MTT、DMSO)。实验重复3次,提高准确率。
1.3.3 AnnexinV-FITC细胞凋亡检测 将分选出的CD133+肿瘤干细胞,铺于6孔板上,5×105个/孔,把细胞培养液吸出,PBS洗涤贴壁细胞1次,加入一定量的胰酶消化液(可含有EDTA)消化细胞。室温孵育至轻轻吹打,吸除胰酶细胞消化液。需避免胰酶的过度消化,加入步骤2A中收集的培养液、混匀,转移至离心管内,1000 r/min离心5 min,吸去上清液,收集细胞,PBS轻轻重悬细胞并且细胞计数。注意:加入2A中的细胞培养液其中血清可以有效抑制或中和残留的胰酶(消化并降解后续加入的Annexin V-FITC导致染色失败);取5~10万重悬细胞,1000 r/min 离心 5 min,弃去上清,加 195 μl Annexin VFITC结合液轻轻晃动;加入5 μl Annexin V-FITC,室温(20℃ ~25℃)避光孵育10 min;1000 r/min离心5 min,弃上清,加入190 μl Annexin V-FITC 重悬细胞;加入 10 μl PI,混匀,避光放置,流式细胞仪检测,Annexin V-FITC为绿色光,PI为红色光。用于荧光显微镜下检测,1000 r/min离心5 min,收集细胞,用80 μl Annexin V-FITC重悬细胞,涂片观察。
1.4 研究指标 MTT法测定三组生长抑制情况;Annexin VFITC/PI双染色检测细胞凋亡率;
1.5 统计学方法 应用SPSS13.0软件进行分析,计量资料以±s表示,两组之间比较采用t检验,对于符合条件的多个均值之间的比较应用方差分析,有意义的行两两比较,采用Tukey-HSD;计数资料用百分比表示,采用χ2检验。
2 结果
2.1 三组肿瘤细胞抑制情况 姜黄素组随着时间变化肿瘤细胞抑制率变化不大(P>0.05);放疗组和姜黄素联合放疗组24、48、72 h细胞生长抑制率逐渐升高(P<0.05);同期三组细胞生长抑制率均有统计学意义(P<0.05),两两比较24 h细胞生长抑制率,姜黄素组与姜黄素联合放疗组和放疗组之间有统计学意义(P<0.05),姜黄素联合放疗组与放疗组之间差异差异无统计学意义(P>0.05);48 h抑制率两两之间差异均有统计学意义(P<0.05);72 h抑制率两两之间差异均有统计学意义(P<0.05)。见表1。
表1 MTT法测定三组抑制率比较(%,±s)
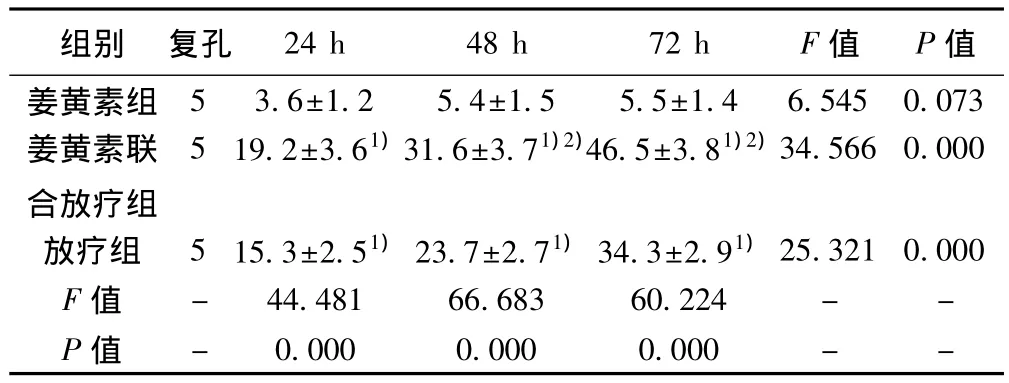
表1 MTT法测定三组抑制率比较(%,±s)
与姜黄素组比较:1)P<0.05;与放疗组比较:2)P<0.05;下表同
组别 复孔 24 h 48 h 72 h F值 P值53.6±1.25.4±1.55.5±1.46.5450.073姜黄素联合放疗组姜黄素组519.2±3.61)31.6±3.71)2)46.5±3.81)2)34.5660.000放疗组 515.3±2.51)23.7±2.71)34.3±2.91)25.3210.000 F值 - 44.48166.68360.224 - -P值 -0.0000.0000.000 - -
2.2 Annexin V-FITC/PI双染色检测细胞凋亡率 姜黄素组48 h与72 h之间细胞凋亡率差异无统计学意义(P>0.05),姜黄素联合放疗组和放疗组差异具有统计学意义(P<0.05)。同期内不同组细胞凋亡率之间的差异具有统计学意义(P<0.05),两两比较细胞凋亡率之间差异具有统计学意义(P<0.05),Annexin V-FITC/PI双染色检测细胞凋亡率右上和右下计为凋亡率。见图1,表2。
表2 Annexin V-FITC/PI双染色检测细胞凋亡率(%,±s)

表2 Annexin V-FITC/PI双染色检测细胞凋亡率(%,±s)
组别 复孔 48 h 72 h T值 P值55.4±0.45.6±0.50.6430.528姜黄素联合放疗组 521.3±1.71)2)29.4±1.81)2)7.6170.000放疗组 512.5±1.31)18.3±1.41) 3.8650.012 F值 - 25.43332.234 - -P值姜黄素组- 0.0000.000 - -
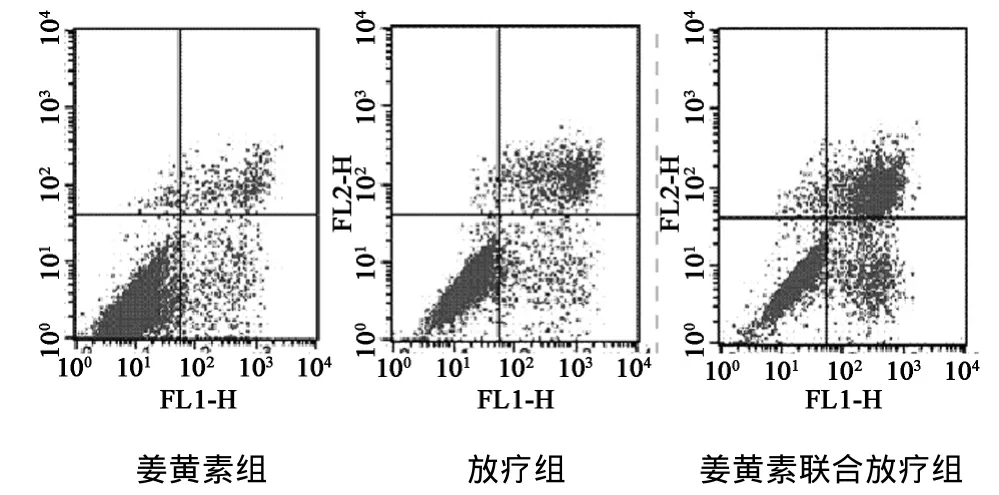
图1 Annexin V-FITC/PI双染色检测细胞凋亡率
3 讨论
姜黄素是植物多酚,是姜发挥药用最重要成分,近年的研究不仅证明姜黄传统中医作用,而且还发现一些新的药理作用〔3〕,如抗炎、抗氧化、清除氧自由基、抗人类免疫缺陷病毒、保护肝脏和肾脏、抗纤维化以及防癌抗癌等作用,可能与机体某些通路蛋白激活有关,而且无明显的毒副作用〔4〕,有研究姜黄素对肝癌细胞(QGY)细胞增殖和细胞周期的调控及细胞凋亡的影响,采用MTT法测定姜黄素在不同浓度、不同时间对QGY的抑制作用,流式分析细胞周期,透射镜观察细胞结构变化〔5〕。结果姜黄素对QGY细胞有一定抑制作用,抑瘤率与药物呈现剂量反应关系,72 h的IC 50为49.50 μmol/L,流式细胞仪分析证实姜黄素能聚积细胞在S期,电镜发现姜黄素可使细胞坏死〔6〕,诱导细胞凋亡证明姜黄素可干扰QGY细胞的周期分布,具有细胞毒作用、抗增殖、诱导细胞凋亡的作用〔7〕。众多的研究暗示姜黄素可能对肿瘤细胞的生长具有一定抑制作用,也有研究发现姜黄素可以增加放疗的敏感性〔8,9〕。本文说明姜黄素可能并不能单纯的起作用,必须和别的措施或者药物协同起作用。
综上所述,姜黄素可以增加直肠癌CD133+肿瘤干细胞样细胞群放疗敏感性,抑制肿瘤细胞生长促进细胞凋亡,临床上对于直肠癌治疗时可以使用,但是也要注意姜黄素使用的适应证以及预防可能出现的不良反应。
1 张 鹏,陈方敏,石家齐,等.增韧基团一姜黄素酯协同二甲双胍对前列腺癌PC-3细胞凋亡的影响〔J〕.中华实验外科杂志,2013;30(6):1181-3.
2 陈方敏,任德帅,石家齐,等.增韧基因-姜黄素酯对前列腺癌细胞体外靶向影响〔J〕.中华实验外科杂志,2012;29(3):1066-8.
3 Valent P,Bonnet D,DeMaria R,et al.Cancer stem cell definitions and terminology:the devil is in the details〔J〕.Nat Rev Cancer,2012;12(11):767-75.
4 何利兵,王险峰,王红胜,等.姜黄素衍生物体外抑制结肠癌细胞增殖侵袭作用〔J〕.中国癌症杂志,2013;23(1):17-25.
5 吕文平,李世拥,安 萍,等.CD/5-FC对人直肠癌细胞辐射增敏作用的研究〔J〕.中华普通外科杂志,2002;17(7):440-2.
6 Takebe N,Warren RQ,Ivy SP.Breast cancer growth and metastasis:interplay between Cancer stem cells,embryonic signaling pathways and epithelial-to-mesenchymal transition〔J〕.Breast Cancer Res,2011;13(3):211-20.
7 刘双林,王志华,胡志全.姜黄素对雄激素非依赖性前列腺癌抑制效应及其机制〔J〕.中华实验外科杂志,2010;27(11):1711-3.
8 Yang CW,Chang CL,Lee HC,et al.Curcumin induces the apoptosis of humanm monocytic leukemia THP-l cells via the activation of JNK/ERK pathways〔J〕.BMC Complement Chem Med,2012;12:22.
9 Shi HS,Gao X,Li D,et al.A systemic administration of liposomal eurcumin inhibits radiation pneumonitis and sensitizes lung carcinoma to radiation〔J〕.Int J Nanomedic,2012;7:2601-11.

