五味子多糖对人结肠癌HT-29细胞体外增殖及侵袭能力的抑制作用
黄晓东,路 倩,沈 楠,王艳春
(1.吉林医药学院药理学教研室,吉林 吉林 132013;2.吉林医药学院机能实验中心,吉林 吉林 132013)
五味子多糖对人结肠癌HT-29细胞体外增殖及侵袭能力的抑制作用
黄晓东1,路倩1,沈楠2,王艳春1
(1.吉林医药学院药理学教研室,吉林 吉林 132013;2.吉林医药学院机能实验中心,吉林 吉林 132013)
目的:探讨五味子多糖(ASPS)对人结肠癌HT-29细胞增殖和侵袭活性的影响,阐明ASPS的抗肿瘤作用。方法:40只 Wistar大鼠随机分为对照组(给予生理盐水)和100、200、400 mg·kg-1ASPS组,每组10只,取各组大鼠血清,HT-29细胞体外培养,以各组大鼠血清进行预处理,采用MTT法和Transwell小室检测各组HT-29细胞的增殖抑制率和侵袭活性抑制率;Western blotting法检测各组细胞上清液中bcl-2、bax和Caspase-3蛋白表达水平。结果:与对照组和100 mg·kg-1ASPS组比较,200和400 mg·kg-1ASPS组HT-29细胞增殖抑制率和侵袭活性抑制率均升高(P<0.05,P<0.01)。400 mg·kg-1ASPS组HT-29细胞上清液中bcl-2蛋白表达水平低于其他组(P<0.05,P<0.01),bax和Caspase-3蛋白的表达水平高于对照组(P<0.05,P<0.01)。结论:ASPS能显著抑制细胞的体外增殖和侵袭能力,其机制可能与下调HT-29细胞的bcl-2基因表达,上调bax和Caspase-3基因表达,激活细胞凋亡通道有关联。
结直肠肿瘤;五味子多糖;侵袭活性;细胞凋亡
直肠癌患者死亡的主要原因是肿瘤的复发和转移,控制恶性肿瘤侵袭和转移非常重要。五味子多糖(AlkalineS.chinensispolysaccharides,ASPS)为中药北五味子中的主要成分,含有多种果糖、多聚糖、氨基酸和10余种微量元素[1-2]。大量研究[3-5]表明:ASPS可以抗肿瘤,诱导肿瘤细胞凋亡。但是其抑制肿瘤转移及其机制均未见报道。本研究采用ASPS含药血清对人结肠癌HT-29细胞进行预处理,观察ASPS对HT-29细胞增殖和侵袭活性的抑制作用,并对其作用机制进行初步探讨。
1 材料与方法
1.1细胞及主要试剂人结肠癌细胞株HT-29由吉林大学基础医学院提供;40只Wistar大鼠,SPF级,雌雄各半,体质量(180±20)g,购于吉林大学实验动物中心(动物合格证号:SCXK吉-2012-0104)。ASPS由吉林大学药学院药物分析教研室自提,纯度为91.4%;bax鼠抗人单克隆抗体、bcl-2鼠抗人单克隆抗体、FITC-羊抗鼠单克隆抗体、兔抗人β-肌动蛋白多克隆抗体和鼠抗人Caspase-3单克隆抗体购于北京中杉公司;Transwell小室购于美国Corning公司;蛋白Marker和PVDF膜购于凯基生物科技发展有限公司。
1.2 ASPS血清的制备40只Wistar大鼠随机分为对照组和100、200、400 mg·kg-1ASPS组,每组10只。各ASPS组大鼠给予灌胃ASPS,每天2次,对照组大鼠灌胃生理盐水,连续7 d。麻醉大鼠后,腹主动脉取血,离心分离血清,56℃水浴中,灭活30 min后,用0.22 μm微孔滤膜过滤除菌,-20℃保存。
1.3MTT法检测HT-29细胞增殖抑制率用RPMI-1640培养基配制HT-29细胞悬液接种于96孔板中,每孔加200 μL,培养24 h;取出孔板弃去上清,加入10% ASPS血清200 μL,培养72 h;再弃上清,加入200 μL MTT(0.5 g·L-1),作用4 h后,吸去上清,加入200 μL DMSO,摇床混匀10 min,于酶标仪570 nm波长处测定吸光度(A)值,重复3次。细胞增殖抑制率=(对照组A值-实验组A值)/对照组A值×100%。
1.4Transwell小室法检测HT-29细胞的侵袭活性抑制率取HT-29细胞1×105mL-1,接种于Transwell板的上室,每孔160 μL,再加入20% ASPS血清40 μL,将800 μL RPMI-1640培养基加入下室,培养24 h。倒置上室,甲醇固定20 min,PBS漂洗×2,染色5 min,蒸馏水漂洗,1%盐酸酒精浸泡10 s,再用蒸馏水漂洗,淡氨水浸泡5 min,漂洗,依次放入体积分数为90% 和100%的酒精脱水,剪下滤膜,正置载玻片上,计数。观察中央和上下左右各5个视野的侵入滤膜细胞数,取均值。侵袭活性抑制率=(对照组侵入滤膜细胞数-ASPS组侵入滤膜细胞数)/对照组侵入滤膜细胞数×100%。
1.5Western blotting法测定HT-29细胞上清液中bcl-2、bax和Caspase-3蛋白表达水平取HT-29细胞1×105个,培养24 h,加入不同浓度ASPS组血清,处理48 h后,收集细胞。bradford法提取蛋白,将20 μg蛋白加入缓冲液进行聚丙烯酰胺凝胶电泳分离,转至PVDF膜,5%脱脂奶粉室温封闭1 h,室温下PBS-T洗膜3次,分别加入1∶200稀释一抗4℃孵育过夜,再分别加入1∶1 000稀释的相应二抗,室温孵育1 h,室温PBS-T洗3次,DAB显色。Imagel凝胶成像系统采集图像,目的条带净灰度值与内参照β-actin测定值的比值即蛋白表达水平。实验重复3次。

2 结 果
2.1各组HT-29细胞增殖抑制率和侵袭活性抑制率MTT检测:不同浓度ASPS含药血清培育72 h后,HT-29细胞株均表现为抑制,200和400 mg·kg-1ASPS组HT-29细胞增殖抑制率均高于对照组和100 mg·kg-1ASPS组(P<0.05或P<0.01)。200和400 mg·kg-1ASPS组HT-29细胞侵袭活性抑制率均高于对照组和100 mg·kg-1ASPS组(P<0.05)。见表1。
表1各组HT-29细胞增殖抑制率和侵袭活性抑制率
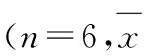

GroupInhibitoryrateofproliferationInhibitoryrateofinvasionabilityControl1.02±0.601.71±1.14ASPS(mg·kg-1) 1004.02±2.702.88±1.72 20010.52±5.20*△44.37±18.91*△ 40013.75±3.40**△48.47±26.38*△
*P<0.05,**P<0.01vscontrol group;△P<0.05vs100 mg·kg-1ASPS group.
2.2HT-29细胞上清液中bcl-2、bax和 Caspase-3蛋白的表达免疫印迹法检测:与对照组比较,400 mg·kg-1ASPS组HT-29细胞上清液中bcl-2蛋白表达水平降低(P<0.01),200和400 mg·kg-1ASPS组HT-29细胞上清液中bax蛋白表达水平升高(P<0.05)。Caspase-3条带随ASPS浓度的增大而明显变深,与对照组比较,200和400 mg·kg-1ASPS 组HT-29细胞上清液中Caspase-3蛋白表达水平明显升高(P<0.05)。见图1和表2。
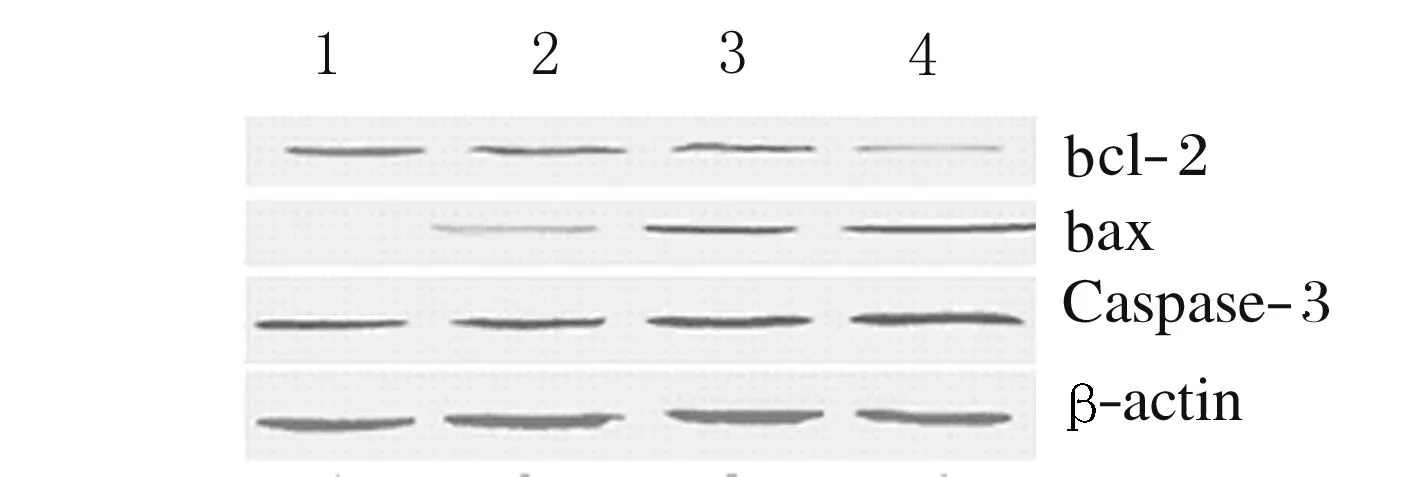
Lane 1: Control group;Lane 2-4: 100,200,and 400 mg·kg-1ASPS groups.
图1各组HT-29细胞上清液中bcl-2、bax和 Caspase-3蛋白表达电泳图
Fig.1Electrophoregram of expressions of bax,bcl-2,and Caspase-3 proteins in supernatant of HT-29 cells in various groups
3 讨 论
结直肠癌是消化系统常见的恶性肿瘤,行切除术后的患者有一半以上会出现复发和远端转移,有50%~60%结直肠癌患者表现为进行性肝转移[6]。除手术治疗外,化疗所用的常用药物在杀灭结肠癌细胞同时,也会损害正常细胞,所以对患者伤害较大。ASPS在提高机体的非特异性免疫功能的同时,还可以升高外周血白细胞数,增强机体非特异性免疫功能和体液免疫功能,提高机体的抗癌能力[7]。本实验观察了含ASPS血清对HT29细胞的抑制作用,结果显示:ASPS血清可以明显抑制人结肠癌HT-29细胞株的增殖,200、400 mg·kg-1ASPS组细胞增殖抑制率分别为10.52%±5.2%、13.75%±3.4%,说明ASPS可以抑制结肠癌HT-29细胞的增殖。
表2各组HT-29细胞上清液中bcl-2、bax和Caspase-3蛋白表达水平

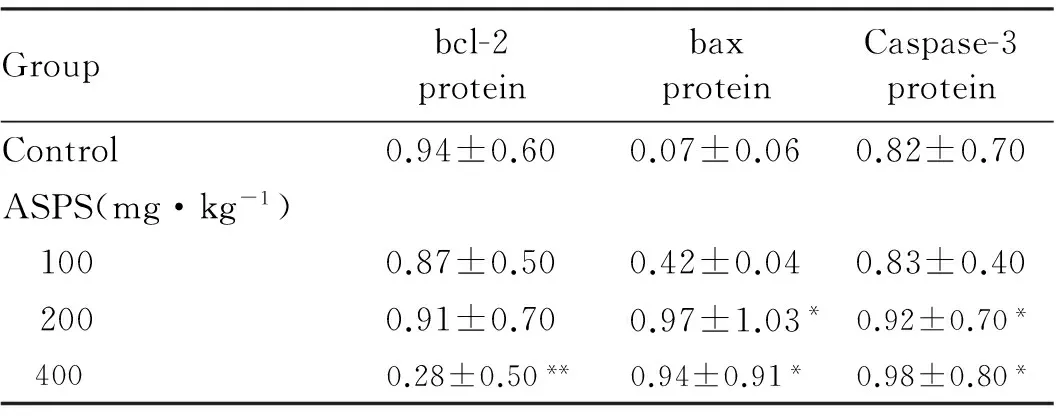
Groupbcl-2proteinbaxproteinCaspase-3proteinControl0.94±0.600.07±0.060.82±0.70ASPS(mg·kg-1) 1000.87±0.500.42±0.040.83±0.40 2000.91±0.700.97±1.03*0.92±0.70* 4000.28±0.50**0.94±0.91*0.98±0.80*
*P<0.05,**P<0.01vscontrol group.
恶性肿瘤的最主要标志是侵袭和转移[8]。脱离原发灶的肿瘤细胞,在黏连蛋白等表面黏附分子的特异性黏附作用下黏附于器官表面,并穿入细胞间隙释放基质蛋白水解酶,降解局部基质,穿过基底膜后,向周围间质侵润性生长,大量增殖成新的肿瘤[9]。肿瘤细胞侵袭转移最先到达的就是细胞基底膜。Transwell小室模型中,肿瘤细胞穿过基质凝胶,到达另一侧,计算其数量,可反映其侵袭活性[10-11]。本实验采用Transwell小室做为模型,观察ASPS含药血清对HT-29细胞体外侵袭活性的抑制作用,结果表明:ASPS含药血清可以明显抑制HT-29体外侵袭基底膜Matrigel成分,其抑制率高于对照组,说明ASPS对结直肠癌HT-29细胞的转移有抑制作用。
bcl-2基因家族主要作用于细胞线粒体[12],其中bcl-2抑制细胞凋亡,bax促进细胞凋亡,两者功能相反却共同参与着细胞凋亡,bcl-2/bax比值是影响细胞凋亡的关键因素[13]。bcl-2家族蛋白与蛋白酪氨酸磷酸酶结合,开放线粒体膜转运孔通道,释放大量细胞色素C,结合细胞凋亡激活因子Apaf-1,使Caspase-9前体活化,促使Caspase-3激活,引发Caspases 级联反应,从而诱发细胞凋亡[14-15]。本研究中Western blotting结果表明:HT-29细胞在ASPS含药血清处理下,上清中bcl-2蛋白表达条带变窄、变浅,bax蛋白表达条带明显变宽、变深,说明bax基因的表达产物随ASPS浓度的升高而表达增加,bcl-2基因的表达产物水平随之降低。同时,Caspase-3蛋白表达水平也随着ASPS浓度升高而升高。说明ASPS可能通过调节HT-29细胞凋亡相关基因,使bax基因的表达上调,bcl-2表达下调,激活Caspase凋亡通路,而诱导肿瘤细胞凋亡。
综上所述,ASPS对肿瘤细胞的侵袭转移有明显的抑制作用,并可诱导细胞凋亡,这为临床开发新的抗肿瘤药物提供了理论依据,其具体机制有待于进一步研究。
[1]陈雯,刘宝瑞.五味子多糖的抗肿瘤研究进展[J].中医临床研究,2012,14(4):24-25.
[2]黄晓东.五味子和桔梗多糖对人结直肠癌CD133+/CD44+细胞生物学行为的影响[D].长春:吉林大学,2012.
[3]许珂玉,肖建英.五味子多糖对甲状腺癌细胞株SW579凋亡及survivin表达的影响[J].吉林大学学报:医学版,2011,37(2):279-283.
[4]牟遇霖.五味子抗肿瘤的研究状[J].中医中药,2010,7(2):84-86.
[5]王艳杰,吴勃岩,孙阳,等.五味子粗多糖对H22、S180荷瘤小鼠抑制作用的实验研究[J].中医药信息,2007,24(5):64-65.
[6]Speidel D.Transcription-independent p53 apoptosis:an alternative route to death[J].Trends Cell Biol,2010,20(1):14-24.
[7]Taira N, Nihira K, Yamaguchi T,et a1.DYRK2 is targeted to the nucleus and controls p53 via Ser46 phosphorylation in the apoptotic response to DNA damage[J].Mol Cell,2007,25(5):725-738.
[8]孟天娇,姜亚磊,闫晓英,等.五味子多糖对人脑胶质瘤细胞凋亡的影响[J].吉林医药学院学报,2014,35(4):254-257.
[9]Denault JB, Salvesen GS.Apoptotic caspase activation and activity[J].Methods Molecul Biol,2008,414(5):191-220.
[10]Dewson G,Kratina T, Czabotar P,et al.Bak activation for apoptosis involves oligomerization of dimers via their alpha 6 helices[J].Mol Cell,2009,36(4):696-703.
[11]黄子明.肝肿瘤细胞内Sox17基因mRNA的表达水平与细胞迁移、侵袭力的相关性研究[D].合肥:安徽医科大学,2013.
[12]陆兔林,吴杨,季德,等.五味子多糖提取分离和药理作用研究进展[J].中国中药杂志,2014,39(4):751-754.
[13]He J,Zhang WY,Zhou QQ,et al.Low- expression of microRNA-107 inhibits cell apoptosis in glioma by upregulation of SALL4[J]. Int J Biochem Cell Biol,2013,45(9):1962-1973.
[14]Yang K,Liu YS,Liu ZX,et al.p38γ overexpression in gliomas and its role in proliferation and apoptosis[J].Sci Rep,2013,12(3):2089.
[15]O’Brien CA,Kreso A,Dick JE.Cancer stem cells in solid tumors: an overview [J].Semin Radiat Oncol,2009,19(2):71-77.
Inhibitory effects ofAlkalineS.chinenispolysaccharides on proliferation and invasion abilities of colon cancer HT-29 cellsinvitro
HUANG Xiaodong1,LU Qian1,SHEN Nan2,WANG Yanchun1
(1.Department of Pharmacology,Jilin Medical College,Jilin 132013,China;2.Function Experiment Center, Jilin Medical College,Jilin 132013,China)
ObjectiveTo investigate the effect ofAlkalineS.chinenispolysaccharides(ASPS) on the proliferation and invasion abilities of the human colon cancer HT-29 cells,and to clarify the anti-tumor effect of ASPS.Methods40 Wistar rates were randomly divided into control group(n=10,given saline),and 100,200,400 mg·kg-1ASPS groups(n=10),respectively.The serum of the rats in various groups were gotten.The HT-29 cells were treated with the serum of the rats in various groups. The inhibitory rates of proliferation and invasion abilities were tested by MTT and Transwell assay;the expression levels of bcl-2,bax,and Caspase-3 proteins in the supernatant of the cells of the rats in various groups were determined by Western blotting method.ResultsCompared with control group,the inhibitory rates of proliferation and invasion abilities of the HT-29 cells in 200 and 400 mg·kg-1ASPS groups were increased(P<0.05,P<0.01).The expression level of bcl-2 protein in 400 mg·kg-1ASPS group was lower than those in other groups (P<0.05),while the expression levels of bax and Caspase-3 proteins were higher than those in control group(P<0.05,P<0.01).ConclusionASPS can inhibit the proliferation and invasion abilities of the human colon cancer HT-29 cells,and its mechanism may be related to down-regulating the expression of bcl-2 protein and up-regulating the expressions of bax and Caspase-3 proteins,thus activating the apoptotic pathway of HT-29 cells.
colon cancer;AlkalineS.chinensispolysaccharides; invasive ability; apoptosis
1671-587Ⅹ(2015)02-0287-04
10.13481/j.1671-587x.20150215
2014-08-26
吉林省教育厅“十二五”科研项目资助课题(2014547)
黄晓东(1978-),男,辽宁省抚顺市人,讲师,医学博士,主要从事肿瘤药理学方面的研究。
王艳春,教授,硕士研究生导师(Tel:0432-64560470,E-mail:wangyanchun1972@163.com)
R730.52;R735.3
A

