兔耳增生性瘢痕切除术后放射治疗时间与疗效关系的基础研究
于尔特, 金石峰, 郭 澍, 李 光, 孙 强, 王晨超, 孙 旭
实验研究
兔耳增生性瘢痕切除术后放射治疗时间与疗效关系的基础研究
于尔特, 金石峰, 郭 澍, 李 光, 孙 强, 王晨超, 孙 旭
目的探讨增生性瘢痕术后放射治疗的疗效和最佳时期。方法制作增生性瘢痕模型。1个月后,将造模成功的兔耳分成3组:未切除组(30处)仅造模;切除未放射组(30处)行瘢痕切除术;切除放射组(180处)术后放射治疗,并根据放射治疗时间平均分为6组:术后即时放射组、术后12 h放射组、术后24 h放射组、术后48 h放射组、术后72 h放射组、术后120 h放射组。结果与切除放射组相比,未切除组和切除放射组瘢痕直径明显增大,差异具有统计学意义(P<0.05)。HE染色观察发现,术后各放射组瘢痕增生指数、成纤维细胞数密度及胶原纤维面密度均明显低于未切除组和切除未放射组(P<0.05),且术后24 h内放射治疗上述值最低,而未切除组和切除未放射组上述指标差异无统计学意义(P>0.05)。结论瘢痕切除联合放射治疗对于增生性瘢痕具有良好的预防作用,同时,术后24 h内行放射性治疗为最佳时机。
增生性瘢痕; 瘢痕切除术; 放射治疗时机
瘢痕组织是人体创伤修复过程中的一种自然现象,但在伤口愈合过程中,过度增生则属于病理性改变[1-4]。病理性瘢痕包括增生性瘢痕(hypertrophic scar, HS)和瘢痕疙瘩[5]。病理性瘢痕的治疗方法很多,但疗效并不理想。手术切除复发率为60.0%~90.0%[6]。单纯放射治疗的有效率为10.0%~94.0%,复发率达50.0%~100.0%[7],而术后用放射治疗的治愈率达到67.0%~97.2%[8]。自2014年3月至2015年5月,我们用家兔制作HS模型,通过对未切除组、切除后未放射组合切除放射组进行对比研究,明确术后放射治疗的疗效及最佳治疗时期。
1 动物来源
新西兰大白兔40只,月龄8~12个月,体质量1.8~2.3 kg,雌雄不限。均由中国医科大学动物实验中心提供。单笼同等条件饲养。
2 实验方法
2.1 瘢痕模型的制作 用盐酸赛拉嗪(0.2 ml/kg)于大腿根部肌肉注射进行麻醉,待白兔呼吸变浅慢,肌张力下降后,剃除兔耳腹侧短毛,用甲紫在兔耳腹侧内侧缘中、下部位标记直径为6 mm的圆形切口。用皮肤取样器沿标记线切开皮肤全层,在皮肤与耳软骨之间锐性剥离。每只兔耳分别做4个创面,各创面之间的距离为1.0 cm。创面压迫止血后,用无菌纱布覆盖,胶布固定,归笼饲养。第2天去除固定的胶布、敷料,外涂碘伏至创面自然愈合。术后1个月所有创面均愈合,形成257处HS。2.2 实验分组 随机选取240处HS标本分为3组:未切除组(30处);切除未放射组(30处),瘢痕切除手术;切除放射组(180处),瘢痕切除后,根据术后首次放射治疗的时间分为术后即时放射组、术后12 h放射组、术后24 h放射组、术后48 h放射组、术后72 h放射组、术后120 h放射组,每组30处。

3 结果
共造模320个,产生257个HS模型,造模率为77.5%(图1a~d)。与切除未放射组相比,术后放射各组的平均愈合时间差异无统计学意义(P>0.05);与未切除组相比,切除未放射组瘢痕直径增大(P<0.05);与切除未放射组相比,术后即时、12、24、48 h放射组瘢痕直径明显缩小;与未切除组及切除放射组相比,切除未放射组的平均瘢痕直径增大。而术后72、120 h放射组瘢痕直径差异无统计学意义(P>0.05);与切除未放射组相比,术后放射各组的感染率差异无统计学意义(P>0.05,表1,图1)。
3.1 瘢痕增生指数测量结果 未切除组与切除未放射组瘢痕增生指数分别为2.78±0.19、2.97±0.24,差异无统计学意义(P>0.05);术后即时、12、24、48 h放射组瘢痕增生指数明显减小,分别为2.21±0.09、2.05±0.12、1.98±0.13、2.14±0.07(P<0.05),48 h内放射组瘢痕增生指数差异无统计学意义(P>0.05),而术后72、120 h放射组瘢痕增生指数分别为2.47±0.17、2.73±0.13,与切除未放射组相比,差异无统计学意义(P>0.05)。未切除组、切除未放射组可见大量成纤维细胞。即时、12、24、48 h放射组可见成纤维细胞明显减少。72、120 h放射组仍可见大量成纤维细胞(图2)。3.2 成纤维细胞数密度测量结果 未切除组有大量着色较深的FB及细胞基质,FB胞体较大(图2)。未切除组与切除未放射组成纤维细胞数密度,分别为57.75±5.09、58.07±6.89,差异无统计学意义(P>0.05)、术后即时、12、24、48 h放射组纤维细胞数密度明显减小,分别为27.84±4.43、26.92±7.47、25.49±4.85、27.72±5.17(P<0.05),48 h内放射组纤维细胞数密度差异无统计学意义(P>0.05),而术后72、120 h放射组纤维细胞数密度分别为59.01±6.75、59.39±7.34,与切除未放射组相比,差异无统计学意义(P>0.05;图2,3)。未切除组、切除未放射组可见大量密集的胶原纤维。即时、12、24 h放射组可见胶原纤维明显减少。48、72、120 h放射组胶原纤维仍较致密(图3)。3.3 胶原纤维面密度测量结果 未切除组胶原纤维染色增强,粗大,排列紊乱,纤维走行互不平行、杂乱无章,与未切除组与切除未放射组胶原纤维面密度分别为54.74±6.95、61.86±8.93,差异无统计学意义(P>0.05)。术后即时、12、24 h放射组胶原纤维面密度明显减小,分别为37.47±7.04、41.97±6.14、39.07±5.99(P<0.05),胶原纤维结构较紧密,组织排列较规整,局部交错排列,基本平行于表皮排列,但有部分纤维排列紊乱,24 h内放射组胶原纤维面密度无统计学意义(P>0.05),而术后48、72、120 h放射组胶原纤维面密度分别53.33±6.58、58.97±7.06、60.04±9.68,与切除未放射组相比,差异无统计学意义(P>0.05),见图4,5。
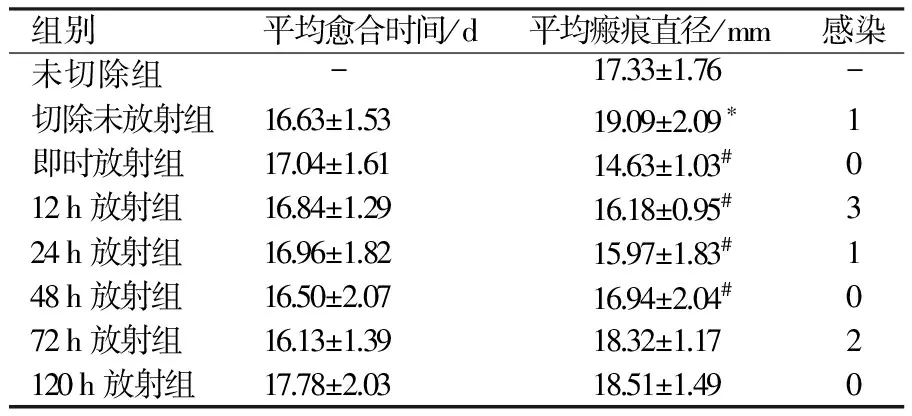
表1 瘢痕生长大体形态观察
注:*与未切除组相比,P<0.05;#与切除未放射组相比,P<0.05,χ2=8.2759
4 讨论
目前临床上HS的治疗主要有手术和非手术方法。非手术治疗种类繁多,但这些方法不同程度地存在疗效不佳、不良反应大、易复发等缺点[9]。单纯行增生性瘢痕切除术,术后复发率60%~90%,而且较切除前,复发后瘢痕面积会更大。本研究表明,术后放射治疗与单纯手术治疗相比,可将复发率降低50%[10]。临床放射治疗病理性瘢痕有单独进行、术后24 h以内、术后24~48 h、术后5~10 d开始4种选择。由于瘢痕由成熟的纤维细胞和胶原细胞组成,对放射线并不敏感,放射治疗只能在一定程度上减轻症状和抑制发展,所以单纯的放射治疗效果较差,故临床中多不使用。24 h以内病理性瘢痕切口处的肉芽组织中幼稚纤维母细胞及占大多数的不稳定胶原对放射线较敏感。所以多数学者主张术后24 h内开始进行放射治疗[11]。
与切除未放射组相比,术后即时、12、24、 48、72 h放射治疗,瘢痕形成的复发率均降低,HE染色后,检测瘢痕增生指数、成纤维细胞数密度均降低,VG染色后胶原纤维面密度明显降低。而与术后即时放射治疗相比,术后48 h放射治疗,瘢痕形成的复发率、检测瘢痕增生指数、成纤维细胞数密度相近,差异无统计学意义。与术后即时放射治疗相比,术后72 h放射治疗,瘢痕形成的复发率、瘢痕增生指数、成纤维细胞数密度以及胶原纤维面密度均有增加。术后120 h放射治疗,瘢痕形成的复发率、瘢痕增生指数和成纤维细胞数与切除未放射组相比,差异无统计学意义(P>0.05)。上述结果说明,考虑到早期时肉芽组织中幼稚纤维母细胞及占大多数的不稳定胶原被放射线抑制,通过破坏足够的细胞,使胶原合成与降解之间建立平衡,对纤维组织细胞增生性瘢痕有预防作用,故术后应早期行放射治疗,且24 h内行放射治疗效果最好。但有学者认为,早期的放射治疗可能会增加术后感染及切口不愈合的可能性,故推荐术后24~48 h以及术后5~10 d开始行放射治疗[12]。术后即时、12、24、48、72、120 h放射治疗与单纯瘢痕切除手术组感染概率差异无统计学意义(P>0.05),其产生的小血管闭塞和减少炎症介质的含量,对伤口渗血能起到止血的作用,对预防伤口感染也有一定作用。

图1 造模及瘢痕切除术后1个月 a.造模后3 d创周红肿 b.造模后7 d c.造模术后14 d创缘略肿胀 d.造模术后28 d瘢痕形成 e.未切除组 f.切除未放射组 g.术后即时放射组 h.术后12 h放射组 i.术后24 h放射组 j.术后48 h放射组 k.术后72 h放射组 l.术后120 h放射组

图2 HE染色观察成纤维细胞数密度(×400) a.未切除组 b.切除未放射组 c.即时放疗组 d.12 h放射组 e.24 h放射组 f.48 h放射组 g.72 h放射组 h.120 h放射组 图3 成纤维细胞数密度 图4 Van Gieson染色观察胶原纤维面密度(×200) a.未切除组 b.切除未放射组 c.即时放射组 d.12 h放射组 e.24 h放射组 f.48 h放射组 g.72 h放射组 h.120 h放射组 图5 胶原纤维面密度
[1] Ma GE, Lei H, Chen J, et al. Reconstruction of large hypertrophic scar on trunk and thigh by means of liposuction technique[J]. Burns, 2010,36(2):256-260.
[2] Rabello FB, Souza CD, Farina Júnior JA. Update on hypertrophic scar treatment[J]. Clinics (Sao Paulo), 2014, 69(3):565-573.
[3] Mohammadi AA, Mohammadian Panah M, Pakyari MR, et al. Surgical excision followed by low dose rate radiotherapy in the management of resistant keloids. World[J]. Plast Surg, 2013,2(5):81-86.
[4] Li ZJ, Kim SM. The application of the starfish hatching enzyme for the improvement of scar and keloid based on the fibroblast-populated collagen lattice[J]. Appl Biochem Biotechnol, 2014,173(5):989-1002.
[5] Kwon SY, Park SD, Park K. Comparative effect of topical silicone gel and topical tretinoin cream for the prevention ofhypertrophic scar and keloid formation and the improvement of scars[J]. Eur Acad Dermatol Venereol, 2014,28(3):1025-1033.
[6] Kal HB, Veen RE, Jurgenliemk-Schulz IM. Dose-effect relation-ship for recurrence ofkeloid and pterygium after surgery and radiotherapy Int [J]. Radiat Oncol BIOL Phys, 2009,74(1);245-251.
[7] Scrimali L, Lomeo G, Tamburino S, et al. Laser CO2versus radiotherapy in treatment of keloid scars[J]. Cosmet Laser Ther, 2012,14(2):94-97.
[8] Bischof M, Krempien R, Debus J, et al. Postoperative electron beam radiotherapy for keloids: objective findings and patient satisfaction in self-assessment Int[J]. Int J Dermatol, 2007,46(9):971-975.
[10] Slemp AE, Kirschner RE. Keloids and scars: a review of keloids and scars, their pathogenesis, risk factors, and management[J]. Curr Opin Pediatr, 2006,18(4):396-402.
[11] De Lorenzi F, Tielemans HJ, van der Hulst RR, et al. Is the treatment of keloid scars still a challenge in 2006[J]? Ann Plast Surg, 2007,58(2):186-192.
[12] Issa MC, Kassuga LE, Chevrand NS, et al. Topical delivery of triamcinolone via skin pretreated with ablative radiofrequency: a new method inhypertrophic scar treatment[J]. Int J Dermatol, 2013,52(3):367-370.
Relationshipbetweenradiotherapytimeandcurativeeffectafterresectionofhypertrophicscarofrabbitears
YUEr-te,JINShi-feng,GUOShu,etal.
(DepartmentofPlasticSurgery,TheFirstAffiliatedHospitalofChinaMedicalUniversity,Shenyang110001,China)
ObjectiveTo explore the curative effect and the best time of radiotherapy after resection of hypertrophic scar of rabbit ears.MethodsThe rabbit hypertrophic scar (HS)models were made. One month later, they were divided into 3 groups; the control group (30), the resection without irradiation group (30) and the resection with irradiation group (180). According the time of irradiation, they were divided into 6 groups; immediate irradiation after resection, irradiation after resection at 12 h, irradiation after resection at 24 h, irradiation after resection at 48 h, irradiation after resection at 72 h and irradiation after resection at 120 h.ResultsCompared with the resection with irradiation group, the diameter in the other two groups increased obviously, there was statistical differences (P<0.05). HE staining showed that scar proliferation indexes in the each radiation group, the number density of fibroblasts and collagen fiber surface density were significantly lower than those in the control group and the resection without irradiation group (P<0.05), and the values mentioned above were the lowest while postoperative radiotherapy performed within 24 hours, and the values at the other groups had no significant difference (P>0.05).ConclusionThe treatment of hypertrophic scar by scar resection combined with radiotherapy is preventive. Besides postoperative radiation within 24 hours is the best time for treatment.
Hypertrophic scar; Scar resection; Radiotherapy time point
110001 辽宁 沈阳,中国医科大学附属第一医院 (整形外科:于尔特,金石峰,郭 澍,孙 强,王晨超,孙 旭;放射科:李 光)
于尔特(1986-),男,辽宁营口人,硕士研究生;金石峰(1982-),男(朝鲜族),辽宁沈阳人,主治医师,硕士.
郭 澍,110001,中国医科大学附属第一医院 整形外科,电子信箱:guoshu67@sohu.com
10.3969/j.issn.1673-7040.2015.11.021
R619.6
A
1673-7040(2015)11-0698-04
2015-09-15)

