氧化苦参碱增强多西他赛对黑色素瘤细胞增殖的抑制作用
张 宇, 郭冰玉, 回 蔷, 全亮亮, 陶 凯
实验研究
氧化苦参碱增强多西他赛对黑色素瘤细胞增殖的抑制作用
张 宇, 郭冰玉, 回 蔷, 全亮亮, 陶 凯
氧化苦参碱; 多西他赛; A375; 黑色素瘤
近年来皮肤肿瘤的发病率有所增加[1-2], 恶性黑色素瘤是死亡率最高的皮肤肿瘤[3-5]。因此,亟需寻找新的药物来优化化疗方案,提高患者生存质量和生存期。氧化苦参碱可通过多种途径抑制肿瘤细胞[6-7],多西他赛(Decetaxel)主要阻滞细胞周期的转化[8]。目前尚无研究探讨两种药物联合用于黑色素瘤治疗的效果。自2014-2015年,笔者观察氧化苦参碱联合多西他赛对细胞增殖的抑制效果,以及对细胞周期阻滞的影响,以期待改善化疗药物治疗黑色素瘤的使用剂量,为优化临床治疗黑色素瘤的方案提供理论基础。
1 实验材料
人黑色素瘤A375细胞株(购自中国医学科学院基础医学研究所),DMEM培养基(美国INVITROGEN公司),胎牛血清(天津灏洋公司),氧化苦参碱(美国SELLECK公司),多西他赛注射液(江苏恒瑞医药股份有限公司),四甲基偶氮唑蓝(MTT,美国SIGMA公司),PI染料(上海碧云天生物技术有限公司),Cyclin D1、CDK4、CDK6和GAPDH抗体(美国SANTA公司),SYBR Green(美国PROMEGA公司)。
2 实验方法
2.1 细胞培养 用含10%胎牛血清的DMEM培养基(含50 IU/ml青霉素,50 IU/ml链霉素)培养A375细胞株,置37 ℃、5 %CO2培养箱中培养至对数生长期。将传代的A375细胞分为4组:生理盐水组、多西他赛组、氧化苦参碱组和两种药物联合组。生理盐水组为空白对照组。2.2 药物处理浓度 多西他赛根据lin burg公式C=20D(C单位为μg/ml,D为临床剂量单位为mg/kg·d-1)和体表面积计算公式S=1.15+(m-30)·0.1·5-1(其中m>30 kg)计算出所需药物浓度。
2.3 MTT实验 细胞培养12 h后,加入不同处理因素,各组3复孔。处理后细胞于不同时间点通过MTT方法记录吸光值(490 nm)。药物对细胞的抑制率计算公式为:

2.4 细胞周期分析 不同处理因素作用24 h后收集细胞,制成单细胞悬液。用70%的冰乙醇4 ℃固定1 h,用PI染液避光染色30 min,用流式细胞仪测定细胞周期。
2.5 WESTERN BLOT检测蛋白表达水平 药物作用24 h后收集细胞,提取蛋白后每个加样孔上样40 μg蛋白。进行SDS-PAGE电泳。2.6 PCR检测蛋白RNA表达水平 TRIZOL法提取细胞总RNA,通过试剂盒反转录成cDNA,参照说明书进行REALTIME PCR反应。所用引物为Cyclin D1, F(5′-3′): CCGAGGAGCTGCTGCAAATGGAGCT; R(5′-3′):GAAATCGTGCGGGGTCATTGCGGC; CDK4, F(5′-3′): CAGAGCTCTTAGCCGAGCGT;R (5′-3′): GGCACCGACACCAATTTCAG; CDK6, F(5′-3′): GTCTGATTACCTGCTCCGC; R(5′-3′): CCTCGAAGCGAAGTCCTC; GAPDH, F(5′-3′): CATCCCTTCTCCCCACACAC; R (5′-3′): AGTCCCAGGGCTTTGATTTG。
3 结果
表1所示,5 μg/ml多西他赛与10 μg/ml氧化苦参碱联合应用对A375细胞增殖的抑制能够起到协同作用的效果。各组间差异具有统计学意义(P<0.05);图1所示,不同处理因素作用下,A375细胞的G1-S期转化受到了不同程度的抑制,当多西他赛与氧化苦参碱联合应用时,细胞周期G1-S期被阻滞的程度增强;图2,3所示,当多西他赛与氧化苦参碱联合应用时,蛋白被抑制的程度增强。
4 讨论
黑色素瘤是皮肤肿瘤中最致命的一种肿瘤[9],极具隐蔽性,术后化疗是治疗黑色素瘤的重要环节[10]。但由于化疗药物具有很强的毒副作用[11]。因此,寻找与化疗药物协同作用的药物,对改善患者的生存质量具有积极意义。
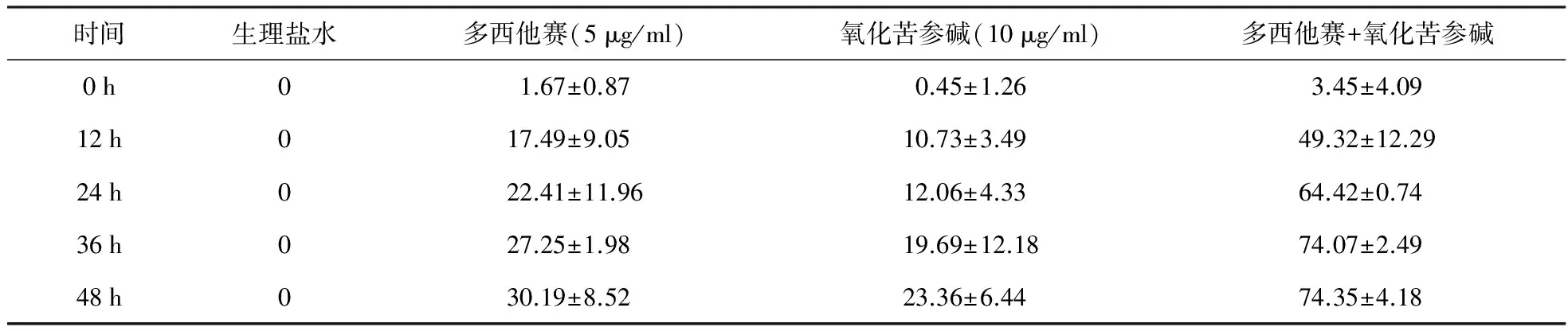
表1 多西他赛、氧化苦参碱单独使用以及联合应用时细胞增殖的抑制作用
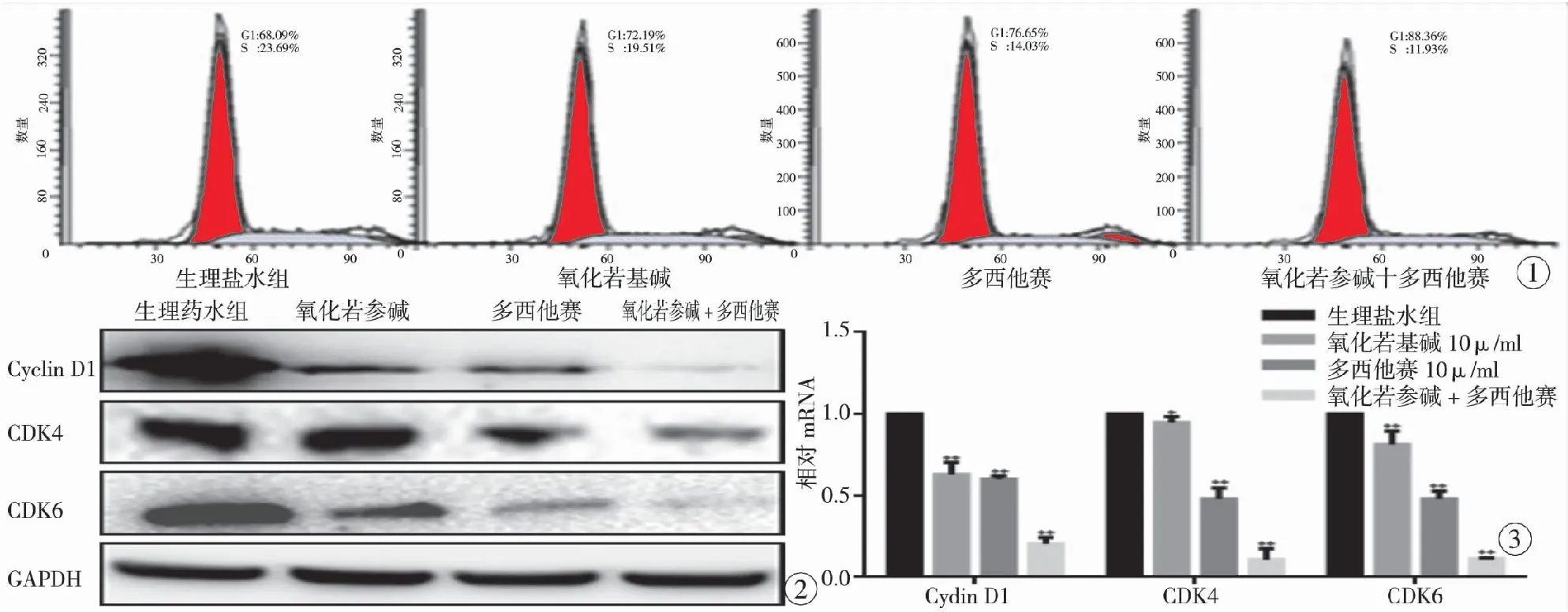
图1 不同处理因素作用下细胞周期的变化 图2 不同处理因素作用下A375细胞蛋白的变化 图3 不同处理因素作用下A375细胞蛋白RNA水平的影响(*P<0.05,**P<0.01)
研究结果显示,当低浓度氧化苦参碱(10 μg/ml)与低浓度的多西他赛(0.1×PPC)联合应用时,对A375细胞增殖的抑制起到了协同作用。流式分析技术也显示联合作用24 h时药物对细胞周期G1~S期的阻滞作用增强。与此同时药物联用时对细胞周期相关蛋白的抑制作用显著增强。由此可见,氧化苦参碱可以增强多西他赛对A375细胞增殖的抑制效果。研究表明,氧化苦参碱与抗肿瘤药物联合应用可产生协同作用。氧化苦参碱联合环磷酰胺可增强其抗肿瘤效果[12]。氧化苦参碱也可以增强VCR、平阳霉素、顺铂和5-FU的化疗效果[13]。与此同时氧化苦参碱与化疗药物联合应用时也可提高化疗耐受性和患者的生存质量[14-15]。
综上所述,氧化苦参碱与多西他赛联用可以降低多西他赛的使用浓度,避免了化疗药物高浓度引起的各种不良反应,改善患者生存质量。
[1] Harris K, Modi K, Kumar A, et al. Endobeochial ultrasound-guided transbronchial needle aspiration of pulmonary artery tumors: A systematic review (with video)[J]. Endosc Ultrasound, 2015,4(3):191-197.
[2] Leiter U, Garbe C. Epidemiology of melanoma and nonmelanoma skin cancer-the role of sunlight [J]. Adv Exp Med Biol, 2008,624:89-103.
[3] Miller AJ, Mihm MC Jr. Melanoma [J]. N Engl J Med, 2006, 355(1):51-65.
[4] 刘桂芹, 应方微. 奥曲肽体外对黑色素瘤细胞株A375分泌VEGF的影响[J]. 国际眼科杂志, 2010,10(2):231-232.
[5] 赵 燕, 李成林, 杨鹤鸣, 等. 皮肤恶性黑色素瘤的临床治疗进展 [J]. 湖南中医药大学学报, 2001,31(4):74-75.
[6] Guo B, Zhang T, Su J, et al. Oxymatrine targets EGFR (p-Tyr845) and inhibits EGFR-related signaling pathways to suppress the proliferation and invasion of gastric cancer cells[J]. Cancer Chemother Pharmacol, 2015,75(2):353-363.
[7] 陈晓峡, 向小庆, 叶 红. 苦参碱及氧化苦参碱抗肿瘤作用的研究进展[J]. 中国实验方剂学杂志, 2013,19(11):361-364.
[8] 李 慧, 孙文辉, 薛 蓓, 等. 多西他赛联合顺铂, 5-FU治疗进展期胃癌[J]. 中国癌症杂志, 2006,16(10):838-840.
[9] Rager EL, Bridgeford EP, Ollila D. Cutaneous melanoma: update on prevention, screening, diagnosis, and treatment [J]. Am Fam Physician, 2005,72(2):269-276.
[10] Murphy MJ. Diagnostic and prognostic biomarkers and therapeutic targets in melanoma [M]. Springer, 2012,58:89-114.
[11] Becker D, Mihm MC, Hewitt SM, et al. Markers and tissue resources for melanoma: meeting report [J].Cancer Res, 2006,66(22):10652-10657.
[12] 王 锐, 姜小军, 郑 婕, 等. 氧化苦参碱增强环磷酰胺对小鼠LEWIS肺癌生长的抑制作用[J]. 第二军医大学学报, 2008,29(4):399-403.
[13] 王 驰, 叶 琳, 沈 娜, 等. 氧化苦参碱与常见肿瘤药物相互作用对HNE-1、HNE-1(200)细胞周期的影响[J]. 肿瘤学杂志, 2009,15(7):622-624.
[14] 杨泽松, 陈建斌, 张红宾, 等. 苦参碱葡萄糖注射液联合CHOP方案治疗非霍奇金淋巴瘤的临床研究[J]. 中成药, 2007,29(12):1728-1730.
[15] 邢晓静, 张丽红, 蔡玉文, 等. 苦参碱联合化疗治疗进展期胃癌疗效分析[J]. 辽宁中医杂志, 2007,34(12):1742-1743.
Enhancementofoxymatrineontheinhibitionofdocetaxelonmelanomaproliferation
ZHANGYu,GUOBing-yu,HUIQiang,etal.
(DepartmentofPlasticSurgery,TheGeneralHospitalofShenyangMilitary,Shenyang110840,China)
ObjectiveTo observe the enhancment of Oxymatrine on inhibition of Decetaxel on proliferation of human melanoma A375 cells.MethodsA375 cells were divided into four groups: saline group, Docetaxel treatment group, Oxymatrine treatment group and Docetaxel combined with Oxymatrine treatment group. The proliferation rate of A375 cells at different time points treated by different concentrations of drugs were tested by MTT and the cells cycle tested by flow cytometry. Then the protein level and RNA level of proteins were detected by western blot and realtime pcr.Results5 μg/ml of Docetaxel, 10 μg/ml of Oxymatrine or Oxymatrine combined with Docetaxel were treated on A375 cells, the inhibition of cell proliferation were (22.41±11.96)%, (12.96±4.33)% and (64.42±0.74)%. In control group and experience groups, the G1 phase of cell cycle were (68.09±6.75)%, (72.19±5.44)%, (76.65±1.88)% and (86.51±3.41)%. At the same time Oxymatrine could significantly enhance the inhibition of Cyclin D1, CDK4 and CDK6 by Decetaxel.ConclusionOxymatrine combined with Decetaxel having a synergistic effect on the inhibition of the proliferation of melanoma cells, which can decrease the side effects of Decetaxel.
Oxymatrine; Decetaxel; A375; Melanoma
】目的观察氧化苦参碱对多西他赛抑制黑色素瘤细胞增殖的作用。方法将传代的A375细胞分为4组:生理盐水组、多西他赛组、氧化苦参碱组和两种药物联合组,在不同的时间点通过MTT的方法检测药物对细胞增殖的作用;流式细胞仪检测细胞周期;通过WESTERN BLOT以及PCR的手段检测不同因素作用下相关蛋白的变化。结果对细胞作用24 h, 5 μg/ml多西他赛、10 μg/ml氧化苦参碱以及两种药物联合处理组对A375细胞的增殖抑制率分别为(22.41±11.96)%、(12.96±4.33)%和(64.42±0.74)%。药物联合使用对A375细胞的抑制作用显著高于各单药组相同剂量药物,各组间差异具有统计学意义(P<0.05)。生理盐水组以及不同药物处理组细胞周期G1期的百分比分别为(68.09±6.75)%、(72.19±5.44)%、(76.65±1.88)%和(86.51±3.41)%。药物联用组对G1期阻滞作用增强。各组数据间差异具有统计学意义(P<0.05)。氧化苦参碱也可增强多西他赛对蛋白Cyclin D1、CDK4和CDK6的抑制作用。结论氧化苦参碱(10 μg/ml)可显著增强低浓度的多西他赛(0.01×PPC)对黑色素瘤细胞增殖的抑制作用,联合应用能够降低多西他赛的使用浓度,减少其引发的不良反应。
10.3969/j.issn.1673-7040.2015.11.022
R739.5
A
1673-7040(2015)11-0702-03
2015-09-29)
110840 辽宁 沈阳,沈阳军区总医院 整形外科
张 宇(1986-),男,辽宁沈阳人,技师,硕士.
陶 凯,110840,沈阳军区总医院 整形外科,电子信箱:plastypaper@163.com 【

