羟苯磺酸钙对对比剂肾病大鼠肾的保护作用
于芬芬 季文萱 单文红 孙艳 刘桂美 黄俊彦
近年来随着放射影像学的快速发展和介入治疗的广泛应用,对比剂在临床诊疗中的应用也越来越多,对比剂引起的对比剂肾病(contrastinduced nephropathy,CIN)也随之逐年增多,已成为医院获得性肾功能不全的第3 位原因[1]。目前,CIN 的发病机制尚不明确,认为可能的机制有:血流动力学发生改变导致肾髓质缺血缺氧,对比剂对肾小管的直接毒性作用,活性氧产生增多导致氧化应激损伤,细胞凋亡,炎性因子等[1-2]。国内外许多研究表明,抗氧化剂可通过减少肾氧化应激对CIN 发挥保护作用[3-5]。羟苯磺酸钙是一种微循环改善剂及抗氧化剂,广泛应用于抗氧化治疗。本实验通过建立CIN 大鼠模型,检测肾丙二醛(malondialdehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)的表达及细胞凋亡情况,观察氧化应激和细胞凋亡与CIN 的关系,并给予羟苯磺酸钙干预,探讨羟苯磺酸钙在CIN 中的干预效果及相关作用机制。
1 材料与方法
1.1 实验动物与试剂
实验动物选取体重为200 ~220 g 的清洁级、健康雄性Wistar 大鼠(购自山东鲁抗实验动物中心)。TUNEL 试剂盒购自Roche 公司,MDA、SOD、GSH-Px试剂盒购自R ﹠ D,吲哚美辛(indometacin,INDO)粉剂、N-硝基-L-精氨酸甲酯(N'-nitro-L-argininemethylesterhydrochloride,L-NAME)粉剂均购自美国Sigma 公司,76%泛影葡胺购自上海旭东海普药业有限公司,羟苯磺酸钙购自海南林恒制药有限公司。
1.2 实验方法
1.2.1 CIN 大鼠模型建立及分组 将84 只大鼠按照随机数字表法分为3 组:假手术组(A 组)、模型组(B 组)和羟苯磺酸钙干预组(C 组),每组28 只。造模当天,B 组、C 组按文献制备CIN 大鼠模型[6]并有所改进,具体方法如下:大鼠尾静脉埋置留置针1 枚,每隔15 min 分别由大鼠尾静脉注射INDO(10 mg/kg)、L-NAME(10 mg/kg)和76%泛影葡胺(10 ml/kg);A 组同样方法注射等量的INDO、L-NAME及生理盐水;C 组于造模前3 d 及造模当天给予羟苯磺酸钙[100 mg/(kg·d)][7]灌胃,A 组及B 组给予等量的生理盐水灌胃。造模72 h 内A 组未见大鼠死亡,B 组有5 只大鼠死亡,C 组有1 只大鼠死亡。以应用对比剂48 h 或72 h 内血肌酸酐(Scr)较基础水平升高≥25%为造模成功[1]。
1.2.2 标本收集 于造模后24 h、48 h、72 h 分批处死大鼠,每组每个时间点处死大鼠7 只,腹主动脉取血,摘取大鼠双肾,剥离肾被膜,取1/4 肾组织于10%中性甲醛固定,其余肾组织液氮速冻后转入-80℃冰箱冻存。
1.2.3 生化指标检测 造模后48 h,应用日本奥林巴斯AU2700 全自动生化分析仪检测尿素氮(BUN)、Scr。
1.2.4 病理检查 肾组织石蜡包埋,切片,HE 染色,光镜下观察造模后24 h、48 h、72 h 的肾病理变化。
1.2.5 ELISA 法检测造模后48 h 血清MDA、SOD、GSH-Px 在聚乙烯板反应孔中加入准备好的样品及标准品,37℃反应30 min,洗板;加入酶标试剂反应30 min,洗板;加入显色液,37℃显色10 min,加入终止液,15 min 内读取OD 值,绘制标准曲线,并计算样品浓度。
1.2.6 TUNEL 检测造模后48 h 肾细胞凋亡 中性甲醛固定肾组织,石蜡包埋,切片,脱蜡,水合,细胞通透,加TUNEL 反应液,再加入标记荧光素抗体的辣根过氧化酶,然后与二氨基苯胺(DAB)反应显色,光学显微镜下观察并计数凋亡细胞。在细胞凋亡区域,随机选取5 个视野(×400),以肾小管上皮细胞凋亡阳性细胞数占肾小管上皮细胞总数的百分比作为肾小管上皮细胞凋亡指数,同时设阴性对照。
1.3 统计学分析
所有资料采用SPSS 17.0 统计软件进行数据分析。正态分布数据采用 珋±s 表示,同一时间点不同组间比较采用单因素方差分析。以P <0.05 为差异有统计学意义。
2 结果
2.1 生化指标检测结果
A 组大鼠造模后各时间段血BUN、Scr 未见显著变化,B 组和C 组大鼠造模后24 h 血BUN、Scr 显著升高,48 h 达到高峰,至72 h 有所下降。与A 组相比,B 组大鼠造模后48 h 血Scr 升高2 倍以上,达到CIN 的诊断标准[1];与B 组相比,C 组大鼠造模后48 h BUN、Scr 水平显著降低,差异有统计学意义(P <0.05),但仍比A 组严重(表1)。
表1 各组大鼠造模后48 h 生化指标(珋±s,n=7)

表1 各组大鼠造模后48 h 生化指标(珋±s,n=7)
注:Scr,肌酸酐;BUN,尿素氮;A 组,假手术组;B 组,模型组;C组,羟苯磺酸钙干预组;a,与A 组比较,P <0.05;b,与B 组比较,P <0.05
项目 A 组 B 组 C组Scr(μmol/L) 34.3 ±5.7 105.6 ±10.8a 66.6 ±3.1 ab BUN(mmol/L) 4.6 ±0.8 54.4 ± 2.8a 48.4 ±3.9 ab
2.2 病理变化
A 组大鼠各时间段均未见明显病理变化;B 组和C 组大鼠造模后24 h 即出现肾病理损伤,造模后48 h 及72 h 病理损伤严重,出现肾小管重度玻璃样变性、肾小球萎缩;C 组同时间段病理变化较B 组轻,但仍比A 组严重(图1)。
2.3 用ELISA 法检测造模后48 h 血清MDA、SOD、GSH-Px
与A 组相比,B 组MDA 表达显著升高,SOD 及GSH-Px 表达显著降低,差异均有统计学意义(P <0.05);C 组MDA 表达较B 组低,SOD 及GSH-Px 表达较B 组高,但仍未达到A 组水平,差异有统计学意义(P <0.05,表2)。
表2 各组大鼠造模后48 h 血清MDA、SOD、GSH-Px 表达情况(珋±s,n=7)
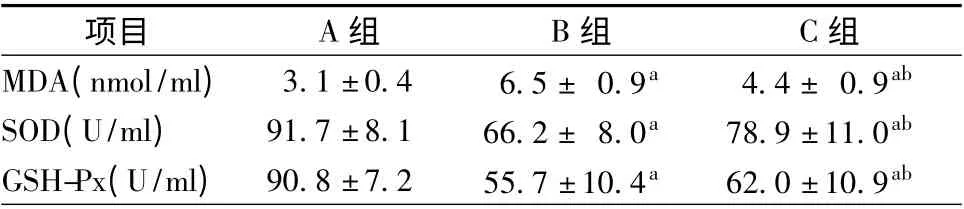
表2 各组大鼠造模后48 h 血清MDA、SOD、GSH-Px 表达情况(珋±s,n=7)
注:MDA,丙二醛;SOD,超氧化物歧化酶;GSH-Px,谷胱甘肽过氧化物酶;A 组,假手术组;B 组,模型组;C 组,羟苯磺酸钙干预组;a,与A 组比较,P <0.05;与B 组比较,P <0.05
项目 A 组 B 组 C组MDA(nmol/ml) 3.1 ±0.4 6.5 ± 0.9a 4.4 ± 0.9 ab SOD(U/ml) 91.7 ±8.1 66.2 ± 8.0a 78.9 ±11.0ab GSH-Px(U/ml) 90.8 ±7.2 55.7 ±10.4a 62.0 ±10.9 ab

图1 HE 染色观察各组大鼠造模后不同时间段的病理改变(×400)
2.4 TUNEL 法检测造模后48 h 肾细胞凋亡
光学显微镜下观察并计数凋亡细胞,计算肾小管上皮细胞凋亡指数(珋±s,n =7),3 组的凋亡指数(%)分别为:A 组(0.6 ± 0.5)%,B 组(38.7 ±4.6)%,C 组(8.3 ±3.6)%。A 组肾细胞未见明显凋亡;与A 组相比,B 组大鼠肾细胞凋亡显著,凋亡指数显著升高,差异有统计学意义(P <0.05);与B组相比,C 组大鼠肾细胞凋亡明显减轻,凋亡指数显著降低,但仍重于A 组,差异有统计学意义(P <0.05,图2)。
3 讨论
CIN 是指在使用对比剂48 h 或72 h 内出现的肾损伤,通常指血Scr 绝对值升高≥44.2 μmol/L,或相对基础水平升高≥25%,且排除其他能够引起肾损伤的因素,血Scr 水平在3 ~5 d 达到高峰,通常在7 ~10 d 可降至基线水平[1]。目前,CIN 的发病机制尚不明确,较多研究表明,氧化应激和细胞凋亡可能参与CIN 的发病机制[3-5]。
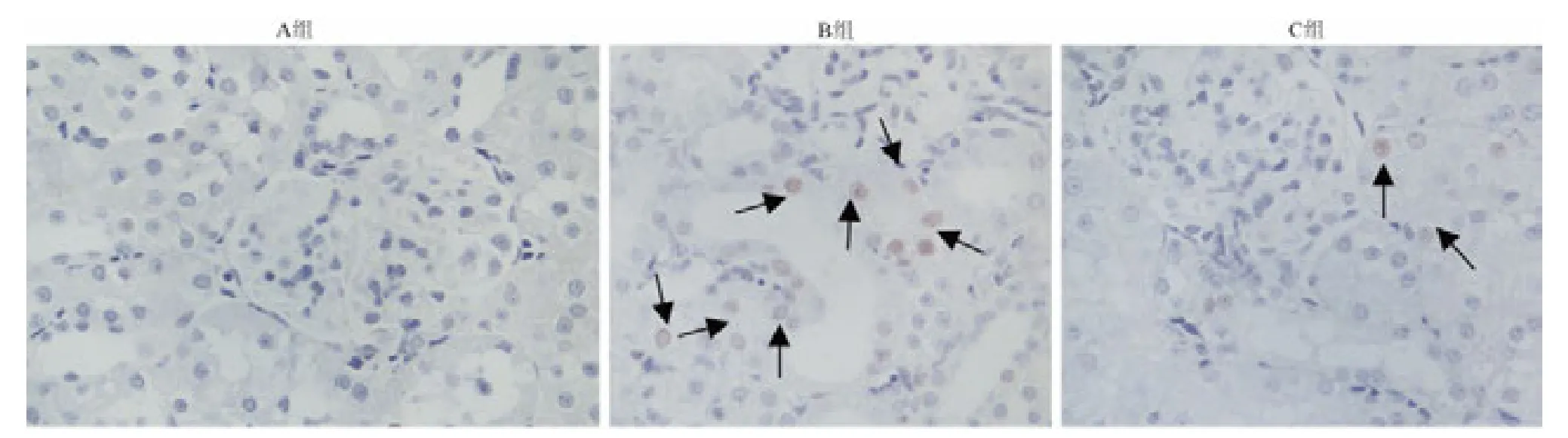
图2 TUNEL 检测各组大鼠造模后48 h 肾细胞凋亡情况(如箭头所示)×400
在正常情况下,氧化应激处于动态平衡状态,当遭遇外界刺激后,氧化作用超过还原作用,导致细胞损伤。目前认为,CIN 时氧自由基生成增多,存在氧化应激反应。氧自由基的产生途径包括黄嘌呤氧化酶途径和细胞色素氧化酶途径,对比剂可通过改变肾血流动力学使肾内渗透压增高,同时引起肾实质缺血缺氧,激活黄嘌呤氧化酶引起腺苷分解,导致活性氧的产生;另外,对比剂可通过降低肾皮质中过氧化氢酶和SOD 的活性而导致活性氧的生成增加[8]。有研究发现,应用对比剂后,活性氧产生增加,可导致和增强脂质过氧化和细胞毒性损伤,表明氧化损伤是CIN 的主要发病机制之一[9]。注射对比剂后,起的大鼠肾毒性起预防保护作用[17]。这些研究均 表明羟苯磺酸钙可作为一种自由基清除剂,具有强产生的氧自由基还可与一氧化氮生成过氧亚硝酸盐,后者更具氧化性,并且可降低一氧化氮的生物利用度,产生更严重的组织损伤[4]。MDA 是脂质氧化应激的产物,是反映氧化应激状态的经典标志物,且能够间接反映氧自由基的生成量;清除体内氧自由基的主要系统是抗氧化酶系统,SOD 及GSH-Px 是该系统重要的两个因子,SOD 能够将超氧阴离子歧化为过氧化氢,GSH-Px 可以清除过氧化氢及脂质过氧化产物[5,10]。本实验通过检测CIN 大鼠模型中以上3 个因子的表达情况,观察到B 组与A 组大鼠相比,MDA 显著升高,SOD 和GSH-Px 显著降低,进一步证实了氧化应激与CIN 的发生密切相关。
细胞凋亡,又称细胞程序性死亡,是指细胞为维持内环境稳定,由基因控制的、有一系列酶参与的一个主动的、高度有序的死亡过程,是为更好地适应生存环境而主动死亡的过程。有研究发现,对比剂对肾小管具有直接毒性,肾小管上皮细胞的过度凋亡与CIN 发病机制有关[3]。本实验发现,与A 组相比,B 组大鼠肾细胞凋亡明显,细胞凋亡指数显著升高,说明细胞凋亡可能参与CIN 的发病机制。
羟苯磺酸钙是一种可以改善微循环的药物,依靠其对内皮素-1(ET-1)、缓激肽等血管活性物质的影响及显著的抗氧化作用,广泛应用于糖尿病视网膜病变和慢性静脉功能不全的治疗[11-13],也有其在氧化应激水平改善冠状动脉旁路移植术患者缺血/再灌注损伤的研究[14]。近年来,国内外较多研究发现,羟苯磺酸钙对肾疾病也具有肯定的保护作用。多项研究表明,羟苯磺酸钙可通过保护血管内皮、抑制肾纤维化、减少纤溶酶原激活抑制因子-1(PAI-1)等机制改善糖尿病肾病[15-16]。另有文献报道显示,羟苯磺酸钙还可以通过减少氧化应激对庆大霉素引大的抗氧化作用。
本实验通过研究羟苯磺酸钙对CIN 大鼠生化、肾病理、氧化应激、细胞凋亡等相关指标的影响,探讨羟苯磺酸钙对CIN 的干预效果。通过HE 染色及TUNEL 染色观察到肾损伤以肾小管最为显著,说明对比剂主要损伤部位为肾小管上皮细胞。造模大鼠血清中MDA 表达增加,SOD 及GSH-Px 表达显著下降,说明氧化应激可能参与CIN 的发生发展,与以往实验结果一致[3-4]。B 组细胞凋亡显著,表明细胞凋亡亦可能参与CIN 的发生发展。此外,C 组肾病理改变及细胞凋亡较B 组显著减轻,且MDA 含量较B 组显著降低,SOD 及GSH-Px 含量较B 组显著升高,SOD 升高较GSH-Px 明显,但尚未达到正常状态。以上实验结果表明,羟苯磺酸钙能够保护CIN大鼠的肾功能,可能机制为羟苯磺酸钙通过增强SOD 及GSH-Px 的表达增强抗氧化系统,反应性减少MDA 表达,减少氧自由基生成,加快自由基清除,从而对抗氧化应激损伤;另外,羟苯磺酸钙可能通过减少细胞凋亡发挥对CIN 模型大鼠的保护作用。
综上所述,氧化应激和细胞凋亡可能参与CIN的发生发展,且该过程主要发生在肾小管上皮细胞。羟苯磺酸钙可能是通过减轻CIN 大鼠氧化应激和细胞凋亡发挥肾保护作用。关于氧化应激和细胞凋亡介导CIN 发生发展的具体机制及羟苯磺酸钙发挥肾保护作用的具体途径有待进一步研究。
[1]Mohammed NM,Mahfouz A,Achkar K,et al. Contrast-induced Nephropathy. Heart Views,2013,14:106-116.
[2]Golshahi J, Nasri H, Gharipour M. Contrast-induced nephropathy;A literature review. J Nephropathol,2014,3:51-56.
[3]Buyuklu M,Kandemir FM,Ozkaraca M,et al. Protective effect of curcumin against contrast induced nephropathy in rat kidney:what is happening to oxidative stress,inflammation,autophagy and apoptosis?Eur Rev Med Pharmacol Sci,2014,18:461-470.
[4]Ari E,Kedrah AE,Alahdab Y, et al. Antioxidant and renoprotective effects of paricalcitol on experimental contrastinduced nephropathy model. Br J Radiol,2012,85:1038-1043.
[5]Kongkham S,Sriwong S,Tasanarong A. Protective effect of alpha tocopherol on contrast-induced nephropathy in rats. Nefrologia,2013,33:116-123.
[6]Wu CT,Weng TI,Chen LP,et al. Involvement of caspase-12-dependent apoptotic pathway in ionic radiocontrast urografininduced renal tubular cell injury. Toxicol Appl Pharmacol,2013,266:167-175.
[7]谢泉琨,刘晓城. 羟苯磺酸钙对2 型糖尿病模型大鼠肾脏氧化应激的影响. 中国药房,2004,15:721-723.
[8]唐露,魏日胞,耿文佳,等. 对比剂肾病发病机制及干预措施的研究进展.中华临床医师杂志(电子版),2013,7:3062-3064.
[9]Heyman SN,Rosen S,Khamaisi M,et al. Reactive oxygen species and the pathogenesis of radiocontrast-induced nephropathy.Investig Radiol,2010,45:188-195.
[10]Zhu SY,Dong Y,Tu J,et al. Silybum marianum oil attenuates oxidative stress and ameliorates mitochondrial dysfunction in mice treated with D-galactose. Pharmacogn Mag,2014,10(Suppl 1):S92-S99.
[11]Garay RP,Hannaert P,Chiavaroli C. Calcium dobesilate in the treatment of diabetic retinopathy.Treat Endocrinol,2005,4:221-232.
[12]Javadzadeh A,Ghorbanihaghjo A,Adl FH,et al. Calcium dobesilate reduces endothelin-1 and high-sensitivity C-reactive protein serum levels in patients with diabetic retinopathy. Mol Vis,2013,19:62-68.
[13]Alda O,Valero MS,Pereboom D,et al. In vitro effect of calcium dobesilate on oxidative/inflammatory stress in human varicose veins. Phlebology,2011,26:332-337.
[14]Cerrahoglu M,Taner Kurdal A,Iskesen I,et al. Calcium dobesilate reduces oxidative stress in cardiac surgery. J Cardiovasc Surg (Torino),2009,50:695-701.
[15]高美娟,刘明,李波,等. 羟苯磺酸钙对早期糖尿病肾病大鼠肾脏的保护作用. 药学学报,2009,44:126-133.
[16]Zhang X. Therapeutic effects of calcium dobesilate on diabetic nephropathy mediated through reduction of expression of PAI-1.Exp Ther Med,2013,5:295-299.
[17]Jafarey M,Changizi Ashtiyani S,Najafi H. Calcium dobesilate for prevention of gentamicin-induced nephrotoxicity in rats. Iran J Kidney Dis,2014,8:46-52.

