植入起搏器的心房颤动患者导管消融术后的临床分析
杨汪洋 李松南 金达 刘念 白融 杜昕 董建增 马长生
心房颤动(房颤)是临床中较为常见的心律失常类型之一,可使痴呆和死亡风险增加2 倍、心力衰竭风险增加3 倍、卒中风险增加5 倍,显著降低患者生活质量[1]。有研究表明,起搏器术后房颤的年发生率超过5%,平均累积发生率高达30% ~40%,显著高于未植入起搏器患者[2-3]。目前,导管消融在房颤治疗中发挥着越来越重要的作用,特别是症状非常明显的患者可作为主要治疗方法[4]。然而,对于植入起搏器的房颤患者导管消融术后远期窦性心律维持情况尚缺乏临床研究,对于不同类型房颤患者植入起搏器状态对远期窦性心律维持率的影响是否有所不同亦尚无定论。本研究旨在针对植入起搏器的不同类型房颤患者(阵发性房颤、持续性房颤)导管消融术后远期窦性心律维持情况进行临床分析并探讨其可能影响因素。
1 对象与方法
1.1 研究对象
连续选取2008 年1 月至2014 年10 月在北京安贞医院房颤中心首次接受导管消融治疗的房颤合并永久起搏器植入患者65 例(38 例阵发性房颤,27例持续性房颤)作为起搏器+房颤组。并从同期在本中心因房颤首次接受导管消融术治疗的非起搏器状态患者中,按照1∶4进行性别、年龄、房颤类型匹配选取260 例患者作为房颤组。起搏器+房颤组患者中9 例植入单腔起搏器,56 例植入双腔起搏器,其起搏器适应证主要为病窦综合征(33 例)、房室传导阻滞(23 例)、房颤合并慢心室率(8 例)和病窦综合征合并房室传导阻滞(1 例)。入选标准:明确诊断为房颤(房颤发作时心电图记录,阵发性房颤持续时间<7 d,可自行终止;持续性房颤持续时间>7 d,需要药物或电击才能转复为窦性心律),首次接受导管消融治疗,无结构性心脏病,无严重心力衰竭等其他重症疾病。
1.2 电生理检查及导管消融
电生理检查和导管消融均于清醒状态下行局麻,采用芬太尼和咪达唑仑镇痛。术前24 h 行经食管超声和(或)心房64 排CT 排除左心房血栓。常规采用双侧股静脉入径,穿刺左侧股静脉放置标测电极于冠状窦内,沿右侧股静脉穿刺房间隔并将8 F 长鞘(SL1,美国St. Jude 公司)和3.5 mm 冷盐水灌注消融导管(Navistar ThemocoolTM,美国Biosense Webster 公司)置入左心房,在CARTO 系统引导下进行左心房三维解剖重建。随后行双侧环肺静脉前庭消融并达到肺静脉隔离,消融温度和功率分别设置为45℃和35 W,冷生理盐水流速17 ml/min。根据术前心电图特点及术中诱发结果决定是否进一步线性消融。如完成上述消融后房颤仍持续,则行体外直流电复律(200 J)。手术终点为环状电极证实肺静脉电隔离。
1.3 术后随访与处理
所有患者术前停用除胺碘酮以外的抗心律失常药物至少5 个半衰期。如无禁忌,术后常规应用一种抗心律失常药物(口服胺碘酮、普罗帕酮或索他洛尔)2 个月,2 个月后如无心律失常发作,心律失常药物可不作为常规用药。所有患者术后口服华法林抗凝至少3 个月,并定期检测凝血功能,调整剂量维持国际标准化比值(INR)在2.0 ~3.0,如若3 个月后明确为房颤复发,建议CHA2DS2-VASC 评分超过1 分且无抗凝禁忌证的患者继续口服华法林抗凝。术后窦性心律维持情况由经过专业培训的工作人员通过门诊或电话随访进行记录,随访内容主要包括术后第3、6、12 个月及以后每6 个月行标准12导联心电图和24 h 动态心电图等检查,如患者出现心悸等症状则随时于当地医院行标准心电图检查,记录有无房颤复发。房颤复发定义为经导管消融术3 个月后,发作持续时间超过30 s 的症状性或标准12 导联心电图或24 h 动态心电图记录到的心房颤动、心房扑动或房性心动过速等房性心律失常[5]。
1.4 统计学分析
所有数据采用SPSS 22.0 软件进行统计学分析。正态分布的计量资料以 珋±s 表示,两组比较采用t 检验;非正态分布的计量资料以M(Q1,Q3)表示,两组比较采用非参数检验(Kruskal-Wallis 秩和检验);计数资料以例数(百分比)表示,两组比较采用卡方检验或Fisher 精确概率检验。将单因素分析中P <0.1 的变量进一步行Logistic 多因素分析并得出复发独立预测因素。术后随访窦性心律维持率的比较采用Kaplan-Meier 分析和Log-rank 检验。以双侧P <0.05 为差异有统计学意义。
2 结果
2.1 患者基线资料比较
两组患者年龄,性别,阵发性房颤、糖尿病、高血压病、心功能不全、冠心病史、术前普罗帕酮、β 阻滞剂、他汀类药物使用率,左心房前后径,左心室舒张末期内径(LVEDd),左心室收缩末期内径(LVESd),左心室射血分数(LVEF),高敏C 反应蛋白(hs-CRP),三酰甘油(TG),总胆固醇(TC),高密度脂蛋白胆固醇(HDL-C),低密度脂蛋白胆固醇(LDL-C)等比较,差异无统计学意义(P >0.05);而房颤病程[72.0(36.0,126.0)月比36.0(12.0,84.0)月,P =0.000]、术前胺碘酮服用率(58.5%比43.8%,P =0.035)、术前索他洛尔服用率(12.3%比3.8%,P =0.018)等起搏器+房颤组患者高于房颤组,差异有统计学意义;而房颤组患者体质量指数(BMI)[(25.8 ±3.3)kg/m2比(24.7±2.8)kg/m2,P =0.014]高于起搏器+房颤组,差异有统计学意义(表1)。
2.2 电生理检查及导管消融情况
两组患者均为首次接受房颤导管消融治疗,肺静脉隔离率比较(95.4%比96.9%,P =0.818),差异无统计学意义(表1)。65 例起搏器+房颤组患者在接受导管消融术过程中及术后均未见起搏器功能不良情况。房颤组有1 例患者术中发生心脏压塞,及时抢救后病情平稳,其余患者均未发生严重手术并发症。
2.3 远期窦性心律维持率比较
两组患者共325 例,平均随访(36.6 ±20.3)个月。起搏器+房颤组65 例中38 例(58.5%)复发房颤,房颤组260 例中122 例(46.9%)复发房颤,采用Kaplan-Meier 分析发现,起搏器+房颤组与房颤组比较,差异有统计学意义(P =0.042)。为研究植入起搏器对不同类型房颤患者远期预后的影响是否不同,进一步按照房颤类型分组进行分析。
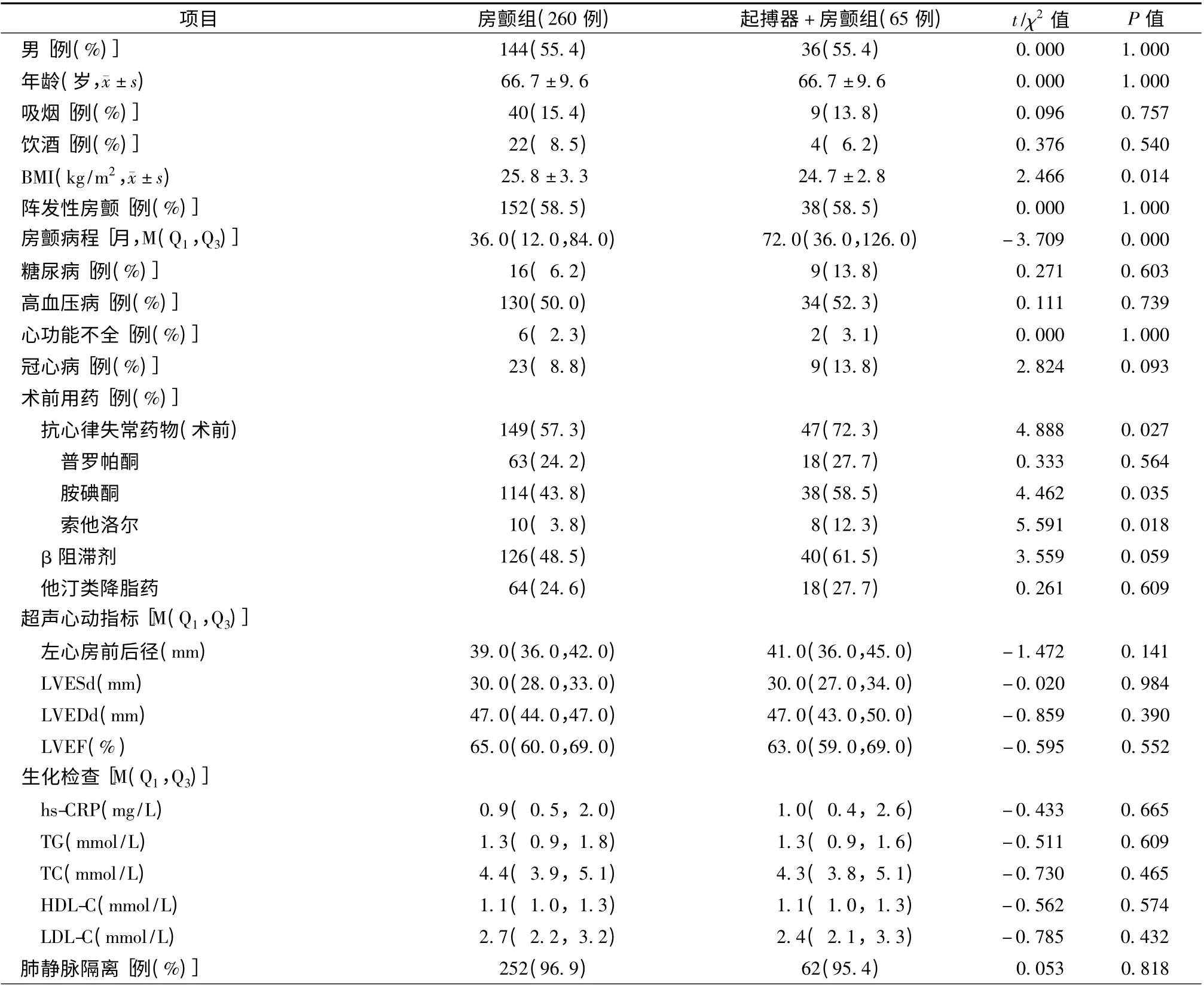
表1 两组患者的基线资料比较
阵发性房颤患者共190 例(表2),82 例(43.2%,82/190)复发房颤,其中起搏器+房颤组患者复发23 例(60.5%,23/38),房颤组患者复发59 例(38.8%,59/152)。采用Kaplan-Meier 分析,按照是否植入起搏器分组,对两组患者无房颤生存率进行比较发现,两组患者差异有统计学意义(P =0.005,图1)。单因素分析显示,对阵发性房颤患者而言,复发患者与维持窦性心律患者在植入起搏器(28.0% 比13.9%,P = 0.016)、男性(42.7% 比60.2%,P = 0.017)、左心房前后径[38.5(35.0,42.0)mm 比36.0(34.0,39.0)mm,P =0.009]等方面比较,差异有统计学意义(表2)。将单因素分析中P <0.1 的变量及年龄和肺静脉隔离情况进一步行Logistic 多因素分析,共纳入性别、年龄、植入起搏器、房颤病程、左心房前后径、肺静脉隔离情况、高血压病史这几个因素,发现植入起搏器(HR 2.186,95%CI 1.020 ~4.684,P=0.044)、男性(HR 0.467,95%CI 0.254 ~0.858,P =0.014)、左心房前后径(HR 1.084,95%CI 1.021 ~1.151,P =0.008)为房颤复发的独立预测因素(表3)。进一步分析比较阵发性房颤基线资料发现,女性与男性相比,吸烟率(0比16.0%,P <0.001)、饮酒率(0 比7.0%,P =0.011)、TG[1.4 (1.0,1.9)mmol/L 比1.1 (0.8,1.7)mmol/L,P=0.035]、TC[(4.7 ±1.0)mmol/L 比(4.3 ± 0.7)mmol/L,P <0.001]、HDL-C[(1.3 ±0.3)mmol/L比(1.1±0.3)mmol/L,P <0.001]、LVEF[67.0(62.0,71.0)% 比64.0(60.0,69.5)%,P =0.007]、LVEDd[45.0(42.0,48.0)mm 比49.0(45.3,52.0)mm,P <0.001]、LVESd[38.0(26.0,31.0)mm比31.0(28.0,34.0)mm,P <0.001]、hs-CRP[1.2(0.6,3.5)mg/L 比0.9(0.5,1.8)mg/L,P =0.011]、术前他汀类药物使用率[27.8% 比16.0%,P =0.049]等方面差异有统计学意义,其余各项差异均无统计学意义(P >0.05,表4)。
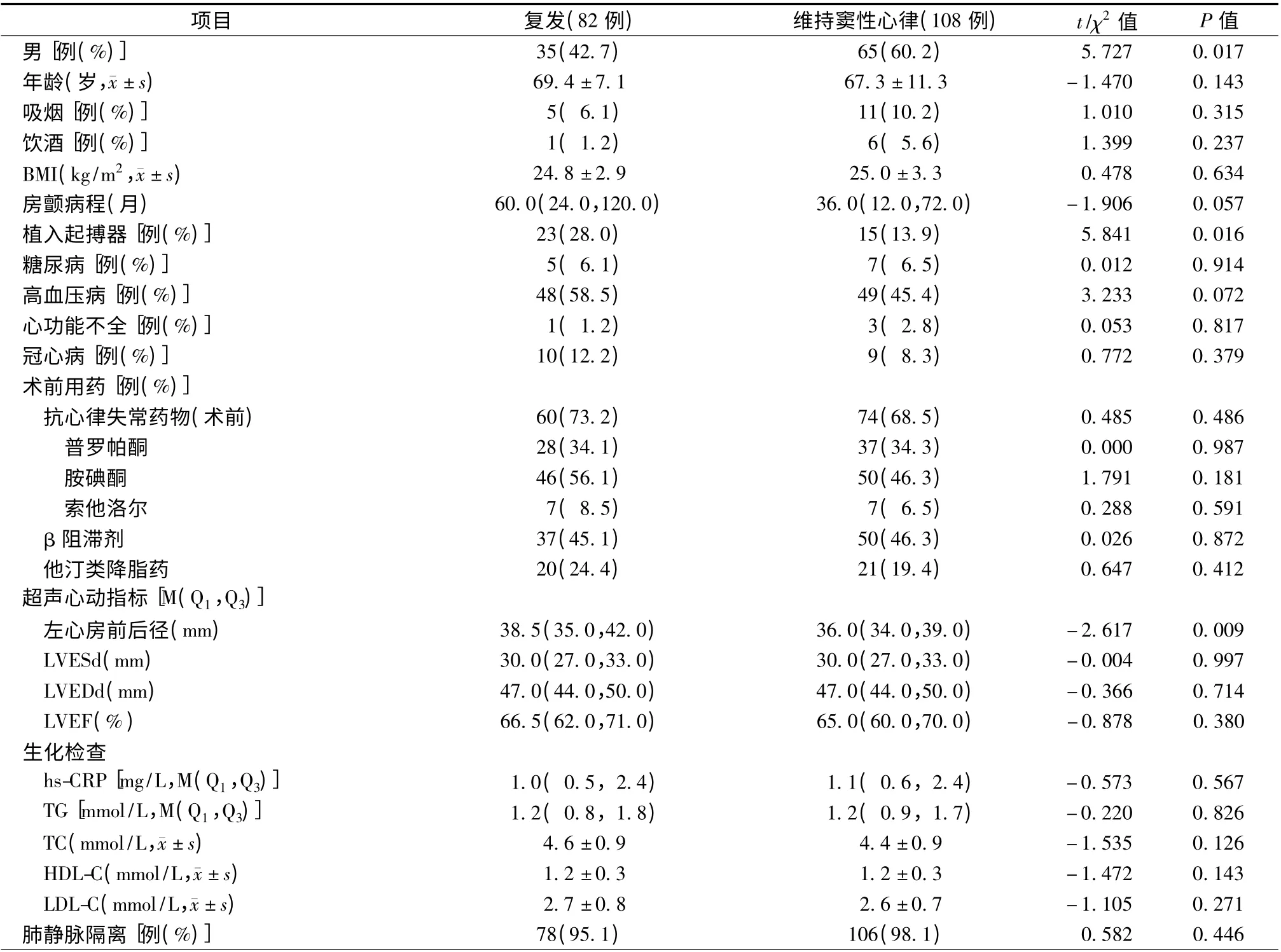
表2 阵发性房颤患者的随访结果
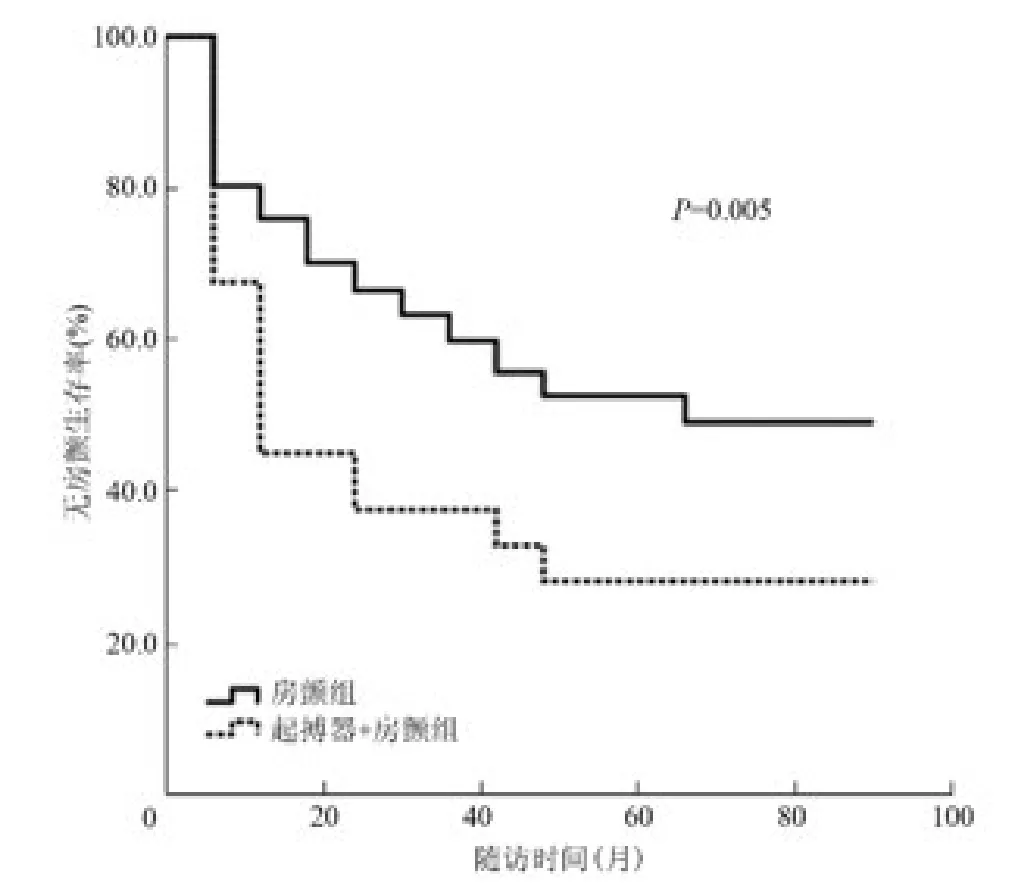
图1 阵发性房颤两组患者无房颤生存率Kaplan-Meier 生存曲线
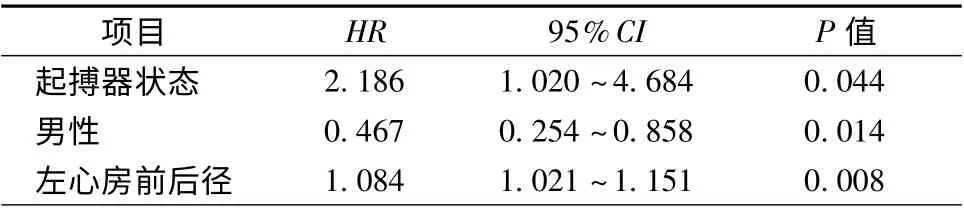
表3 阵发性房颤患者复发危险因素的Logistic 回归分析
持续性房颤患者共135 例(表5),78 例(57.8%,78/135)患者复发房颤,其中起搏器+房颤组患者复发15 例(55.6%,15/27),房颤组患者复发63 例(58.3%,63/108)。采用Kaplan-Meier 分析,按照是否植入起搏器分组,对两组患者无房颤生存率进行比较发现,两组患者差异无统计学意义(P =0.925,图2)。单因素分析显示,对于持续性房颤患者而言,复发患者与维持窦性心律患者仅在左心房前后径方面差异有统计学意义(P=0.014,表5)。
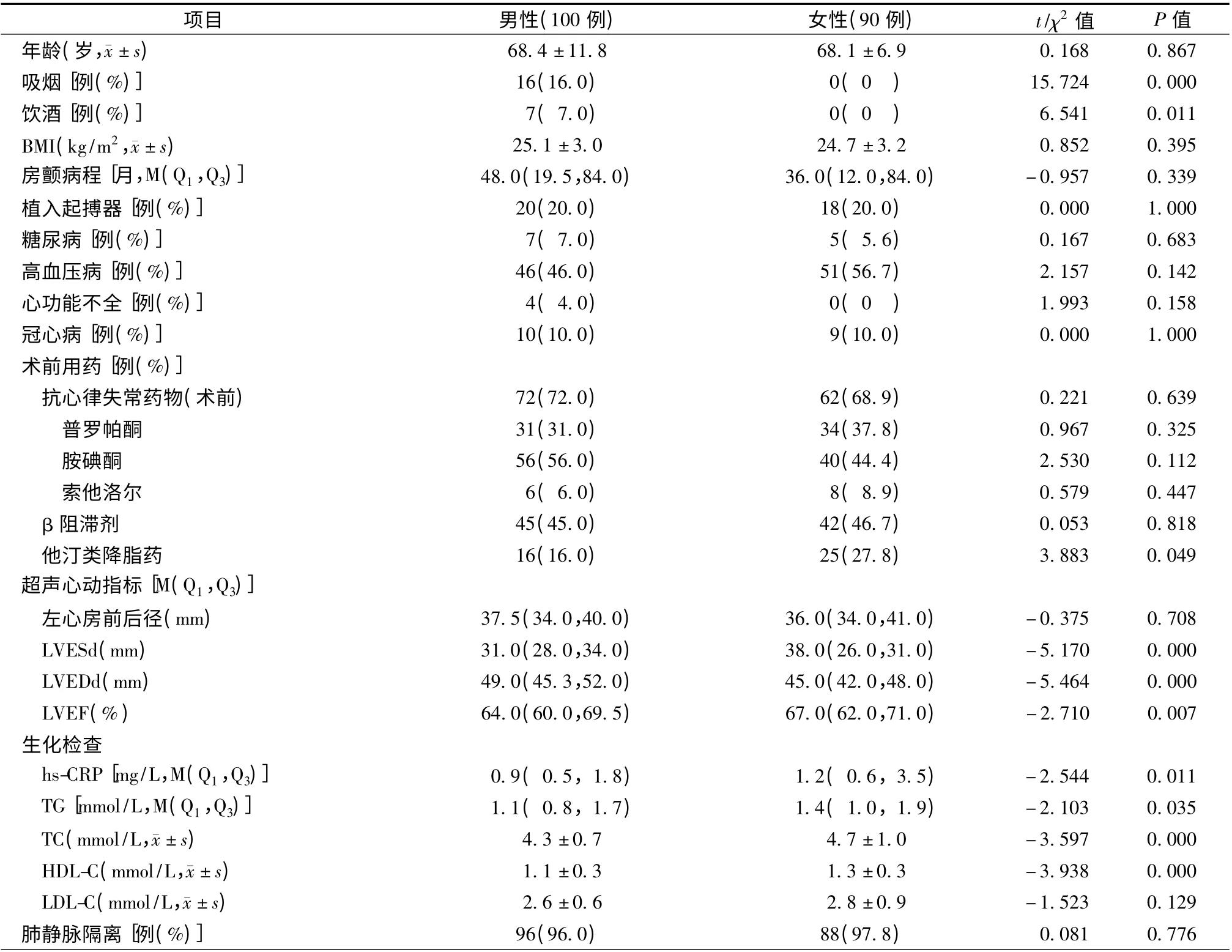
表4 阵发性房颤男性与女性患者的基线特征比较
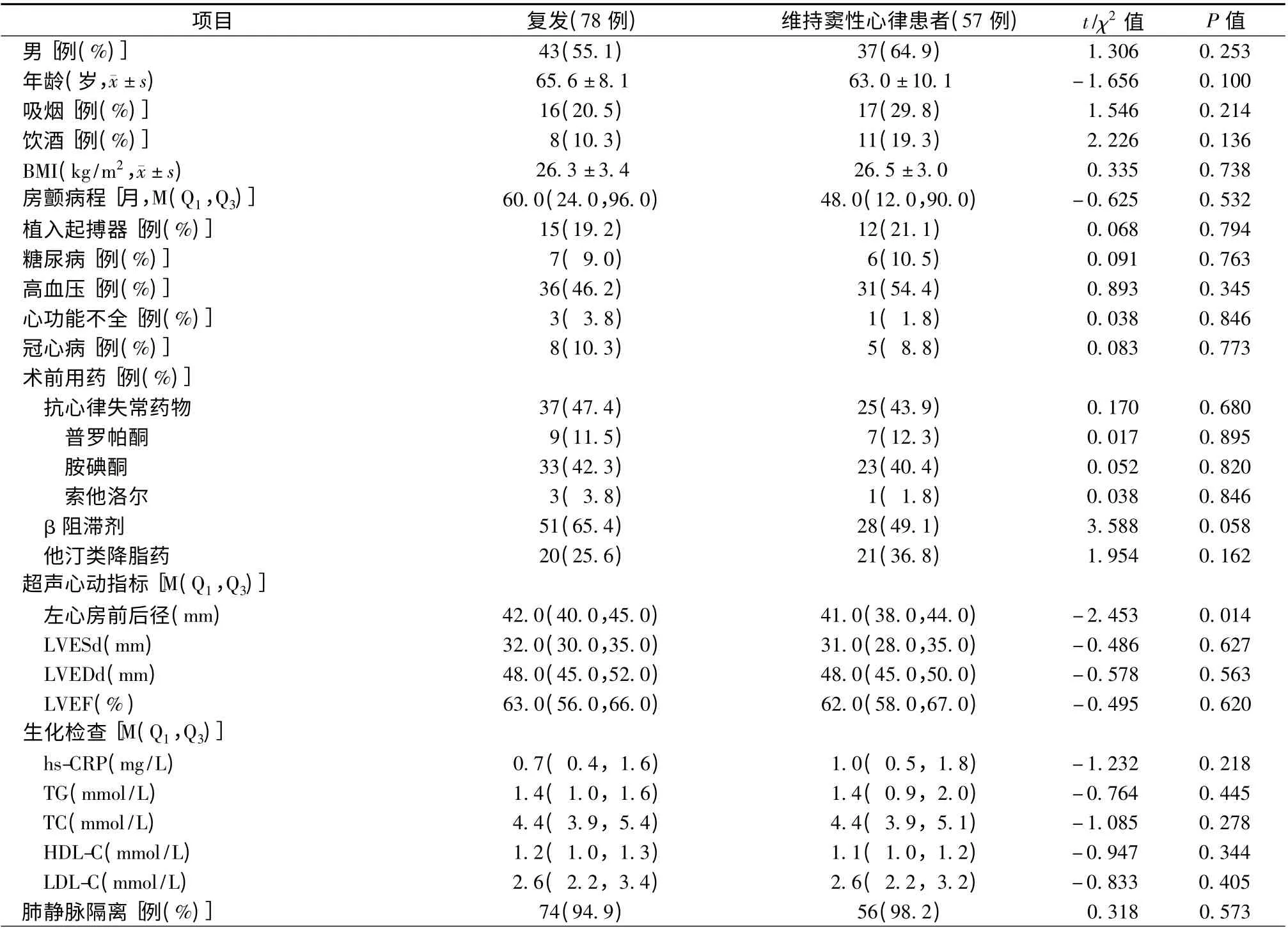
表5 持续性房颤患者的随访结果
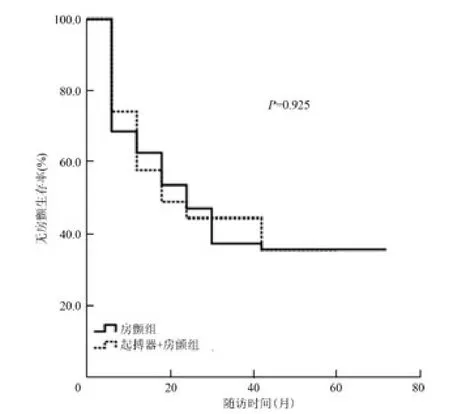
图2 持续性房颤两组患者无房颤生存率Kaplan-Meier 生存曲线
3 讨论
与既往研究相比,本研究根据房颤类型进行分组讨论,分别讨论植入起搏器对不同类型房颤导管消融术后远期窦性心律维持率的影响。研究分析发现,阵发性房颤患者消融术后复发与性别、左心房前后径、植入起搏器有关。大量研究已证实,左心房前后径对房颤导管消融术后复发有影响[6-7]。多数植入起搏器的患者为病窦综合征、房室传导阻滞,房颤的发生与心房及传导系统退行性改变有关,即有起搏器适应证的患者本身发生房颤的风险较高。此外,有研究表明植入起搏器增加房颤发病风险[2-3]。植入起搏器改变了心脏原有电激动模式,导致血流动力学发生改变,长时间还可造成心脏电重构和结构重构,促使房颤启动和持续[8-13]。且右心室心尖部起搏被证实可引起内皮功能障碍,而内皮功能障碍也被认为是房颤导管消融术后复发的预测因素之一[14-16]。对于接受永久起搏器治疗的房颤患者,导管消融术后由起搏器造成的房颤发病风险并未改变。因此,不难接受植入起搏器的阵发性房颤患者导管消融术后远期窦性心律维持率较低这一结果。本研究分析比较阵发性房颤男性和女性患者基线资料,发现男性与女性患者在很多方面存在统计学差异,然而其临床意义不明,因而性别对阵发性房颤患者导管消融术后远期窦性心律维持率的影响尚有待进一步研究证实。
本研究统计分析发现,对持续性房颤患者,起搏器+房颤组导管消融术后远期窦性心律维持率与非起搏器状态房颤患者差异无统计学意义,这表明植入起搏器的持续性房颤患者接受导管消融术治疗效果良好。但本研究中持续性房颤患者平均左心房前后径为(41.9 ±4.7)mm,明显超出正常范围19 ~35 mm(P <0.001)且显著大于阵发性房颤患者(37.6 ±5.4)mm(P <0.001)。本研究中仅有27 例为持续性房颤合并植入起搏器患者,样本量较小,可能掩盖植入起搏器对持续性房颤患者经导管消融术后远期窦性心律维持率的影响。
通过对本研究325 例患者的随访及对远期窦性心律维持率的结果分析发现,对阵发性房颤患者,起搏器+房颤组导管消融术后远期窦性心律维持率低于房颤组;对持续性房颤患者,起搏器+房颤组导管消融术后远期窦性心律维持率与非起搏器状态房颤患者差异无统计学意义;影响导管消融术后复发房颤的因素对于不同类型房颤患者而言有所差异,阵发性房颤患者导管消融术后复发与性别、左心房前后径、植入起搏器有关,持续性房颤患者消融术后复发仅与左心房前后径相关。
本研究尚存在很多不足:(1)本研究中起搏器+房颤组患者共65 例,均为导管消融术前植入起搏器,其起搏器适应证各异,多数患者为病窦综合征、房室传导阻滞,而本研究未将其原发病纳入统计分析。然而,从伦理角度考虑,很难寻找具有起搏器适应证却未安装起搏器的患者作为对照组。(2)起搏模式及起搏部位不同对房颤发作或有不同影响[17-18]。本研究中起搏器+房颤组患者共65 例,样本量较小,未将起搏模式及起搏部位纳入统计分析。(3)本研究在术后6 个月后多为电话随访,对无症状房颤检出较差。
本研究结果表明,导管消融术对植入起搏器的房颤患者是安全有效的,而不同类型房颤消融效果受起搏器影响不同,植入起搏器的持续性房颤患者术后远期窦性心律维持率或与非起搏器状态患者无异,而植入起搏器的阵发性房颤患者远期预后则较非起搏器状态患者差。
[1]Wann LS,Curtis AB,January CT,et al. 2011 ACCF/AHA/HRS Focused update on the management of patients with atrial fibrillation (updating the 2006 guideline):a report of the Amerian College of Cardiology Foundation/Amerian Heart Associantion Task Force on Practice Guidelines. Circulation,2011,123:104-123.
[2]Nielsen JC.Mortality and incidence of atrial fibrillation in paced patients. J Cardiovasc Electrophysiol,2002,13:S17-S22.
[3]Gillis AM,Morck M. Atrial fibrillation after DDDR pacemaker implantation. J Cardiovasc Electrophysiol,2002,13:542-547.
[4]Brignole M,Auricchio A,Baron-Esquivias G,et al. 2013 ESC Guidelines on cardiac pacing and cardiac resynchronization therapy.The Task Force on cardiac pacing and resynchronization therapy of the European Society of Cardiology (ESC). Developed in collaboration with the European Heart Rhythm Association(EHRA). Eur Heart J,2013,34:2281-2329.
[5]Camm AJ,Lip GY,De Caterina R,et al. 2012 focused update of the ESC Guidelines for the management of atrial fibrillation:an update of the 2010 ESC Guidelines for the management of atrial fibrillation. Developed with the special contribution of the European Heart Rhythm Association. Eur Heart J,2012,33:2719-2747.
[6]Montserrat S,Gabrielli L, Bijnens B, et al. Left atrial deformation predicts success of first and second percutaneous atrial fibrillation ablation. Heart Rhythm,2015,12:11-18.
[7]Lo LW,LinYJ,Tsao HM,et al.The impact of left atrial size on long-term outcome of catheter ablation of chronic atrial fibrillation. J Cardiovasc Electrophysiol,2009,20:1211-1216.
[8]Nielsen JC,Thomsen PE,Hjberg S,et al. A comparison of single-lead atrial pacing with dual-chamber pacing in sick sinus syndrome. Eur Heart J,2011,32:686-696.
[9]Vaturi M,Kusniec J,Shapira Y,et al. Right ventricular pacing increases tricuspid regurgitation grade regardless of the mechanical interference to the valve by the electrode. Eur J Echocardiogr,2010,11:550-553.
[10]Klutstein M,Balkin J,Butnaru A,et al. Tricuspid incompetence following permanent pacemaker implantation. Pacing Clin Electrophysiol,2009,32 Suppl 1:S135-S137.
[11]Akutsu Y,Kaneko K,Kodama Y,et al. Association between left and right atrial remodeling with atrial fibrillation recurrence after pulmonary vein catheter ablation in patients with paroxysmal atrial fibrillation:a pilot study. Circ Cardiovasc Imaging,2011,4:524-531.
[12]樊晓寒,姚焰. 起搏器术后心房颤动现状分析. 中国循环杂志,2014,29:852-854.
[13]陈英伟,董建增,马长生.阵发性心房颤动合并长R-R 间期导管消融和起搏治疗的对比. 中国介入心脏病学杂志,22:477-482.
[14]Fak AS,Ozben B,Toprak A,et al. The acute effect of cardiac pacing mode on endothelial vasodilation:prospective,doubleblind,cross-over, comparative clinical study. Pacing Clin Electrophysiol,2008,31:327-332.
[15]Krishnamoorthy S,Khoo CW,Lim HS,et al. Predictive value of atrial high-rate episodes for arterial stiffness and endothelial dysfunction in dual-chamber pacemaker patients. Eur J Clin Invest,2014,44:13-21.
[16]Shin SY,Na JO,Lim HE,et al. Improved endothelial function in patients with atrial fibrillation through maintenance of sinus rhythm by successful catheter ablation. J Cardiovasc Electrophysiol,2011,22:376-382.
[17]Stambler BS,Ellenbogen KA,Orav EJ,et al. Predictors and clinical impact of atrial fibrillation after pacemaker implantation in elderly patients treated with dual chamber versus ventricular pacing. Pacing Clin Electrophysiol,2003,26:2000-2007.
[18]Toff WD,Camm AJ,Skehan JD,et al. Single-chamber versus dual chamber pacing for high-grade atrioventricular block. N Engl J Med,2005,353:145-155.

