带孔房间隔缺损封堵器治疗房间隔缺损合并重度肺动脉高压的疗效观察
陈火元 朱鲜阳 盛晓棠 张端珍 王琦光 韩秀敏 崔春生 庚靖淞
房间隔缺损(atrial septal defect,ASD)是成人最常见的左向右分流型先天性心脏病,由于长期左向右分流,大部分患者逐渐出现症状,如劳累性呼吸困难、房性心律失常或右心衰竭,预期寿命也较正常人缩短[1]。通常在儿童期需闭合ASD,即使在老年人中行ASD 封堵,总预期寿命也会得到改善[2]。但随着年龄增长,部分患者合并重度肺动脉高压(pulmonary arterial hypertension,PAH),右心室增大,左心室顺应性降低,采用不完全封堵ASD 可能比完全封堵有更大的优势[3-4]。本文观察17 例ASD合并重度PAH 患者采用带孔房间隔缺损封堵器(atrial septal occluders,ASO)介入治疗近中期及远期的疗效,旨在为此类患者的治疗提供参考。
1 对象与方法
1.1 研究对象
选取沈阳军区总医院2002 年9 月至2013 年4 月收治的17 例ASD 合并重度PAH 患者,其中男1 例,女16 例,年龄18 ~72(41.8 ±13.9)岁。ASD病理分型均为继发孔中央型、单一缺损,经胸超声心动图(transthoracic echocardiography,TTE)/经食管超声心动图(transesophageal echocardiography,TEE)测量ASD 最大直径18 ~33(26.5 ±4.2)mm,TTE 估测肺动脉收缩压(pulmonary arterial systolic pressure,sPAP)80 ~112(96.9 ± 8.9)mmHg(1 mmHg =0.133 kPa)。术前心电图不完全性右束支传导阻滞5 例(2 例合并右心室肥厚),右心室肥厚11 例,心房颤动合并右心室肥厚1 例。
1.2 方法
1.2.1 常规检查 患者术前行各项常规检查,包括血常规、血生化、凝血功能、12 导联心电图、X 线胸片、TTE/TEE、股动脉血气分析等。
1.2.2 介入治疗过程 术前告知可能使用带孔ASO 的治疗方法,患者及家属签署手术知情同意书。麻醉后穿刺股静脉,年龄≥50 岁患者同时穿刺桡动脉或股动脉行冠状动脉造影排除冠状动脉病变,之后经股静脉行右心导管检查,计算肺循环血流量/体循环血流量(Qp/Qs)及肺血管阻力(pulmonary vascular resistance,PVR)。当Qp/Qs≥1.5、sPAP≥60 mmHg,则行封堵术。封堵后再次穿刺股静脉,重复右心导管检查,如肺动脉压下降不明显(<20%)或sPAP≥60 mmHg,则采用带孔ASO封堵,见图1。2007 年之前患者封堵后采用吸入纯氧气15 ~20 min,监测肺动脉压力变化;2007 年之后则采用腺苷或吸入伊洛前列素行急性肺血管扩张试验。
图1 房间隔缺损封堵器,其上做6 ~8 mm 小孔。植入封堵器后可阻断房间隔水平大量左向右分流,若肺动脉压力下降不理想或左心不能承受体循环压力,血流通过此孔形成分流来减轻心室超负荷,起到缓冲作用
1.3 术后处理及随访
所有患者术后监护24 h,给予低剂量多巴胺或多巴酚丁胺、呋塞米及米力农静脉泵入,吸氧或给予伊洛前列素雾化吸入2 ~3 d。其中窦性心律患者口服阿司匹林3~5 mg/(kg·d),硫酸氢氯吡格雷片75 mg/d;心房颤动患者给予华法林抗凝,维持INR 在2.0左右。同时,口服一种降PAH 的靶向药物:波生坦125 mg/次、每日2次(首月半量),或西地那非20 mg/次、每日3 次,或他达那非5 mg/次、每日1 次。术后4 ~6 d 出院。术后3 d 和3、6 个月行心电图、TTE 检查,利用TTE估测sPAP、右心室舒张末期内径(right ventricular end diastolic diameter,RVEDd)、左心室舒张末期内径(left ventricular end diastolic diameter,LVEDd)、左心室舒张末期容积(left ventricular end-diastolic volume,LVEDV)、左心室收缩末期容积(left ventricular end-systolic volume,LVESV)和左心室射血分数(left ventricular ejection fraction,LVEF)。封堵术后随访时间为1.5 ~12(6.4 ±2.7)年。
1.4 统计学分析
统计分析采用SPSS 13.0 软件。数据以均数±标准差(珋±s)表示,采用t 检验。以P <0.05 为差异有统计学意义。
2 结果
2.1 封堵前右心导管检查结果
全部患者封堵前行右心导管检查,测得sPAP 60 ~108(88.7 ±11.7)mmHg,平均肺动脉压(mean pulmonary arterial pressure,mPAP)29.3 ~60(51.0 ±8.1)mmHg,Qp/Qs 1.50 ~2.44(1.8 ±0.31),PVR 3.1 ~9.7(5.6 ±1.5)wood,见表1。
2.2 封堵后即刻结果
采用带孔ASO 封堵后,右心导管检查测得sPAP 56 ~99(70 ± 11.5)mmHg,mPAP 27 ~51.7(41.1 ±7.1)mmHg,较术前均有显著下降(均P <0.05),见表1。12 例患者急性肺血管反应试验为阴性。
17 例患者均成功置入带孔ASO,所用ASO 直径为30 ~42(35.6 ±4.6)mm,术中无心脏压塞、血栓栓塞事件及急性肺动脉高压危象发生。1 例患者术后1 h 由导管室回病房后出现急性左心衰竭症状,胸闷、呼吸困难、咯血,加大静脉泵入多巴胺的剂量,联合静脉泵入多巴酚丁胺及米力农,并雾化吸入伊洛前列素,1 d 后病情稳定;其他患者封堵后在药物辅助下未出现急性左心功能不全的表现。
2.3 封堵后近期结果
术后3 d 和3、6 个月采用TTE 观察,所有患者封堵器位置正常,带孔ASO 孔中可见左向右分流,未出现栓塞、心脏压塞及封堵器脱落等不良事件。术后3 d RVEDd 缩小,LVEDd、LVEDV 及LVEF 均增大(P <0.05);术后3 ~6 个月,RVEDd 继续缩小,LVEDd、LVEDV 均进一步增大,患者心脏形态及功能持续得到改善,见表2。术后3、6 个月的sPAP分别为50 ~78 (61.6 ± 7.5)mmHg 和46 ~68(55.9 ±5.7)mmHg,较术前均有显著下降(均P <0.05),见表1。
2.4 封堵后中、远期结果
平均随访(6.4 ±2.7)年,均未出现血栓栓塞事件。患者的RVEDd、LVEDd、LVEDV、LVESV 与术后6 个月时比较无明显改变。TTE 估测sPAP 为45 ~100(60. 2 ±13. 3)mmHg,较封堵前显著下降(P <0.05),但与术后6 个月比较,差异无统计学意义(P >0.05),见表1。随访中ASO 小孔均有减小趋势,3 例完全闭合。5 例术后1 年自行停用靶向药物治疗。1 例术后2 年心电图出现心房扑动,给予华法林抗凝及胺碘酮控制心室率,维持稳定。1 例术后2 年重复右心导管检查,肺动脉压完全正常(但TTE 估测sPAP 58 mmHg)。1 例术后1 年重复右心导管检查,肺动脉压再次升高至术前水平,与TTE 估测sPAP 相近。
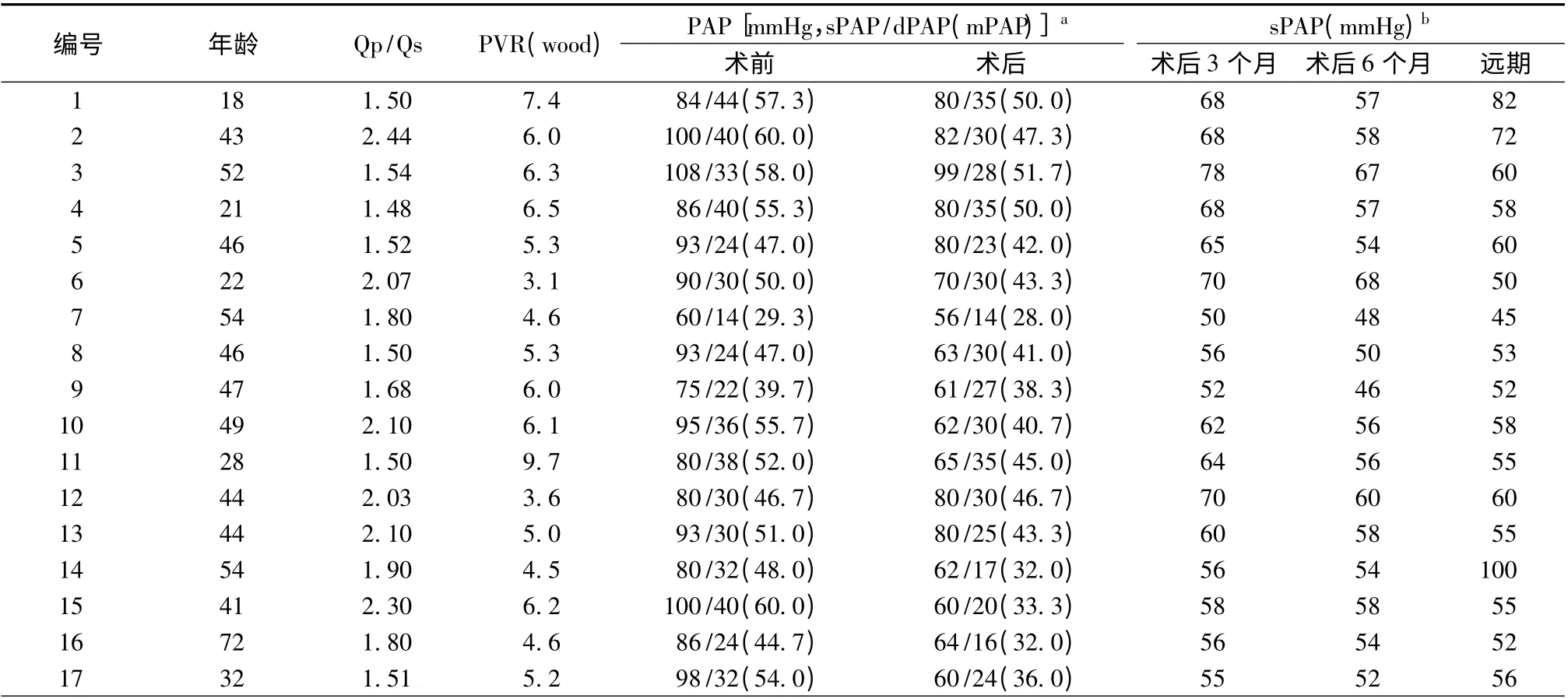
表1 17 例患者检查结果及随访资料

表2 17 例患者封堵前、后心室内径与射血分数的变化
3 讨论
ASD 与室间隔缺损及动脉导管未闭不同,发生PAH 的概率更小,儿童期PAH 的发生率约为2.2%[5]。多数患者青春期后出现活动后心悸气短,PAH 体征或者发绀、心力衰竭等症状,提示ASD发展到较严重的阶段,若不及时闭合缺损,患者寿命通常低于正常人,预期寿命40 ~50 岁,从出现症状到死亡时间为1 ~19 年,平均8 年[6]。根据2010 年欧洲心脏病协会(ESC)成人先天性心脏病治疗指南[7]中的推荐,ASD 手术指征为房间隔水平存在显著分流,右心室容量负荷过重与肺血管阻力<5 wood 时,应行介入封堵治疗,推荐等级为Ⅰ/B;当肺血管阻力≥5 wood、<2/3 体循环阻力或肺动脉压<2/3 体循环血压及以左向右分流为主时,可行介入治疗,推荐等级为Ⅱb/C;合并艾森曼格综合征时不宜行ASD 封堵术(Ⅲ/C)。标准的治疗方法是心房间水平左向右分流量Qp/Qs >1.5 表明分流量较大,应阻断分流,而当sPAP≥60 mmHg,肺血管阻力≥5 wood 则表示肺动脉压重度增高,直接闭合缺损危险较大,患者容易出现肺高压危象、心力衰竭等。因此,临床上此类患者的处理较为棘手。目前,带孔ASO 在ASD 介入治疗中的适应证尚未明确。有文献报道左心功能受限的ASD 患者,为预防ASD 完全封堵后出现急性左心功能不全而采用带孔ASO 封堵[8-9]。老年患者左心功能受限比年轻患者常见,封堵前左心房平均压超过10 mmHg 时建议使用带孔ASO 封堵[9]。本组中有1 例年轻患者(LVEDd 为32 mm)术后出现急性左心衰竭,发生原因考虑为封堵后左心室容量负荷突然增加,左心室舒张末期压力迅速升高,肺毛细血管压随之升高使血管内液体渗入到肺间质和肺泡内形成急性肺水肿。因此,对左心室小、舒张功能受限的年轻患者也应引起重视,术中应全程监测左心室舒张末期压力变化。ASD 合并重度PAH,右心室承受压力和容量双重负荷,右心室扩张导致室间隔向左偏移,引起左心室形态及顺应性的改变。本研究组认为,采用带孔ASO 介入治疗,主要目的是减少左向右的分流量而降低右心室容量负荷,通过房间隔少量左向右的分流,减轻左心系统短时间的容量负荷,保护左心室功能,使长期受限制的左心功能得到逐步改善。部分ASD 合并重度PAH 患者本身可能存在特发性PAH,封堵后肺动脉压下降不明显,随着时间推移,PAH 可能会逐渐升高,此时残留小孔可通过右向左分流延缓右心衰竭的发生[10],这与特发性PAH 患者采用房间隔造口的治疗方法类似。本组患者房间隔水平左向右分流量Qp/Qs 为1.50 ~2.44(1.8 ±0.31),均属于大分流。而测得sPAP 60 ~108
(88.7 ± 11.7)mmHg,mPAP 29.3 ~60 (51.0 ±8.1)mmHg,PVR 3.1 ~9.7(5.6 ±1.5)wood,为重度PAH。采用带孔ASO 进行封堵,可以最大限度阻断其左向右的分流,降低右心室容量负荷,同时使肺动脉压不同程度下降而减轻右心室的压力负荷,双重负荷的减少对这类患者左、右心室功能的改善有积极作用。目前对ASD 合并重度PAH 患者是否存在特发性PAH 尚无明确的诊断方法,但是对ASD 偏小而PAH 严重的患者不建议手术干预,此类患者更倾向将其归为特发性PAH[11],应给予靶向药物治疗。
本组患者随访中发现,使用带孔ASO 封堵后,左向右分流量的大部分被阻断,使右心室容量负荷减轻,扩张的右心室缩小,而左心室则逐渐增大,患者心功能有不同程度改善。术后3 d RVEDd 缩小,LVEDd、LVEDV 增大,与左向右分流量的减少有关,而术后3 ~6 个月随访,左、右心室形态及功能持续改善,可能与肺动脉压持续降低使左、右心室进一步优化有关,但长期随访未见心室形态及功能的进一步改善,推测ASD 合并重度PAH 术后心功能的改善主要发生在术后6 个月内,另外也可能与部分患者停用靶向药物致肺动脉压增高有关。本组患者近期随访肺动脉压均有不同程度下降,但中远期随访结果有差异,持续口服靶向药物的患者,超声心动图随访肺动脉压未见升高,与术后6 个月肺动脉压持平,而停用靶向药物患者肺动脉压则出现再次升高。因此,合并PAH 患者行封堵治疗后,应继续给予靶向药物治疗,这与相关报道结论一致[12-13]。ASD 封堵术后早期症状改善并不代表长期预后良好,特别是年龄≥55 岁患者,更应该注意封堵后效果。对已经存在PAH 者更应该密切随访观察。本组中编号16 的72 岁患者术后2 年随访肺动脉压未见升高,可能与患者一直口服靶向药物波生坦有关。
ASD 合并重度PAH 采用带孔ASO 封堵后,抗栓仍是值得关注的问题。合并心房颤动患者持续口服华法林已没有争议,但对窦性心律患者该如何抗栓,使用双联(阿司匹林联合氯吡格雷)抗血小板还是华法林抗凝,使用多长时间,目前没有相关医学证据。本组窦性心律者仍是给予双联抗血小板治疗,术后出现心房颤动或心房扑动则改为华法林抗凝,在随访过程中,未出现血栓栓塞事件。双联抗血小板虽然未引起ASO 血栓事件,但是对PAH 的治疗可能并不是最优化方法。此类患者封堵后仍残存PAH,给予华法林抗凝,针对原位血栓,并防止肺动脉血栓的形成可能更为有益。另外,ASO 上所留小孔直径选择多大也是需要关注的问题,有研究显示,在老年ASD 合并PAH 中,初始ASO 孔径为8 mm,以后减少到6 mm,最后为5 mm,均显示有效[3]。孔径太大,左向右分流没有得到有效阻止,右心房和右心室继续增大,会导致右心衰竭的发生。如孔径太小,封堵后残存PAH 者小孔闭合的可能性较大。有研究报道,平均血小板体积(MPV)水平与右心室内径及sPAP 均呈显著正相关,MPV 水平高,血小板激活增加血栓形成,易引起ASO 小孔完全闭合[14]。本组患者近中期随访ASO 小孔完全通畅,在长期随访过程中,孔径有减小的趋势,其中编号1、3、11 的患者随访过程中封堵器小孔完全闭合。综合考虑,此类患者术后长期给予华法林抗凝治疗应更为合适,除非患者肺动脉压降至正常。
综上所述,ASD 合并重度PAH 采用带孔的ASO介入治疗是安全、有效的。主要适用于缺损较大,Qp/Qs≥1.50,sPAP≥60 mmHg,PVR≥3.0 wood,完全封堵后肺动脉压下降不明显,LVEDd≤35 mm 者。治疗目的在于减少房间隔分流量,降低右心室容量与压力负荷,改善左心室功能,延长患者寿命,改善生存质量。因此,术前必须全面评估病情,封堵后仍需积极给予降PAH 的靶向药物治疗,坚持对此类患者术后长期随访,进一步积累经验。
[1]Webb G,Gatzoulis M. Atrial septal defects in the adult:Recent progress and overview. Circulation,2006,114:1645-1653.
[2]Konstantinides S,Geibel A,Olschewski M,et al. A comparison of surgical and medical therapy for atrial septal defect in adults.N Engl J Med,1995,333:469-473.
[3]Bruch L,Winkelmann A, Sonntag S, et al. Fenestrated occluders for treatment of ASD in elderly patients with pulmonary hypertension and/or right heart failure. J Interv Cardiol,2008,21:44-49.
[4]中国医师协会心血管内科医师分会,朱鲜阳,张端珍,等.2015 年先天性心脏病相关性肺动脉高压诊治中国专家共识.中国介入心脏病学杂志,2015,23:61-69.
[5]Goetschmann S,DiBernardo S,Steinmann H,et al. Frequency of severe pulmonary hypertension complicating "isolated" atrial septal defect in fancy. Am J Cardiol,2008,102:340-342.
[6]Vogel M,Berger F,Kramer A,et al. Incidence of secondary pulmonary hypertension in audlts with atrial septal or sinus venosus defects. Heart,1999,82:30-33.
[7]Baumgartner H,Bonhoeffer P,De Groot NM,et al. ESC Guidelines for the management of grown-up congenital heart disease (new version 2010). Eur Heart J,2010,31:2915-2957.
[8]Peters B,Ewert P,Schubert S,et al. Self-fabricated fenestrated Amplatzer occluders for transcatheter closure of atrial septal defect in patients with left ventricular restriction:midterm results. Clin Res Cardiol,2006,95:88-92.
[9]Holzer R,Cao QL,Hijazi ZM. Closure of a moderately large atrial septal defect with a self-fabricated fenestrated Amplatzer septal occluder in an 85-year-old patient with reduced diastolic elasticity of the left ventricle. Catheter Cardiovasc Interv,2005,64:513-518.
[10]Rozkovec A,Montanes P,Oakley CM. Factors that influence the outcome of primary pulmonary hypertension. Br Heart J,1986,55:449-458.
[11]Galiè N,Hoeper MM,Humbert M,et al. Guidelines for the diagnosis and treatment of pulmonary hypertension. Eur Respire J,2009,34:1219-1263.
[12]Fujino T,Yao A,Hatano M,et al. Targeted therapy is required for management of pulmonary arterial hypertension after defect closure in adult patients with atrial septal defect and associated pulmonary arterial hypertension. Int Heart J,2015,56:86-93.
[13]周红梅,尚小珂,Liang Zhong,等. 儿童腺样体肥大致肺动脉高压二例并右心导管检查分析. 中国介入心脏病学杂志,2014,22:738-740.
[14]Kaya MG,Elcik D,Akpek M,et al. Mean platelet volume levels predict pulmonary artery hypertension in patients with atrial septal defect. Acta Cardiol,2014,69:161-166.

