注射用氟尿嘧啶对晚期胃癌患者亚甲基四氢叶酸还原酶、谷胱甘肽硫转移酶及肿瘤标志物的影响
陈庭富,严琦敏
(1.中国人民解放军第63870部队医院 消化内科,陕西 华阴 714200;2.中国人民解放军第323部队医院内科,陕西 西安 710000)
注射用氟尿嘧啶对晚期胃癌患者亚甲基四氢叶酸还原酶、谷胱甘肽硫转移酶及肿瘤标志物的影响
陈庭富1,严琦敏2
(1.中国人民解放军第63870部队医院 消化内科,陕西 华阴 714200;2.中国人民解放军第323部队医院内科,陕西 西安 710000)
目的 探讨注射用氟尿嘧啶对晚期胃癌患者亚甲基四氢叶酸还原酶(methylene tetrahydrofolate reductase,MTHFR),谷胱甘肽硫转移酶(glutathione S-transferase,GST)及肿瘤标志物的影响。方法 选取中国人民解放军第63870部队医院2013年8月~2014年8月确诊为晚期胃癌的患者48例,根据随机数字表法随机分为2组:对照组(n=24)予卡培他滨为基础的化疗方案;实验组(n=24)予注射用氟尿嘧啶为基础的化疗方案。观察2组患者血清中MTHFR浓度、GST水平及患者肿瘤标志物(糖类抗原199、癌胚抗原、甲胎蛋白)水平,进而对注射用氟尿嘧啶的疗效机制进行分析。结果 与对照组相比,实验组患者血清中亚甲基四氢叶酸还原酶浓度较高(P<0.05),谷胱甘肽硫转移酶活性较低(P<0.05),肿瘤标志物水平降低(P<0.05),临床症状改善的总有效率较高[16(66.67)vs.22(91.67),χ2=4.55,P<0.05],不良反应发生率较低[14(58.33)vs.6(25.00),χ2=5.49,P<0.05]。结论 注射用氟尿嘧啶化疗方案能够升高血清中MTHFR浓度,降低GST活性,临床疗效明显、不良反应少、对治疗晚期胃癌具有重要意义。
注射用氟尿嘧啶;晚期胃癌;亚甲基四氢叶酸还原酶;谷胱甘肽硫转移酶;肿瘤标志物
胃癌的发生是一个由多因素参与的复杂过程,与生活环境、饮食、幽门螺旋杆菌感染等密切相关。胃黏膜上皮细胞的增殖和凋亡保持动态平衡,这种平衡一旦被破坏,胃黏膜上皮细胞就会过度增殖但又无法启动凋亡,久而久之便会进展为胃癌[1]。氟尿嘧啶属于5-FU的衍生物,是尿嘧啶的氟化类似物5-FU 是一种抗代谢药物,它对很多实体肿瘤有较好活性。5-FU 抗肿瘤活性是通过干扰DNA 合成和mRNA 翻译来实现的[2],其进入人体后可选择性地在肿瘤组织激活,具有靶向性的治疗作用,5-氟尿嘧啶(5-FU)是治疗胃癌的基础药物。有研究证实[3],以氟尿嘧啶为基础药物治疗晚期胃癌时,疗效较好,不良反应也较少。
有研究表明[4],亚甲基四氢叶酸还原酶(methylene tetrahydrofolate reductase,MTHFR)及谷胱甘肽硫转移酶(glutathione S transferase,GST)与晚期胃癌患者的肿瘤标志物密切相关。临床上根据肿瘤标志物是否下降可以评判当时治疗方法是否有效[5],病灶被控制时肿瘤标志物下降至正常或维持在较低水平,肿瘤标志物短暂下降后又上升代表病情进展。目前关于注射用氟尿嘧啶治疗晚期胃癌患者对MTHFR、GST及肿瘤标志物影响的相关研究较少。本文通过观察注射用氟尿嘧啶治疗晚期胃癌患者对MTHFR、GST及肿瘤标志物的影响,探究注射用氟尿嘧啶治疗晚期胃癌的机制。
1 资料与方法
1.1 一般资料 收集中国人民解放军第63870部队医院2013年8月~2014年8月确诊为晚期胃癌的患者48例,按照随机数字法将患者随机分为实验组和对照组。实验组24例,年龄40~75岁,平均年龄(62.25±7.54)岁,男性11例,女性13例;病程1~5年,平均(3.16±0.59)年。对照组24例,年龄40~75岁,平均年龄(63.06±7.72)岁,男性11例,女性13例;病程1~5年,平均(3.23±0.62)年。本实验获得患者知情同意,并得到本院伦理委员会批准,批准日期为2013年7月26日。纳入标准:①诊断根据胃肠道癌前病变和癌的WHO诊断新标准关于晚期胃癌的诊断标准[6]:具有上腹疼痛、食少纳差、体质量减轻等临床症状,并经内镜检查加活检证实为胃癌晚期;②年龄在45~70岁之间;③治疗前1个月内未进行系统的化疗治疗;④愿意接受以氟尿嘧啶为基础的化疗方案治疗;⑤生存时间预计在3个月以上。排除标准:①伴有严重的肝功能、肾功能不全;②患者或家属拒绝参与本实验;③伴有心衰、严重高血压、呼吸衰竭及血液系统疾病等严重的原发疾病;④伴有精神疾病,无法配合的患者;⑤年龄小于40岁或大于75岁;⑥伴有严重的急慢性感染。
1.2 治疗方法 对照组患者以卡培他滨为基础的化疗方案进行治疗,具体方案如下:卡培他滨(上海罗氏制药有限公司,国药准字H20073024,生产批号:20120515)1250 mg/m2,每天2次口服(早晚各1次,日总剂量为2500 mg/m2),治疗2周后停药1周,3周为1个疗程。联用多西紫杉醇(湖北华源世纪药业有限公司,国药准字H20083578,生产批号:20080616)75 g/m2,加入5%葡萄糖注射液500 mL,在每个疗程第1天静脉滴注1 h,每3周进行重复治疗。实验组以注射用氟尿嘧啶为基础的化疗方案进行治疗,具体方案如下:注射用氟尿嘧啶(海南长安国际制药有限公司,国药准字H20050981,生产批号:20100817)0.5 g/d,每天1次,溶于250 mL 0.9%氯化钠注射液中静点,治疗2周后停药1周,3周为1个疗程。联用多西紫杉醇使用方法同对照组,服药期间,患者每个疗程结束后复查1次,共跟踪随访1年。服药期间详细记录服药过程中出现的任何不良反应。2组晚期胃癌患者均在治疗前、3个疗程治疗结束后空腹采集5 mL肘静脉血,装入预先装有EDTA的抗凝采血管中。将采血管按3000 r/min离心10 min,待离心结束后将上层血清装入EP管中,放入-80 ℃冰箱中保存备用。以上均由本院检验科专业人员负责操作。
1.3 观察指标及检测方法
1.3.1 血清中亚甲基四氢叶酸还原酶浓度的测定:本研究采用双抗体夹心法检测所有研究对象血清中亚甲基四氢叶酸还原酶的浓度水平。首先用人亚甲基四氢叶酸还原酶抗体免疫实验微孔板,再分次向微孔中加入亚甲基四氢叶酸还原酶,与辣根过氧化物酶(HRP)标记的白介素抗体结合,形成抗体-抗原-酶标抗体复合物,最后加底物3′,3′,5,5′-四甲基联苯胺(TMB)显色。显色后,TMB在HRP酶的催化下发生连续的颜色转化,最后变为黄色。由于颜色深浅与标本血清中的白介素浓度呈正比例关系,用伯乐680全自动酶标仪(北京泰泽瑞达科技有限公司)测定标本的吸光度(OD值),最终通过绘制标准曲线可精确计算标品中的亚甲基四氢叶酸还原酶浓度。具体操作步骤参照试剂盒(上海经科化学科技有限公司)说明书进行。
1.3.2 血清中谷胱甘肽硫转移酶活性的测定:参照有关文献[7]的实验方法,所有试剂均购于上海经科化学科技有限公司。聚体步骤如下:依次向容器中加入250 μL磷酸盐缓冲液,25 μL谷胱甘肽硫转移酶,适量的酶溶液及25 μL 1-氯-2,4-二硝基苯试剂,最终混合为500 μL的液体,反应从加入1-氯-2,4-二硝基苯试剂开始,在NanoDrop Lite分光光度计(赛默飞世尔科技)30 ℃保温10 min,记录340 nm波长下谷胱甘肽硫转移酶与1-氯-2,4-二硝基苯结合物的生成量。在30 ℃条件下,应用1 mM谷胱甘肽硫转移酶和1-氯-2,4-二硝基苯每分钟催化形成1 μM S-2,4-二硝基苯谷胱甘肽为1个酶活性单位。
1.3.3 血清肿瘤标志物的测定:本研究采用双抗体夹心酶联免疫吸附(ELISA)法检测所有研究对象血清中肿瘤标志物糖类抗原199(CA199)、癌胚抗原(carcino-embryonic antigen,CEA)、甲胎蛋白肿瘤标志指标的浓度水平(试剂盒由武汉博士的生物技术有限公司提供),其操作方法按照说明书严格操作。以上所有操作均由本院检验科专业人员负责操作。
1.3.4 临床疗效及不良反应的观察:疗效判定标准:显效:入组前的病灶最大径总和缩小≥60%以上,上腹疼痛明显减轻,体力状况评分明显升高;有效:入组前的病灶最大径总和缩小≥30%,上腹疼痛有所缓解,体力状况评分升高;无效:入组前的病灶最大径总和未见明显缩小或增大,体力状况评分无变化或降低。总有效率=(显效例数+有效例数)/总例数×100%。详细记录患者服药期间出现的任何不良反应,并及时予以对症治疗。体力状况评分标准是由ECOG(美国东部肿瘤协作组)Karnofsky(卡氏评分,KPS)提出,并依据患者能否正常活动、病情、生活自理程度,KPS把患者的健康状况视为总分100分,10分为1个等级[8]。

2 结果
2.1 2组患者血清中亚甲基四氢叶酸还原酶和谷胱甘肽硫转移酶的比较 本研究显示,治疗前2组患者血清中MTHFR和GST的水平相比较,差异无统计学意义,基线可比。治疗后2组患者血清中MTHFR浓度水平均比治疗前升高(P<0.05),实验组患者血清中MTHFR的浓度高于对照组(P<0.05)。治疗后2组患者血清中GST活性均比治疗前降低(P<0.05),且实验组患者血清中GST的活性低于对照组(P<0.05)。见表1。
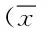
表1 2组患者血清中亚甲基四氢叶酸还原酶和谷胱甘肽硫转移酶的比较±s)Tab.1 Comparison of MTHFR and GST between two ±s)
*P<0.05,与同组治疗前比较,compared with the same group before treatment;#P<0.05,与对照组治疗后比较,compared with control group after treatment
2.2 2组患者肿瘤标志物水平比较 治疗前2组患者肿瘤标志物水平无明显差异。经治疗后,2组肿瘤标志物水平均降低(P<0.05),与对照组相比,实验组CA199、CEA与AFP水平较低(P<0.05)。见表2。
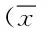
表2 2组患者肿瘤标志物水平比较±s)Tab.2 Comparison of tumor marker between two groups ±s)
*P<0.05,与同组治疗前比较,compared with the same group before treatment;#P<0.05,与对照组治疗后比较,compared with control group after treatment
2.3 2组患者临床疗效的比较 本研究结果显示,经过3个疗程的治疗后,实验组患者的总有效率为91.67%,对照组患者的总有效率为66.67%,实验组总有效率明显高于对照组(χ2=4.55,P<0.05)。见表3。

表3 2组患者临床疗效的比较[n(%)]Tab.3 Comparison of clinic effect between two groups[n(%)]
#P<0.05,与对照组比较,compared with control group
2.4 2组患者不良反应发生率的比较 本研究显示,对照组有14例患者出现不良反应,其中腹泻2例,胃胀3例,恶心4例,手足综合征2例,脊髓抑制1例,其他2例;实验组有6例患者出现不良反应,其中腹泻3例,胃胀2例,恶心1例;对照组不良反应发生率58.33%显著高于实验组的25.00%(χ2=5.49,P<0.05)。
3 讨论
近年来,胃癌在我国的发病率呈上升趋势,对人们的身体健康和生活质量造成严重的危害。研究证实[9],化疗是改善晚期胃癌患者生活质量、延长其生存时间的有效措施。目前,世界范围内尚无关于晚期胃癌化疗的标准方案。卡培他滨是5- 氟尿嘧啶的前体药物,口服后完整地通过胃肠壁,首先经肝脏羧酸酯酶催化代谢为5’-脱氧-5- 氟胞苷,然后经肝脏和肿瘤细胞中的胞苷脱氨酶催化转化为5’-脱氧-氟尿嘧啶,最后经胸苷磷酸化酶催化转化为5- 氟尿嘧啶。而5- 氟尿嘧啶则直接通过不同的生化途径产生单磷酸氟脱氧尿苷、三磷酸氟脱氧尿苷和三磷酸氟尿苷分别干扰细胞DNA 及RNA 复制合成,产生细胞毒效应,与5,10-亚甲基四氢叶酸(5,10-MTHF)和胸苷酸合成酶反应,形成稳定的共价化合物,干扰肿瘤细胞DNA的合成与修复,从而抗癌[10]。亚甲基四氢叶酸还原酶是一种还原酶,主要作用是在叶酸代谢通路中将5,10-MTHF转化为具有生物学功能的5-MTHF,参与广泛的DNA甲基化反应。谷胱甘肽S-转移酶(GSTs)是在肝脏中参与生物转化第二相反应的一种生物酶。谷胱甘肽(GSH)在肝细胞液GST 催化下,可与许多卤代化合物和环氧化合物结合,生成含GSH 的结合产物。GSTs 与毒物包括致癌物代谢解毒有关[11]。有研究表明[12],谷胱甘肽硫转移酶减少,抗癌药物的降解时间将延长,可能增加抗癌药物化疗的作用时间及敏感性。
本研究结果发现,经化疗后,2组患者血清中MTHFR浓度水平均比治疗前升高,实验组患者血清中MTHFR的浓度高于对照组(P<0.05);化疗后2组患者血清中GST活性均比治疗前降低,且实验组患者血清中GST的活性低于对照组(P<0.05)。四氢叶酸还原酶是叶酸代谢过程中的关键酶,将 5,10-亚甲基四氢叶酸(5,10-methylene tetrahydrofolate,5,10-MTHF)转变成 5-甲基四氢叶酸(5-methyltetrahydrophplate,5-MTHF),前者与DNA合成及修复过程密切相关,可影响5-FU类药物代谢,后者为细胞内 DNA 甲基化反应提供原料,即参与蛋氨酸(methionine,Met)循环和各种基因 DNA 的甲基化[13]。MTHFR主要催化5,10-MTHF还原为具有生物学功能的5-MTHF,参与广泛的DNA甲基化反应。如果MTHFR浓度较低,DNA甲基化过低,便会导致癌基因的高表达和修复基因的低表达,促进肿瘤的发生[14]。经化疗后,2组患者血清中MTHFR浓度升高(P<0.05),促进DNA甲基化,抑制癌基因的表达,促进修复基因的表达,从而延缓胃癌的进展。与对照组比较,实验组患者血清中MTHFR浓度升高明显(P<0.05),由此可见,实验组的治疗效果优于对照组。谷胱甘肽硫转移酶能够催化使某些内源性或外来有害物质亲电子基团的疏水性增加,从而加快分解排出体外。经化疗后,2组患者血清中GST活性均降低(P<0.05),抗癌物质在体内排出时间延长,从而使作用时间延长。实验组患者血清中GST活性低于对照组(P<0.05),表明实验组治疗效果优于对照组。由此可见,以氟尿嘧啶为基础的化疗方案能后升高血清中MTHFR浓度,抑制癌基因表达,降低GST活性,延长化疗药的作用时间,对晚期胃癌患者的治疗具有重要的意义。
肿瘤标志物是恶性肿瘤在发生和增殖过程中,由肿瘤细胞的基因表达而合成分泌或是由机体对肿瘤反应异常而产生的,是反映肿瘤存在和生长的一类物质。在一定程度上能反映癌的发生发展,可以在肿瘤病变组织,血液和排泄物中检出。肿瘤标志物主要与肿瘤增殖和肿瘤细胞绝对数量直接相关,检测血清肿瘤标志物水平是临床评价肿瘤治疗效果和预后复发常用方法[15]。在临床研究中大部分血清肿瘤标志物水平变化和肿瘤治疗效果相关。在成功的治疗后,包括手术、化疗,肿瘤标志物即明显下降。一般认为化疗有效的病例,肿瘤标志物的浓度应该下降50%[16],至少应该降至正常参考值上限附近,既往所应用的肿瘤单一指标检测已经被证明特异性低、灵敏度差,因此国内外学者均主张多指标联合、动态检测。本研究结果表明,氟尿嘧啶能够明显降低晚期胃癌患者血清肿瘤标志物水平,提示临床疗效显著。
研究表明[17],以氟尿嘧啶为基础,联合多西紫杉醇的化疗方案可以有效改善晚期胃癌患者的临床症状,减少不良反应,但相关研究较少。本研究结果显示,经过3个疗程的治疗后,实验组患者的总有效率为91.67%,对照组患者的总有效率为70.83%,实验组总有效率明显高于对照组(P<0.05)。2组患者在治疗过程中均未出现严重的肝肾功能不全、出血等不良反应,2组患者出现的不良反应主要有腹泻、胃胀、恶心、手足综合征、脊髓抑制等,其中实验组出现腹泻、胃胀的不良反应低于对照组(P<0.05)。绝大部分不良反应经对症治疗后均可缓解。由此可见,以卡培他滨为基础的化疗方案治疗晚期胃癌有效率高,临床症状改善明显,不良反应少。
实验通过对48例晚期胃癌患者血清中的MTHFR、GST及肿瘤标志物等情况进行比较分析,证实了以卡培他滨为基础的化疗方案能够升高血清中MTHFR浓度,降低GST活性,降低肿瘤标志物水平,临床疗效明显、不良反应少。因此,以卡培他滨为基础的化疗方案对治疗晚期胃癌患者具有重要意义。在下一步研究中,本课题组将寻找新的信号分子和目的基因,为本实验所反映的现象做出进一步论证和分析。
[1] 惠起源,魏晓萍.幽门螺杆菌致胃癌机制的研究进展[J].中国肿瘤,2003,12(2):89-91.
[2] 袁吉,倪孟祥.5-氟尿嘧啶及其衍生物的研究进展[J].药物生物技术,2012,(5):462-465.
[3] 吴芳,陈述嫦,卢致辉,等.紫杉醇脂质体或紫杉醇联合5-氟尿嘧啶一线治疗晚期胃癌的临床疗效分析[J].中华肿瘤杂志,2010,32(3):234-236.
[4] 于国伟,梁会.胃癌遗传易感性基因的研究进展[J].世界华人消化杂志,2014,22(1): 53-58.
[5] 王英,黄文成,黄玲莎.血清肿瘤标志物联合检测在恶性肿瘤诊断中的临床应用[J].贵州医药,2004,12(2):145-146.
[6] 朱雄增.胃肠道癌前病变和癌的 WHO 诊断新标准[J].中华病理学杂志,2003,32(2): 168-169.
[7] 王奇,范灿鹏,陈锟慈,等.三种磺胺类药物对罗非鱼肝脏组织中谷胱甘肽转移酶 (GST) 和丙二醛 (MDA)的影响[J].生态环境学报,2010,19(5):1014-1019.
[8] Buccheri G,Ferrigno D,Tamburini M.Karnofsky and ECOG Performance Status Scoring in Lung Cancer: A Prospective, Longitudinal Study of 536 Patients From a Single Institution[J].Eur J Cancer,1996,32a(7):1135-1141.
[9] 曹妮达,赵爱光,朱莹杰,等.进展期胃癌化疗疗效的中国文献分析[J].世界华人消化杂志,2008,16(4):436-442.
[10] 宋卫峰,王雷,蔡讯,等.5-氟尿嘧啶血药浓度预测卡培他滨联合顺铂一线治疗晚期胃癌的疗效和安全性的单中心临床研究[J].肿瘤,2013,33(9):795-801.
[11] 姜跃龙,Liu XS,Chan DKY.谷胱甘肽-S-转移酶P1基因多态性与胃癌和食管腺癌的关系研究进展[J].中国综合临床,2014,30(1):97-99.
[12] 高雅琼,王彩丽.谷胱甘肽硫转移酶基因多态性与疾病关系的研究进展[J].医学综述,2013,19(1):29-31.
[13] 郭兴坡.MTHFR 基因多态性与结直肠癌易感性及与5-FU类药物化疗毒副反应的相关研究[D].苏州大学,2014.
[14] 陆建伟,高长明,吴建中,等.亚甲基四氢叶酸还原酶基因 C677T 多态性与胃癌患者对 5-FU 化疗敏感性的关系[J].癌症:英文版,2004,23(8):958-962.
[15] 朱海涛.血清肿瘤标志物在胃癌疗效观察、术后预后判断和复发监测中的临床价值[J].中外健康文摘,2013(51):202.
[16] 斯基尔.癌症化疗手册[M].科学出版社,2002.
[17] 何清.卡培他滨联合多西紫杉醇与L-OHP+5-FU/CF治疗晚期胃癌的对比研究[D].大连医科大学,2008.
(编校:王俨俨)
Effect of fluorouracil for injection on methylenetetrahydrofolate reductase, glutathione S-transferase and tumor markers on patients with advanced gastric cancer
CHEN Ting-fu1, YAN Qi-min2
(1.Department of Internal Medicine, The 63870th Hospital of Chinese People’s Liberation Army, Huayin 714200, China; 2.Department of Internal Medicine, The 323th Hospital of Chinese People’s Liberation Army, Xi’an 710000, China)
ObjectiveTo investigate the effect of fluorouracil for injection on methylene tetrahydrofolate reductase (MTHFR), glutathione S-transferase (GST) and tumor markers in patients with advanced gastric cancer.MethodsForty-eight cases with advanced gastric cancer were selected from August 2013 to August 2014 in the hospital and divided into two groups.The control group (n=24) were treated with capecitabine plan, and the experiment group (n=24) were treated with fluorouracil for injection plan.MTHFR concentration, GST activity and tumor markers [carbohydrate antigen-199(CA199), carcinoembryonic antigen (CEA), alpha fetoprotein(AFP)] levels were compared before and after treatment.ResultsCompared with control group, MTHFR concentration of experiment group was higher (P<0.05), GST activity was lower (P<0.05), the tumor markers levels were lower (P<0.05), total effective rate of clinical symptoms was higher [16(66.67) vs.22(91.67),χ2=4.55,P<0.05], and incidence of adverse reactions was lower [14(58.33) vs.6(25.00),χ2=5.49,P<0.05].ConclusionFluorouracil for injection chemotherapy could increase the serum MTHFR concentration, reduce GST activity, and its clinical curative effect is obvious with less adverse reactions, which has important significance in treatment of patients with advanced gastric cancer.
fluorouracil for injection; advanced gastric cancer; methylene tetrahydrofolate reductase; glutathione S-transferase; tumor markers
陈庭富,男,本科,主治医师,研究方向:消化内科疾病治疗,E-mail:ctf13311588571@163.com。
R735
A
1005-1678(2015)07-0085-04

