热力学研究辅料与蛋白药物之间的相互作用
王文娟,王炳全,韩军
(聊城大学 生物制药研究院,药学院,山东 聊城 252059)
热力学研究辅料与蛋白药物之间的相互作用
王文娟,王炳全Δ,韩军
(聊城大学 生物制药研究院,药学院,山东 聊城 252059)
目的 研究不同辅料(氨基酸、糖类、非离子型表面活性剂)对蛋白药物IgG1单抗热稳定性的影响,探讨辅料与蛋白之间的相互作用,判断辅料与蛋白之间是否存在结合作用。方法 通过差示扫描量热法(differential scanning calorimetry, DSC)获得蛋白的变性温度(Tm)或蛋白某一结构域的变性温度。采用等温滴定量热法(isothermal titration calorimetry ,ITC)测定蛋白与不同辅料之间的相互作用。结果 带负电荷的氨基酸可以明显降低IgG1单抗的变性温度(△Tm>9 ℃),其他辅料作用不明显(△Tm<1 ℃)。不同pH下辅料对蛋白稳定性的影响不同, 在pH=5时带负电荷的氨基酸对IgG1单抗热稳定性的影响大于pH=7时。ITC实验数据显示各种辅料和IgG1单抗的滴定等温线近乎一条直线。结论 IgG1单抗与辅料之间不存在特异性相互作用,带负电荷的氨基酸可以明显降低IgG1单抗的变性温度,应该归功于2者之间的静电相互作用。
蛋白制剂;IgG1单抗;蛋白热稳定性;辅料;氨基酸;相互作用
随着基因工程和生物制造工艺技术的发展,蛋白药物发展越来越快。单克隆抗体由于其低的毒、副作用和高特异性,而逐渐成为安全有效的新型蛋白药物,并在治疗癌症、心血管疾病和炎症领域表现突出[1-3]。然而单克隆抗体治疗一般需要定期给药且所需剂量大,一般每周需要几个mg/kg的量。现在上市的单克隆抗体大多是靠静脉注射方式给药[4],给患者带来很多不便。皮下注射是一种安全便利的给药途径,且注射体积较小(小于1.5 mL)[5],故需要较高浓度的单抗以满足高剂量(100~400 mg)的要求。皮下给药途径的发展促进了高浓度(一般大于50 mg/mL)蛋白药物的发展[6]。
然而,生产高浓度蛋白药物有很高的挑战性。高浓度蛋白溶液的粘度一般较高,这给准确填充装瓶造成了困难。另外,蛋白质的降解尤其是蛋白的团聚现象在不同的生产工艺下都可能出现。团聚的比例和程度与多种因素有关,如蛋白的物理-化学性质、溶液条件、蛋白浓度及辅料。还有工艺上的因素,如无菌过滤、冻结和解冻的循环、液体蛋白药物运输及储存过程都会诱导蛋白质团聚。蛋白质聚集会影响药物的生物活性,还可能诱导患者的免疫反应[7-8]。因此,如何提高蛋白质的稳定性是高浓度蛋白配方和生产的一大挑战[9-12]。
蛋白药物的稳定性受各种因素的影响,如蛋白分子构象的改变,蛋白质团聚体的形成都会受pH,缓冲液,离子强度等因素影响。当前,提高蛋白药物稳定性常用的方法是尝试加入不同辅料如各种氨基酸或各种表面活性剂等尽量减少蛋白-蛋白之间的相互联结及团聚现象。Shire小组[9]研究发现高浓度液体导致较强的蛋白分子之间的相互作用,蛋白分子之间距离更接近。Nichols等[12]通过设计降低溶液粘度的单克隆抗体突变体发现,静电作用比疏水作用力在单抗分子间的相互作用中起更主要的作用。Inoue等[13]通过测定加入了不同辅料(LysHCl,GdnHCl,ArgHCl, NaCl)的牛丙种球蛋白(Bovine gamma globulin ,BGG)粘度发现精氨酸盐酸盐(ArgHCl)对降低高浓度牛丙种球蛋白溶液粘度有较好的作用,他们认为ArgHCl的胍基与抗体上的芳香环有较强亲和力,加入ArgHCl阻止了蛋白分子间的相互作用。精氨酸(Arg)作为抑制蛋白团聚的辅料已用于上市的药物中[14]。Lilyestrom 等[15]研究了在pH 6.0及不同的离子强度下IgG1寡聚物的状态及其流变特性之间半定量的关联,发现IgG1溶液的流变学与单抗聚集成簇的尺寸的热力学平衡相关,与细长的寡聚物结构的粘性行为一致。还有,非离子型表面活性剂也是常用的辅料[16]。其中,吐温20和吐温80又是非离子表面活性剂中最常用的,既能防止表面吸附又能防止蛋白质团聚,从而提高高浓度蛋白配方的稳定性[17-19],又因其低毒性,被广泛应用于注射用蛋白药物中[6]。
虽然近来对辅料与蛋白药物的研究有了长足的进步,但目前关于辅料提高抗体蛋白溶液流变性和稳定性的机制还不太明确,辅料特别是不同的氨基酸与蛋白分子之间的相互作用还未深入了解。本研究旨在使用带不同电荷的氨基酸(正电荷, 负电荷和不带电荷)和表面活性剂作为辅料,采用不同的热力学手段探讨辅料与蛋白分子之间是否存在直接相互作用。本研究通过对比不同蛋白药物与不同表面活性剂的相互作用差异,以期为蛋白药物配方和工艺条件选择最优的辅料及pH值,为生产提供理论参考。
1 材料与方法
1.1 试剂 IgG1单抗(上海张江生物技术有限公司制备),人血清白蛋白(HSA,广东双林生物制药有限公司,批号20140302)。本实验用的蛋白是经透析处理获得的无其他辅料的蛋白溶液。由Sigma生产的吐温20(tween 20; polysorbate 20)、吐温80(tween 80; polysorbate80);及由Biotopped生产的蔗糖(sucrose)、精氨酸(Arg)、赖氨酸(Lys)、天冬氨酸(Asp)、谷氨酸(Glu)、苯丙氨酸(Phe)、酪氨酸(Tyr)均为分析纯级。
1.2 主要仪器 MicroCal®VP-DSC(Malvern), MicroCal®ITC-200(Malvern)。
1.3 实验方法 DSC实验中蛋白浓度为0.7 mg/mL, Arg和Lys是40 mM,Asp, Glu, Phe和Tyr是25 ℃时的饱和溶液,吐温20和吐温80浓度是0.2%,配3种不同pH值(5、6、7)的磷酸盐缓冲液,浓度为20 mM。加热范围是25 ℃~78 ℃,加热速率是1 ℃/min。每次实验之前先扫参比3~5遍,参比与样品实验条件相同,每个实验重复3遍,所得数据为3次平均值,所得结果用ORIGIN软件分析。
ITC实验中的蛋白浓度为0.1 mM,磷酸盐缓冲液20 mM。ITC实验转速为650r/min,注射器容量40 μL,2 μL/滴,池子容量为280 μL。滴定速率0.05 μL/s,间隔为180 s,初始平衡时间是300 s,平衡温度 25 ℃,参照功率5 μcal/s。每个实验重复3遍,所得结果用ORIGIN软件分析。
2 结果
2.1 辅料对IgG1单抗热稳定性的影响 分别加入不同辅料(氨基酸、糖和表面活性剂),通过DSC方法测得的蛋白变性温度(Tm值)与没加入辅料之前对比,有些辅料对蛋白Tm值影响较大, 有些几乎没有影响 (见表1)。并且, 测了不同pH值对蛋白稳定性的影响,及不同pH下辅料对蛋白稳定性的影响。试验中所用的氨基酸带有不同的电荷 ,其中Arg和Lys带正电荷,Asp, Glu带负电荷,Phe 和Tyr不带电荷,但具有芳香环。

表1 IgG1单抗在pH为5,6 和7时加入不同辅料后的变性温度(n=3)Tab.1 Denaturation temperature (Tm/℃) of IgG1 MAb in the presence of different excipients at pH 5, 6 and 7(n=3)
由图1可看出,带负电荷的氨基酸(Asp和Glu)对蛋白的Tm值影响最大,明显降低了样品的Tm值。如表1所示,加入氨基酸后吸热峰发生明显移动,pH=5时(图1A)加入辅料Asp后,样品的Tm值显著减小20 ℃,加入Glu 25℃饱和溶液后,样品的Tm值显著减小15.7 ℃。而pH=7(图1B),加入辅料Asp 25℃饱和溶液后,样品的Tm值显著减小15.6 ℃,加入Glu后,样品的Tm值显著减小9.4 ℃。
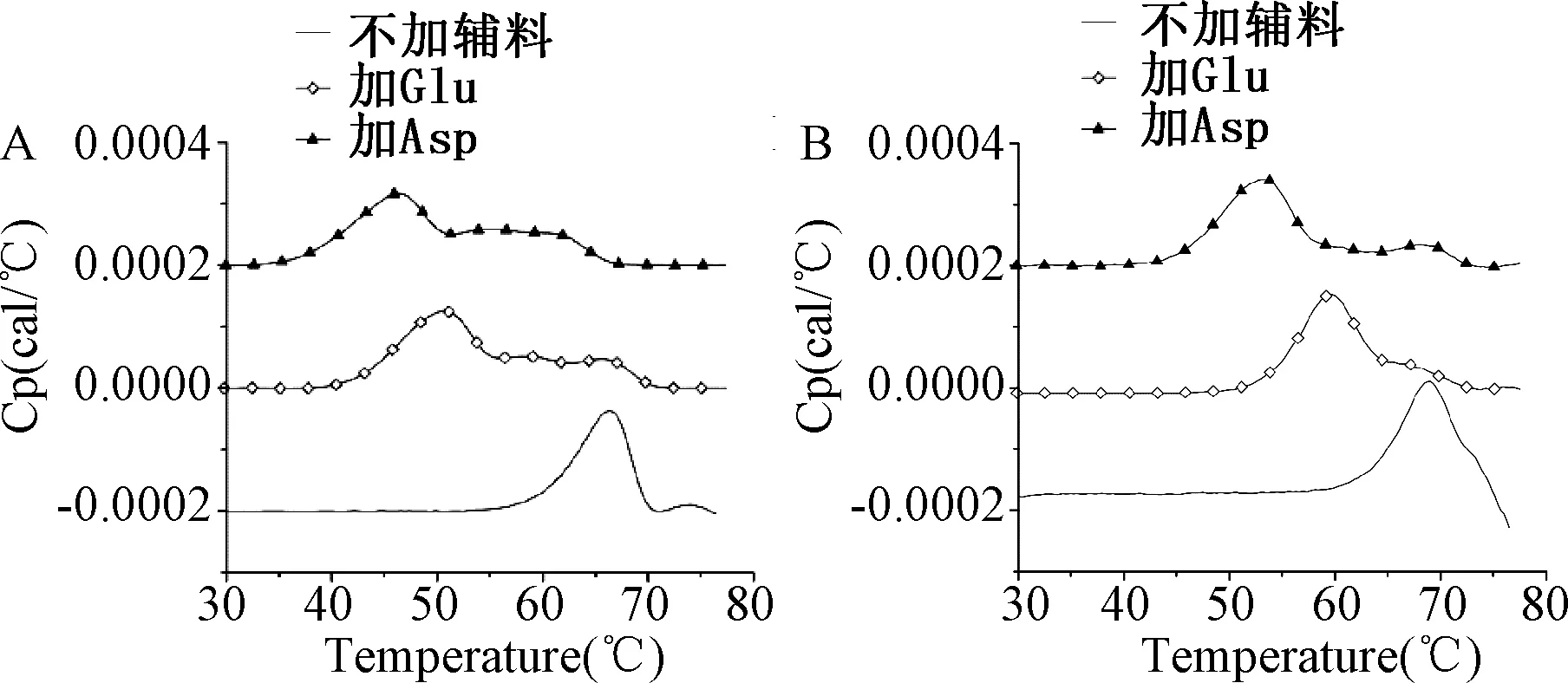
图1 IgG1单抗(0.7 mg/mL)在20 mM磷酸盐缓冲溶液中的DSC温度曲线A.pH=5;B.pH=7Fig.1 Heat capacity curves (Cp) of IgG1(0.7 mg/mL) in 20 mM phosphate bufferA.pH=5;B.pH=7
不带电荷的氨基酸对IgG1单抗热稳定性的影响,见图2。带正电荷氨基酸(Arg和Lys)及不带电荷的氨基酸(Phe和Tyr)对蛋白热稳定性影响很小(△T<1 ℃),温度曲线在形状上也没明显变化。其他辅料如蔗糖,吐温20和吐温80对样品热稳定性的影响与芳香族氨基酸(见图2)类似。

图2 IgG1 (0.7 mg/mL)在20 mM磷酸盐缓冲溶液DSC温度曲线A.pH=5;B.pH=7Fig.2 Heat capacity curves (Cp) of IgG1(0.7 mg/mL) in 20 mM phosphate bufferA.pH=5;B.pH=7
2.2 pH值对蛋白稳定性的影响 为了探索pH值对蛋白稳定性的影响,在此试验中设计了3个不同pH值(pH=5、6、7)。表1显示,IgG1的热稳定性一般随pH值减小而降低。由图1可看出,不同pH值时,样品DSC温度曲线的形状也有所不同,pH=5时IgG1的吸热峰有2个,1个大峰,后面1个小峰(后面的蛋白聚合放热曲线在图上没有显示);pH=7时,只能在大峰右侧看到1个肩峰,后面是蛋白聚合放热曲线;pH=6时,右侧肩峰要比pH=7时明显(pH=6的数据没有在此展示)。图1显示不同pH条件下相同辅料对同一蛋白热稳定性影响程度不同。pH=5时带负电荷的氨基酸对蛋白热稳定性降低程度较大。
2.3 去折叠后蛋白的溶解性 图2B中吸热峰后面温度曲线急剧下降的部分代表了去折叠后蛋白的溶解性。图3中,在pH=7时,蛋白的变性温度,比pH=5 时明显要高,但在不同吐温之间,不存在明显差异。但蛋白去折叠后溶解性存在差异,去折叠后蛋白的溶解性最差的(曲线急剧下降)是pH=7时加吐温20的样品。
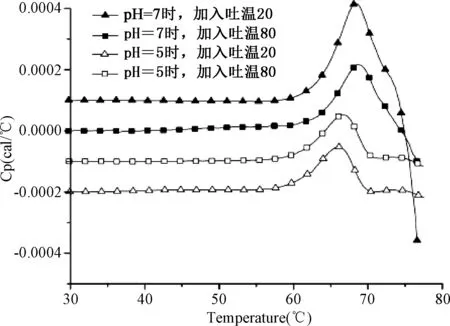
图3 IgG1样品(0.7 mg/mL)加入吐温20(5 mM)和吐温80(5 mM)后的DSC温度曲线磷酸盐缓冲溶液20 mMFig.3 Heat capacity curves (Cp) of IgG1(0.7 mg/mL) in the presence of polysorbate80 (5 mM) or polysorbate20 (5Mm) Buffer composition:20 mM phosphate
2.4 ITC研究辅料与蛋白的相互作用 通过ITC实验检测辅料与蛋白的相互作用,如下图4是精氨酸滴加到IgG1单抗时的反应。其他氨基酸,糖类与IgG1单抗的ITC结合等温线与图4一致,近乎一条直线。吐温20和吐温80作为蛋白药物最常用的非离子表面活性剂辅料,其与IgG1单抗的相互作用见图5(吐温80和吐温20的结果相同,在这没呈现吐温80结果)。如图5所示,参比与混合释放的热量比较接近,最后的等温线近乎一条直线。与IgG1相比,吐温与HSA的结合反应更明显(见图6),使用origin软件进行处理(结合模型one set of sites)[20],25 ℃时每个HSA分子可结合1~2个吐温分子,吐温20和HSA结合常数为2.9×103±63.5 M-1吐温80和HSA结合常数为2.7× 103±65.5 M-1。吐温20-HSA的其他相关热力学数据:△H=-64.9±2 kJ mol-1, T×△S=-45.7 kJ mol-1,△G=-19.2±2 kJ mol-1,吐温80-HSA:△H=-51.7±0.5 kJ mol-1,T×△S=-31.9 kJ mol-1,△G=-19.8±2 kJ mol-1。
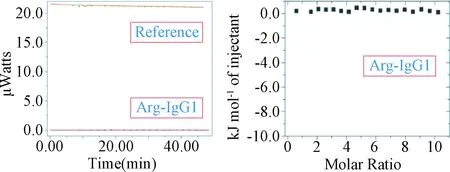
图4 Arg(5 mM)滴加到IgG1单抗溶液(0.1 mM)时的热量变化图(左图)和ITC结合等温线(右图)缓冲溶液为20 mM的磷酸盐缓冲液,pH=7Reference:Arg滴加到缓冲溶液时的热量变化;Arg-IgG1:Arg滴加到IgG1单抗溶液时的热量变化Fig.4 Experimental power flow signals (left) and binding isotherm (right) (obtained by integration of the titration peaks) after injection of Arg (5 mM) to IgG1 (0.1 mM) at 25 ℃ Buffer composition: 20 mM phosphate, pH=7Reference refers to the titration of Arg into buffer;Arg-IgGl refers to the titration of Arg into IgGl soultion

图5 磷酸盐缓冲溶液(20 mM)pH=7时,吐温20(5 mM)滴加到IgG1单抗溶液(0.1 mM) 溶液中的热量变化图(左图)和ITC结合等温线(右图)Reference:吐温20滴加到缓冲溶液时的热量变化; Polysorbate20-IgG1:吐温20滴加到IgG1单抗溶液时的热量变化Fig.5 Experimental power flow signals (left) and binding isotherm (right) (obtained by integration of the titration peaks) after injection of polysorbate 20 (5 mM) to IgG1 (0.1 mM) Reference refers to the thermal change of polysorbate 20 drops into buffer. Polysorbate20-IgG1 refers to the thermal change of phosphate 20 drops into IgG1 solution

图6 磷酸盐缓冲溶液(20 mM)pH=7时,吐温20、吐温80 (5 Mm)分别滴加到HSA (0.1 mM)溶液中的中的热量变化图和ITC结合等温线Reference: 吐温20(左上)、吐温80(右上)滴加到缓冲溶液时的热量变化;Polysorbate20-HSA、Polysorbate80-HAS:吐温20、吐温80滴加到HSA溶液时的热量变化Fig.6 Experimental power flow signals and binding isotherm (obtained by integration of the titration peaks) after injection of polysorbate 20、polysorbate 80 (5 mM) to HSA (0.1 mM) Reference refers to the thermal change of polysorbate 20(upper left), polysorbate 80 (upper right ) drops into buffer; Polysorbate20-IgG1 refers to the thermal change of phosphate 20 drops into IgG1 solution; Polysorbate20-HAS、 Polysorbate80-HASrefers to the thermal change of phosphate 20,phosphate 80 drops into HSA solution
3 讨论
单抗的功能依赖其结构,DSC测得的变性温度(Tm)与其结构密切相关。IgG1单抗有多个结构域,各结构域稳定性不同,在加热时最先去折叠的是CH2结构域,后面依次是Fab和CH3结构域[21]。图1A中不加辅料的样品温度曲线呈现出一个不对称的吸热峰,加入辅料后出现多个吸热峰。不加辅料的样品呈现的吸热峰可能是多个结构域吸热峰部分重叠在一起形成的。而其他氨基酸辅料对蛋白的热稳定性影响则不明显。应该是低浓度的带电荷辅料在蛋白溶液中发挥电解质的作用,从而影响了蛋白分子之间的静电相互作用[13]。ITC实验也证实了这一点(图4)。其他氨基酸辅料与IgG1单抗的ITC结合等温线与图4一致,参比释放的热量与辅料-样品释放或吸收的热量很相近,无论吸热峰还是放热峰都非常小,而且结合等温线近似一条直线,说明IgG1单抗分子与氨基酸之间没有特异性结合作用。辅料所带的负电荷使IgG1单抗的各结构域之间的稳定性差距变大,CH2结构域的热稳定性明显变差。
pH值也是影响蛋白质稳定的因素,由图1和图2可看出, pH值影响了不同结构域的热稳定性。带负电荷的氨基酸,在pH=5时对蛋白热稳定性降低程度最大,可能是pH=5时离此种IgG1单抗的等电点(pI>7)更远, 辅料和蛋白分子间的静电相互作用较强,导致蛋白的局部构象变化进而导致蛋白的热稳定性变差。
除此之外,影响IgG1稳定性的另一因素是去折叠后蛋白的溶解性[21], 这在DSC结果中也可看到,图2B中吸热峰后面温度曲线急剧下降的部分代表了去折叠后蛋白的溶解性。而蛋白质聚合或沉淀会使得蛋白折叠与去折叠之间的平衡向去折叠方向移动,所以可溶的去折叠中间体越少,蛋白聚合体和去折叠蛋白越多。pH=7时吐温80比吐温20吸热峰后面的温度曲线下降较缓慢,可能反映了其较好的溶解性。所以,在为IgG1单抗选择表面活性剂时,吐温80优先考虑。
至于吐温20和吐温80对IgG1单抗热稳定性的影响,在此实验条件下,无论是对Tm值还是吸热峰的形状影响都很小。吐温20和吐温80对于蛋白药物所起的稳定性依赖于其浓度,有文献报道0.1~0.4 mM的吐温20可以有效降低由搅拌诱导的免疫球蛋白聚合[22-23]。 Bam等[24]表明吐温可以使重组人生长激素避免搅拌导致的损害,且吐温与蛋白的摩尔比大于4时效果最好。
吐温20和吐温80常用来防止蛋白药物聚合,目前关于吐温20和吐温80的作用机制主要有以下几种观点:第一种观点认为,表面活性剂与蛋白在空气/水表面位点竞争,从而限制蛋白分子暴露于空气界面[25]。第二种观点认为,表面活性剂扮演分子伴侣的角色,能瞬间结合到部分折叠的蛋白分子上,从而使蛋白重现折叠,并且在空间上阻止蛋白-蛋白分子之间的相互作用[26]。第三种观点认为,表面活性剂与蛋白分子直接相互作用。表面活性剂结合到蛋白分子暴露在外的疏水区,从而阻止蛋白聚合[27-29]。此研究主要探索吐温20和吐温80是否与IgG1分子存在特异性结合,即最后一种观点。ITC实验结果显示,吐温(吐温20和吐温80的结果相同,在这没呈现吐温80结果)与IgG1单抗亲和力非常低,2者之间几乎不发生特异性结合(图5A),这有可能是在此条件下,蛋白-蛋白之间的相互作用较强,影响了辅料和蛋白之间的特异性,结合非常弱[30- 31]。
吐温和不同蛋白结合有明显的区别,这可能与蛋白的结构有关,IgG1的二级结构主要是β-折叠(β-sheet),HSA的二级结构以α-螺旋(α-helix)为主。鉴于HSA天然的生物学功能, HSA在溶液中展示出很大的灵活性,所以它可以和不同配体结合[32]。吐温20与HSA的亲和力稍高于吐温80,Chou等[33]进行的吐温和HSA结合反应实验也证明吐温20与HSA的亲和力更高一些, 这可能是因为吐温80分子脂肪酸更长,从空间上妨碍了吐温80与HSA的结合。吐温20-HSA的其他相关热力学数据如△H,T×△S表明吐温20和吐温80与HSA结合反应非常相似,在这种结合模式中有范德华力作用和/或蛋白-吐温之间氢键形成[34]。
综上所述,在本实验中各种辅料对蛋白药物的热稳定性的影响差异很大,其中带负电荷的氨基酸(Asp和Glu)明显降低了IgG的Tm值,使得单抗各结构域的去折叠温度差变大,且pH=5比pH=7时作用更明显。而带正电荷(Arg和Lys)和带芳香环的氨基酸(Phe和Tyr),蔗糖,吐温20及吐温80对IgG热稳定性影响不大,且IgG1抗体溶液在pH=7时的热稳定性要比在pH=5时好。pH=5时离蛋白的pI较远,辅料和蛋白分子间的静电相互作用较强。通过ITC测得的数据表明, 吐温20 和吐温80与HSA的结合反应明显, 但各种辅料包括吐温与IgG1抗体之间没有特异性结合作用。这也说明带负电荷的氨基酸发挥电解质作用,影响了蛋白分子间的静电相互作用,从而降低了蛋白药物的热稳定性。
致谢
感谢上海张江生物的王皓教授慷慨提供了IgG1单抗, 及李军老师对本工作提供的帮助。本研究也获得了山东省泰山学者研究基金资助,在山东省抗体制药协同创新中心,山东省纳米药物与释药系统工程技术研究中心完成,特此感谢。
[1] Gelfand EW. Antibody-directed therapy: past, present, and future[J].J Allergy Clinical Immunol, 2001,108(4 Suppl):S111-116.
[2] Campbell P,Marcus R. Monoclonal antibody therapy for lymphoma[J]. Blood Rev, 2003,17(3):143-152.
[3] Loertscher R.The utility of monoclonal antibody therapy in renal transplantation[J]. Transplant Proc, 2002,34(3):797-800.
[4] Liu J, Nguyen MD, Andya JD, et al. Reversible self-association increases the viscosity of a concentrated monoclonal antibody in aqueous solution[J]. J Pharmaceutical sciences, 2005,94(9):1928-1940.
[5] Yadav S, Liu J, Shire SJ, et al. Specific interactions in high concentration antibody solutions resulting in high viscosity[J]. J Pharma Sciences, 2010,99(3):1152-1168.
[6] Hoffmann C, Blume A, Miller I, et al. Insights into protein-polysorbate interactions analysed by means of isothermal titration and differential scanning calorimetry[J]. Eur Biophys J, 2009,38(5):557-568.
[7] Braun A, Kwee L, Labow MA, et al. Protein aggregates seem to play a key role among the parameters influencing the antigenicity of interferon alpha (IFN-alpha) in normal and transgenic mice[J]. Pharm Res, 1997,14(10):1472-1478.
[8] Moore WV, Leppert P. Role of aggregated human growth hormone (hGH) in development of antibodies to hGH[J]. J Clin Endocrinol Metab, 1980,51(4):691-697.
[9] Shire SJ, Shahrokh Z, Liu J. Challenges in the development of high protein concentration formulations[J]. J Pharm Sci, 2004,93(6):1390-1402.
[10] Cromwell ME, Hilario E, Jacobson F. Protein aggregation and bioprocessing[J]. AAPS J, 2006,8(3):E572-579.
[11] Wang W. Protein aggregation and its inhibition in biopharmaceutics[J].Int J Pharm, 2005,289(1-2):1-30.
[12] Nichols P, Li L, Kumar S, et al. Rational design of viscosity reducing mutants of a monoclonal antibody: hydrophobic versus electrostatic inter-molecular interactions[J]. MAbs, 2015,7(1):212-230.
[13] Inoue N, Takai E, Arakawa T, et al. Specific decrease in solution viscosity of antibodies by arginine for therapeutic formulations[J]. Mol Pharm, 2014,11(6):1889-1896.
[14] Arakawa T, Tsumoto K, Kita Y, et al. Biotechnology applications of amino acids in protein purification and formulations[J]. Amino Acids, 2007,33(4):587-605.
[15] Lilyestrom WG, Yadav S, Shire SJ, et al. Monoclonal antibody self-association, cluster formation, and rheology at high concentrations[J]. J Phys Chem B, 2013,117(21):6373-6384.
[16] Chou DK, Krishnamurthy R, Randolph TW, et al. Effects of Tween 20 and Tween 80 on the stability of Albutropin during agitation[J]. J Pharm Sci, 2005,94(6):1368-1381.
[17] Goppert TM, Muller RH. Plasma protein adsorption of Tween 80-and poloxamer 188-stabilized solid lipid nanoparticles[J]. J Drug Target, 2003,11(4):225-231.
[18] Dickinson E, Ritzoulis C, Povey MJ. Stability of Emulsions Containing Both Sodium Caseinate and Tween 20[J]. J Colloid Interface Sci, 1999,212(2):466-473.
[19] Dimitrova, TD, Leal-Calderon F. Forces between emulsion droplets stabilized with Tween 20 and proteins[J]. Langmuir, 1999,15(26):8813-8821.
[21] Wen J, Arthur K, Chemmalil L, et al. Applications of differential scanning calorimetry for thermal stability analysis of proteins: qualification of DSC[J]. J Pharm Sci, 2012,101(3):955-964.
[22] Schule S, Friess W, Bechtold-Peters K, et al. Conformational analysis of protein secondary structure during spray-drying of antibody/mannitol formulations[J]. Eur J Pharm Biopharm, 2007,65(1):1-9.
[23] Mahler HC, Muller R, Friess W, et al. Induction and analysis of aggregates in a liquid IgG1-antibody formulation[J]. Eur J Pharm Biopharms, 2005,59(3):407-417.
[24] Bam NB, Cleland JL, Yang J, et al. Tween protects recombinant human growth hormone against agitation-induced damage via hydrophobic interactions[J]. J Pharm Sci, 1998,87(12):1554-1559.
[25] Lin TY, Timasheff SN. On the role of surface tension in the stabilization of globular proteins[J]. Protein Science, 1996,5(2):372-381.
[26] Bam NB, Randolph TW, Cleland JL. Stability of protein formulations: investigation of surfactant effects by a novel EPR spectroscopic technique[J]. Pharm Res, 1995,12(1):2-11.
[27] Peyre V, Lair V, Andre V, et al. Detergent binding as a sensor of hydrophobicity and polar interactions in the binding cavities of proteins[J]. Langmuir, 2005,21(19):8865-8875.
[28] Xie G, Timasheff SN. Temperature dependence of the preferential interactions of ribonuclease A in aqueous co-solvent systems: thermodynamic analysis[J]. Protein Sci, 1997,6(1):222-232.
[29] Nishikido N, Takahara T, Kobayashi H, et al. Interaction between hydrophilic proteins and non-ionic detergents studied by surface tension measurements[J]. Bull Chem Soc Jpn,1982, 55(10):3085-3088.
[30] Sophioanopoulos AJ, van Holde KE. Physical studies of murinase[J]. J Biol Chem, 1964, 239:2416-2524
[31] Wilson LJ, Adcock-Downey L, Pusey ML. Monomer concentrations and dimerisation constants in crystallising lysozyme solutions by dialysis[J]. Biophys J, 1996,71(4):2123-2129
[32] Spector AA. Fatty acid binding to plasma albumin[J]. J Lipid Res,1975, 16(3):165-179
[33] Arouri A, Garidel P, Kliche W, et al. Hydrophobic interactions are the driving force for the binding of peptide mimotopes and Staphylococcal protein A to recombinant human IgG1[J]. Eur Biophys J, 2007,36(6):647-660.
[34] O’Brien R, Haq I. Application of biocalorimetry: binding, stability and enzyme kinetics[M]. Ladbury JE, Chowdhry BZ(eds) Biocalorimetry-applications of calorimetry in the biological sciences. New York:Wiley, 2004:1-34
(编校:王冬梅)
Thermodyn amic study on the interaction of excipients and protein
WANG Wen-juan, WANG Bing-quanΔ, HAN Jun
(Institute of BioPharmaceutical Research/School of Pharmacy, Liaocheng University, Liaocheng 252059, China)
ObjectiveTo determine the effects of different excipients (amino acids, carbohydrates and nonionic surfactants) on thermal stability of the IgG1 monoclonal antibody, and to examine the interactions between the excipients and the protein.MethodsDifferential scanning calorimetry (DSC) was used to study thermal stability of the protein in different solutions and got information on the solubility of the unfolded forms of the protein.Isothermal titration calorimetry (ITC) was used to examine the binding interactions between the excipients and the protein.ResultsNegatively charged amino acids could significantly reduce the denaturation temperature (Tm) of IgG1(△Tm>9 ℃), and other excipients didn’t have a major effect (△Tm<1 ℃).Excipients shared different impacts on thermal stability of the IgG1 monoclonal antibody under different pH, and negatively charged amino acids result in a much lower Tmat pH 5 than at pH 7.The ITC binding isotherms of different excipients (including polysorbate 20 and 80) and IgG1 were almost straight lines, while there was strong binding interaction between polysorbate 20 or 80 and Human Serum Albumin (HSA).ConclusionThe results suggest that there is no binding interaction between these studied excipients and the IgG1 monoclonal antibody; instead electrostatic interactions seem to play a leading role between the excipients and the IgG1 monoclonal antibody.
protein formulation; IgG1 monoclonal antibody; thermal stability; excipient; amino acid; specific interaction
国家自然科学基金(21373106)
王文娟,女,硕士,研究方向:蛋白药物,E-mail:elma95@126.com;王炳全,通讯作者,男,博士,教授,研究方向:生物制剂和蛋白药物稳定性的研究,E-mail:1298145393@qq.com。
R94
A
1005-1678(2015)07-0005-05

