偏头痛模型大鼠相关活性物质表达
董晓梦 荆龙 陈金波
偏头痛模型大鼠相关活性物质表达
董晓梦 荆龙 陈金波
目的 研究磷酸化的细胞外信号调节激酶(the phosphorylated form of the extracellular signal-regulated kinase,p-ERK)、降钙素基因相关肽(calcitonin gene-related peptide,CGRP)及环氧化酶-2(cyclooxygenase-2,COX-2)在偏头痛模型大鼠硬脑膜、三叉神经节和三叉神经脊束尾核组织中的表达及其相关性,为探讨偏头痛发病机制提供依据。方法 将60只雄性SD大鼠随机分为空白组、生理盐水组、硝酸甘油组和电刺激组;硝酸甘油组和生理盐水组根据注射后时间再分别分为30 min、1 h和3 h组;电刺激组再分为电刺激三叉神经节(ESTG)模型组、假手术组和尼美舒利干预组。采用免疫组化染色观察大鼠硬脑膜、三叉神经节和三叉神经脊束尾核p-ERK、CGRP、COX-2的表达。结果 (1)硝酸甘油组大鼠硬脑膜、三叉神经节和三叉神经脊束尾核的p-ERK、CGRP、COX-2表达均明显高于生理盐水组(均P<0.01),ESTG大鼠不同部位组织的p-ERK、CGRP、COX-2表达均明显高于假手术组和空白组(均P<0.01);(2)p-ERK表达在注射硝酸甘油后的30 min组均高于1 h组和3 h组,后随时间增加其表达逐渐降低(均P<0.01);(3)尼美舒利干预组大鼠不同组织中p-ERK、CGRP、COX-2的表达均低于ESTG模型组(P<0.05)。结论 (1)p-ERK、CGRP、COX-2表达上调与偏头痛的炎性反应和疼痛敏化有关,其中p-ERK可能参与偏头痛早期过程;(2)偏头痛过程中,p-ERK、CGRP和COX-2蛋白之间有密切联系。
偏头痛;细胞外信号调节MAP激酶类;降钙素基因相关肽;环氧化酶-2;硝酸甘油模型;电刺激三叉神经节模型;尼美舒利
偏头痛是一种复杂的神经血管疾病,以发作性、多为偏侧、中重度、搏动样疼痛、活动后加重为特点,患病率为15%[1]。其发病机制尚不明确,三叉神经血管系统(trigeminalvascularsystem,TVS)介导的神经源性炎性反应和疼痛中枢敏化在偏头痛的痛觉产生和维持中起重要作用[2-3],其中硬脑膜(duramater)、三叉神经节 (trigeminalganglion,TG) 和脑干三叉神经脊束尾核 (spinaltrigeminalnucleuscaudalis,TNC)为TVS关键部位[4-5]。诸多研究证实,磷酸化的细胞外信号调节激酶(thephosphorylatedformoftheextracellularsignal-regulatedkinase,p-ERK)、降钙素基因相关肽(calcitoningene-relatedpeptide,CGRP)及环氧化酶-2(cyclooxygenase-2,COX-2)参与痛觉机制和伤害性信号传递,但目前国内外对以上3种物质在偏头痛神经源性炎性反应和疼痛敏化过程的研究较少。基于TVS理论的经典模型-硝酸甘油(nitroglycerin,NTG)模型和电刺激三叉神经节(electricalstimulationofthetrigeminalganglion,ESTG) 模型,较好地反映了偏头痛的疼痛超敏和神经炎性反应过程[6]。本实验应用免疫组化技术,从蛋白水平观察NTG模型大鼠p-ERK、CGRP和COX-2在硬脑膜、TG和TNC组织中的表达,研究其在偏头痛炎性反应和疼痛敏化中的作用,并用ESTG模型探讨此3种物质在偏头痛中的相互联系,为偏头痛机制研究和治疗提供实验依据。
1 材料和方法
1.1 实验动物及分组 60只SPF级成年雄性SD大鼠(体质量280~320g),购于北京维通利华实验动物技术有限公司。大鼠按随机数字法分为空白组(n=6)、生理盐水组(n=18)、NTG模型组(n=18)和电刺激组(n=18)。NTG模型组和生理盐水组再根据最后一次注射后处死时间随机分为30min、1h和3h亚组(每组6只);电刺激组再随机分为ESTG模型组(n=6)、假手术组(n=6)和尼美舒利干预组(n=6)。
1.2 主要试剂和仪器 鼠抗p-ERK、羊抗CGRP及兔抗COX-2抗体购自Abcam公司,对应3种二抗MaxVisionTM试剂盒、DAB染色液及苏木素染色液购自福州迈新生物技术有限公司,NTG注射液(5mg/mL,批号20130504)为北京益民药业有限公司产品,尼美舒利分散片(50mg,批号131001)购自康芝药业。主要仪器包括YLS-9A生理药理电子刺激仪(济南益延科技发展公司)、ZH-RXZ柔性颅骨钻及ZH蓝星脑立体定位仪(安徽正华生物仪器设备有限公司)、LeicaRM2235石蜡切片机、OLYMPUSBX51显微镜+DP72显微照相等。
1.3 方法
1.3.1NTG模型:采用皮下注射NTG法[7]造模。大鼠按体质量10mg/kg颈部皮下注射NTG,15~30min后大鼠出现双耳发红、前后肢频繁挠头、爬笼次数增多等现象,40~60min时达高峰,持续1~3h后大鼠蜷卧、活动减少。每周1次,共5周。生理盐水组以相同方式注射等剂量生理盐水。两组大鼠分别于第5次注射后30min、1h、3h时将大鼠麻醉,灌注固定,取材。
1.3.2ESTG模型:将大鼠用10%(质量浓度)水合氯醛按体质量0.4mL/100g腹腔注射麻醉后固定在立体定位仪上,头顶正中(去毛)皮肤消毒,“十”字切口切开皮肤、肌肉,暴露颅骨。以前囟为基点,在后移3.2mm,旁开3mm处,颅骨钻钻直径为1.5mm孔,然后将电极经此孔插入TG(以硬脑膜算起深度约为9.5mm)。调试好刺激电极,电刺激参数为周期200ms,幅度10V,波宽5ms,刺激30min[8]。大鼠刺激侧咀嚼肌收缩,口鼻分泌物增多时为模型制作成功。假手术组只插电针不刺激,余同上。尼美舒利处理组大鼠进行ESTG造模前按体质量6mg/(kg·d)给予尼美舒利分散片灌胃,1次/d,持续7d。最后1次灌胃后1h建立ESTG模型,步骤同上。以上所有操作均在无菌条件下进行,操作过程保持动作轻柔、环境安静,避免强光,室温保持25℃左右。刺激结束30min后灌注固定,取材。空白组不作任何处理,直接麻醉后灌注固定,取材。
1.3.3 免疫组织化学染色:大鼠经10%(质量浓度)水合氯醛按体质量0.4mL/100g腹腔注射麻醉后,仰卧固定,开胸经左心室插管至升主动脉灌注37℃ 0.9%(质量浓度)生理盐水300~500mL至右心耳流出液变清、肝脏变白,继而用4℃ 4%(质量浓度)的多聚甲醛磷酸缓冲液先快速灌注200mL,再慢速灌注300mL,至大鼠肝脏变韧,肢体由抽搐变僵直后开颅,取出硬脑膜、TG(ESTG模型组、假手术组和尼美舒利干预组只取刺激侧)、TNC对应的低位脑干,置于4%(质量浓度)的多聚甲醛磷酸缓冲液中固定12~24h后,常规脱水、包埋、切片(厚度3μm)。
将上述切片烤片,二甲苯脱蜡,梯度酒精复水,0.01mol/LPBS洗 5min×3次,柠檬酸盐缓冲液微波炉热抗原修复,0.01mol/LPBS洗5min×3次,3%(体积分数)H2O2孵育20min(室温),PBS洗5min×3次,5%(质量浓度)BSA封闭30min(室温),加一抗(稀释倍数:COX-2、CGRP均为1/350,p-ERK为1/400)4℃过夜,0.01mol/LPBS洗5min×3次,滴加二抗,37℃孵育30min,0.01mol/LPBS洗5min×3次,DAB显色、苏木素复染、盐酸酒精分化、脱水透明、封片后,显微镜下观察。光镜(×40)下观察拍摄(脑膜切片×100),应用ImageProPlus6.0图像分析系统,每只大鼠取5张切片,每张切片随机取6个视野,对阳性表达部分进行平均吸光度〔D(λ)〕值测定,每组至少测定3次,取均值。

2 结果
2.1NTG对p-ERK、CGRP和COX-2表达的影响 空白组与生理盐水组p-ERK、CGRP、COX-2在硬脑膜、TG及TNC未见或仅见少量表达,两组间比较差异无统计学意义;与空白组和生理盐水组相比,NTG模型组大鼠在3个时间点硬脑膜、TG与TNC组织的CGRP和COX-2均呈强阳性表达(均P<0.01),p-ERK阳性细胞在30min时间点的表达较空白组和生理盐水组升高(均P<0.01),且在此时间点3部位p-ERK表达分别高于1h组和3h组(均P<0.01),而COX-2与CGRP的表达在各时间点间比较未见统计学差异(均P>0.05);生理盐水组与空白组中3物质在3时间点无统计学差异(均P>0.05)。具体结果见图1~6。
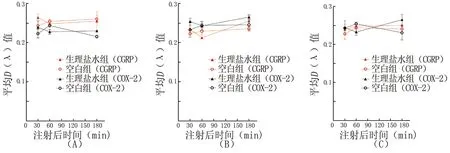
2.2 尼美舒利对p-ERK、CGRP和COX-2表达的影响 空白组、假手术组、ESTG组和尼美舒利干预组间各部位中p-ERK、CGRP和COX-2的表达比较均有统计学差异(硬脑膜组织:Fp-ERK=98.34,FCGRP=131.4,FCOX-2=99.4;TG组织:Fp-ERK=193.4,FCGRP=227.0,FCOX-2=96.61;TNC组织:Fp-ERK=35.55,FCGRP=123.5,FCOX-2=114.9;均P<0.01)。两两比较,ESTG组各部位组织的p-ERK、CGRP和COX-2表达均较假手术组增高(均P<0.01),而尼美舒利干预组其表达均较ESTG组降低(均P<0.05),但高于假手术组和空白组(均P<0.01),假手术组和空白组组间比较差异无统计学意义(均P>0.05,图7)。

p-ERK:磷酸化的细胞外信号调节激酶,CGRP:降钙素基因相关肽,COX-2:环氧化酶-2,NTG:硝酸甘油,图2~7同
图1 各组大鼠最后一次注射后30 min硬脑膜p-ERK、CGRP和COX-2的表达(免疫组化,×100)

TG:三叉神经节,图3~7同
图2 各组大鼠最后一次注射后30 min TG p-ERK、CGRP和COX-2的表达(免疫组化,×40)
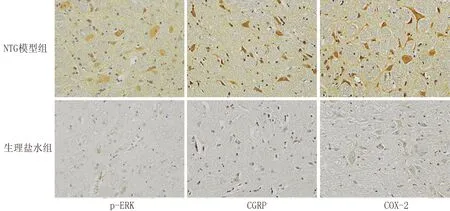
TNC:三叉神经脊束尾核,图4~7同
图3 各组大鼠最后一次注射后30 min TNC p-ERK、CGRP和COX-2的表达(免疫组化,×40)
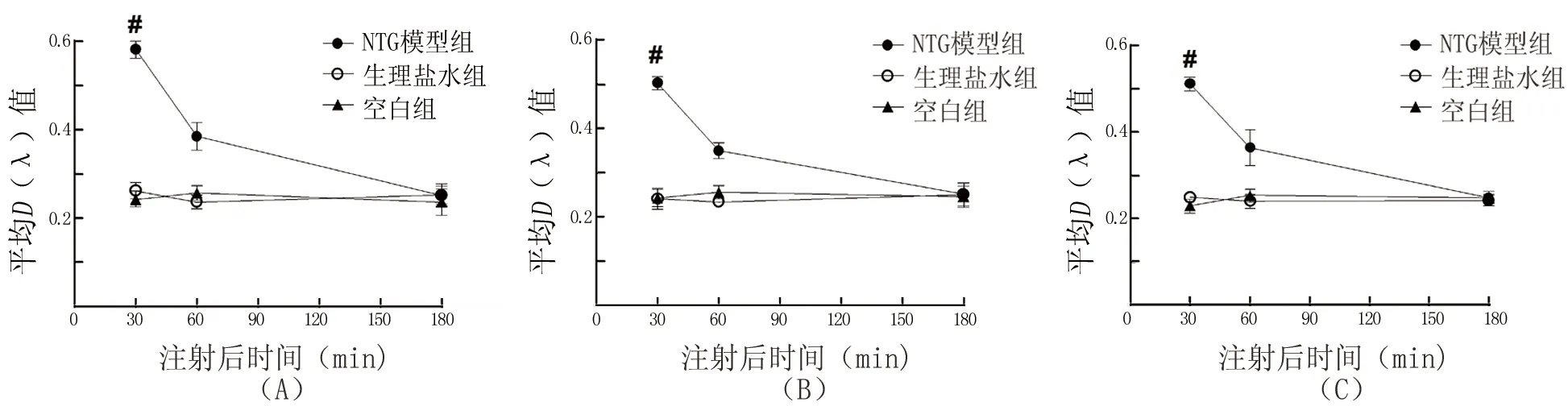
注:A:硬脑膜组织,B:TG组织,C:TNC组织,图5~7同;NTG模型组大鼠不同时间点各部位组织中p-ERK比较有统计学差异(F硬脑膜=139.8,FTG=82.42,FTNC=181.4,均P<0.01);生理盐水组(F硬脑膜=1.235,FTG=0.4613,FTNC=0.4333)和空白组(F硬脑膜=0.7114,FTG=0.3329,FTNC=1.929)p-ERK在各时间点各部位的表达无统计学差异(均P>0.05);与同组内1 h和3 h时间点比较,#P<0.01
图4 各组注射后不同时间点各部位组织中p-ERK的表达(免疫组化)

注: NTG模型组各组织部位不同时间点CGRP(F硬脑膜=0.8455,FTG=0.4945,FTNC=0.9628)和COX-2(F硬脑膜=0.6558,FTG=0.8512,FTNC=0.7731)的表达无统计学差异(均P>0.05)
图5 NTG模型组注射NTG后不同时间点各部位组织中CGRP和COX-2的表达变化(免疫组化)
注:生理盐水组各时间点CGRP比较差异无统计学意义(F硬脑膜=0.2973,FTG=0.2427,FTNC=0.6693,均P>0.05),COX-2比较亦无统计学意义(F硬脑膜=0.7436,FTG=0.4846,FTNC=0.3889,均P>0.05);空白组各时间点CGRP比较差异无统计学意义(F硬脑膜=0.3908,FTG=0.4987,FTNC=0.5542,均P>0.05),COX-2比较亦无统计学意义(F硬脑膜=0.3688,FTG=0.7940,FTNC=0.4383,均P>0.05)
图6 生理盐水组和空白组注射后不同时间点各部位组织中CGRP和COX-2的表达变化(免疫组化)

注:与假手术组和空白组分别比较,#P<0.01;与ESTG组比较,*P<0.05
图7 各组大鼠不同组织中p-ERK、CGRP和COX-2的表达比较
3 讨论
偏头痛发病机制复杂,TVS的激活起关键作用[1-3,5]。TVS包括三叉神经眼支支配的脑膜及其血管、TG、TNC等[5]。偏头痛发作时硬脑膜等伤害感受器上的三叉神经无髓C纤维释放CGRP、P物质、神经激肽A等,产生神经源性炎性反应[1],是偏头痛发作时的主要伤害性刺激[5,9]。皮肤超敏痛(cutaneous allodynia, CA)是偏头痛慢性化的指标之一,是中枢感觉神经元超敏化的标志,经TVS介导[3,5,10]。TG接受来自硬脑膜的疼痛刺激,传递至TNC,后者将伤害性刺激向上传递至丘脑腹后核、大脑皮质,产生痛觉[3,5,9]。因此,神经源性炎性反应和中枢敏化是偏头痛的关键反应。
细胞外信号调节激酶(extracellular signal-regulated kinase, ERK)是丝裂原活化蛋白激酶的一员,Iwashita等[11]研究证实p-ERK通过伤害性刺激受体——TRPV1介导偏头痛痛觉信号传导,传递伤害信息至外周神经末梢和TNC,产生外周和中枢敏化。本实验结果显示,NTG模型组和ESTG组大鼠组成TVS部分的硬脑膜、TG和TNC中p-ERK表达均明显升高,提示其在偏头痛发病机制中具有重要作用;且p-ERK 的表达在偏头痛发作30 min左右时达到较高水平,后随时间增加其表达逐渐降低,在3 h左右达到基础水平,而CGRP及COX-2在发作30 min~3 h一直处于相对较高水平,提示 ERK的磷酸化激活可能参与了偏头痛的早期发病过程,而CGRP和COX-2则在维持偏头痛整个发作过程中起重要作用。
CGRP表达于感受痛觉的脑膜血管的TG细胞,参与偏头痛硬脑膜神经源性炎性反应[2,4]。研究表明,偏头痛患者血清CGRP水平明显升高;CGRP可通过激活P2X3基因参与痛觉敏化[12];其受体拮抗剂CGRP8-37可减弱辣椒辣素诱导的TVS痛觉过敏[13]。COX-2是合成前列腺素E2(prostaglandin E2, PGE2)的重要限速酶,PGE2不仅是一种周围炎性反应介质,更参与中枢疼痛信号传导[14-15],临床上常用COX-2抑制剂(如尼美舒利等)治疗偏头痛。本实验结果显示,NTG模型组和ESTG组中,硬脑膜、TG及TNC上都呈现CGRP和COX-2的高表达,从蛋白水平证实了CGRP和COX-2在TVS介导的痛觉敏化和炎性反应中具有重要作用。此外,本研究还发现CGRP在硬脑膜的表达多集中在脑膜血管周围肥大细胞处,这可能与CGRP参与偏头痛过程肥大细胞脱颗粒释放炎性反应介质从而进行伤害性信号传递[5]有关。COX-2在正常组织表达较少,在炎性反应组织中则呈高表达。本实验中NTG模型组与生理盐水组相比、ESTG组与假手术组相比,硬脑膜COX-2表达明显升高,进一步证实偏头痛硬脑膜神经源性炎性反应的存在。
本实验通过特异性COX-2抑制剂尼美舒利干预ESTG模型大鼠,结果显示COX-2水平被明显抑制的同时,p-ERK和CGRP的水平也较ESTG组降低,提示尼美舒利可能通过抑制COX-2抑制了部分p-ERK和CGRP的表达,由此推测,在偏头痛过程中,COX-2与p-ERK、CGRP的表达存在某种联系。尼美舒利组3种物质的表达仍较空白组和假手术组高,考虑与尼美舒利剂量不足有关。结合Neeb等[16]研究结果,作者认为,在偏头痛过程中,COX-2可通过合成PGE2进一步激活三叉神经元释放CGRP;而由于p-ERK在偏头痛中由TRPV1介导,而后者亦可被PGE2激活[11]。因此,COX-2也可以通过合成PGE2促进p-ERK的产生。可见,偏头痛过程中COX-2与p-ERK、CGRP之间存在密切联系,临床上COX-2抑制剂不仅是通过抑制COX-2,也抑制p-ERK、CGRP等治疗偏头痛,为COX-2抑制剂在临床上的使用增加了新的实验证据。
综上所述,本实验通过建立两种经典的偏头痛大鼠模型研究p-ERK、CGRP和COX-2在偏头痛炎性反应和疼痛中枢敏化中的作用,为偏头痛治疗药物和发病机制的研究提供了新的实验依据和靶点。
[1]Goadsby PJ. Recent advances in understanding migraine mechanisms, molecules and therapeutics[J]. Trends Mol Med, 2013,13(1):39-44.
[2]Noseda R, Burstein R. Migraine pathophysiology: anatomy of the trigeminovascular pathway and associated neurological symptoms, CSD, sensitization and modulation of pain[J]. Pain, 2013, 154(Suppl1):44-53.
[3]Burstein R, Jakubowski M. Managing migraine associated with sensitization[J]. Handb Clin Neurol, 2010, 97:207-215.
[4]Kaiser EA, Russo AF. CGRP and migraine: Could PACAP play a role too?[J]. Neuropeptides, 2013, 47(6):451-461.
[5]Kojiĉ Z, Stojanoviĉ D. Pathophysiology of migraine-from molecular to personalized medicine [J]. Med Pregl, 2013, 66(1-2):53-57.
[6]Buzzi MG, Tassorelli C. Experimental models of migraine[J]. Handb Clin Neurol, 2010, 97:109-123.
[7]Tassorelli C, Greco R, Wang D, et al. Nitroglycerin induces hyperalgesia in rats—a time-course study[J]. Eur J Pharmacol,2003,464(2-3):159-162.
[8]刘婷,沈飞飞,韦俊超,等.头痛宁对电刺激三叉神经节大鼠脑膜血流与CGRP的影响[J].中国疼痛医学杂志,2010,16(4):220-223.
[9]Aguggia M, Saracco MG, Cavallini M,et al. Sensitization and pain[J]. Neurol Sci, 2013, 34(Suppl1): 37-40.
[10]Louter MA, Bosker JE, van Oosterhout WP, et al. Cutaneous allodynia as a predictor of migraine chronification[J]. Brain, 2013, 136(11):3489-3496.
[11]Iwashita T, Shimizu T, Shibata M, et al. Activation of extracellular signal-regulated kinase in the trigeminal ganglion following both treatment of the dura mater with capsaicin and cortical spreading depression[J]. Neurosci Res, 2013, 77(1-2):110-119.
[12]Giniatullin R, Nistri A, Fabbretti E. Molecular mechanisms of sensitization of pain-transducing P2X3 receptors by the migraine mediators CGRP and NGF[J]. Mol Neurobiol, 2008, 37(1):83-90.
[13]Sun RQ, Lawand NB, Willis WD. The role of calcitonin gene-related peptide (CGRP) in the generation and maintenance of mechanical allodynia and hyperalgesia in rats after intradermal injection of capsaicin[J]. Pain, 2003, 104(1-2):201-208.
[14]Varga H, Pardutz A, Vamos E, et al. Cox-2 inhibitor attenuates NO-induced nNOS in rat caudal trigeminal nucleus[J]. Headache, 2007, 47(9):1319-1325.
[15]Tassorelli C, Greco R, Armentero MT, et al. A role for brain cyclooxygenase-2 and prostaglandin-e2 in migraine:effects of nitroglycerin [J]. Int Rev Neurobiol, 2007, 82:373-382.
[16]Neeb L, Hellen P, Boehnke C, et al. IL-1β stimulates COX-2 dependent PGE2 synthesis and CGRP release in rat trigeminal ganglia cells[J]. PLoS One, 2011, 6(3):e17360.
(本文编辑:时秋宽)
Expression of the relevant active substances in rat models of migraine
DONGXiaomeng,JINGLong,CHENJinbo*.
*Department of Neurology, The Affiliated Hospital of Binzhou Medical University,Binzhou Shandong 256603,China
CHENJinbo,Email:chenjinbo6720@126.com
ObjectiveToobservetheexpressionofthephosphorylatedformofextracellularsignal-regulatedkinase(p-ERK),calcitoningene-relatedpeptide(CGRP),andcyclooxygenase-2 (COX-2)inthepathogenesisofmigraineandtheconnectionsbetweenthethreesubstances.MethodsSixtyratswererandomlydividedintofourgroups:blank,normalsaline(NS),nitroglycerin(NTG),andelectricalstimulationgroups.TheNTGgroupandNSgroupwerethenrandomlydividedinto30min,1h,and3hgroupsbytheinjectiontime.Theelectricalstimulationgroupwerethenrandomlydividedintoelectricalstimulationoftrigeminalganglion(ESTG),shamgroup(SO),andnimesulide(NM)groups.Theduramater,TGandTNCwereresectedtodetecttheexpressionofp-ERK,CGRPandCOX-2byimmunohistochemistry.Results(1)ComparedtoNSgroup,theexpressionsofp-ERK,CGRPandCOX-2intheduramater,TGandTNCweresignificantlyenhancedinNTGgroup(P<0.01);andtheexpressionsofp-ERK,CGRPandCOX-2inalltheexaminedtissuesitesinESTGgroupwerealsosignificantlyenhancedcomparedtotheSOandblankgroup(P<0.01);(2)Theexpressionofp-ERKinthe30mingroupwashigherthanthe1hgroupandthe3hgroupafterNTGadministration,thengraduallydecreased; (3)TheexpressionsofthethreesubstancesinNMgroupwerelowerthantheESTGgroup(P<0.05).Conclusions(1)Theup-regulatedexpressionofp-ERK,CGRPandCOX-2isassociatedwiththeneurogenicinflammationandcentralsensitizationofmigraine,andp-ERKpotentiallytookpartintheearlyprocessofit; (2)Thereisacloserelationshipbetweenp-ERK,CGRPandCOX-2duringmigraine.
migrainedisorder;extracellularsignal-regulatedMAPkinases;calcitoningene-relatedpeptide;cyclooxygenase-2;nitroglycerin-inducedmigrainemodel;electricalstimulationofthetrigeminalganglionmodel;nimesulide
10.3969/j.issn.1006-2963.2015.01.009
滨州市科技发展计划项目(NO.2011ZC0908)
256603滨州医学院附属医院神经内科(董晓梦,陈金波);256603 滨州市人民医院特检科(荆龙)
陈金波,Email:chenjinbo6720@126.com
R747.2
A
1006-2963 (2015)01-0034-07
2014-04-16)

