司来吉兰对帕金森病模型大鼠结肠α-突触核蛋白和神经元型一氧化氮合酶表达的影响
毕树立 刘斌 成晓华 高海英 李世英
司来吉兰对帕金森病模型大鼠结肠α-突触核蛋白和神经元型一氧化氮合酶表达的影响
毕树立 刘斌 成晓华 高海英 李世英
目的 观察司来吉兰(selegiline)对帕金森病(Parkinson disease,PD)模型大鼠结肠功能障碍及结肠α-突触核蛋白(α-Synuclein,α-Syn)及神经元型一氧化氮合酶(neuronal nitric oxide synthase,nNOS)表达的影响,探讨司来吉兰对PD患者结肠功能障碍的治疗作用及可能机制。方法 将72只健康SD大鼠随机分为正常对照组、PD模型组和司来吉兰治疗组,后两组采用颈背部皮下注射鱼藤酮方法制备PD模型。模型组每天给予生理盐水灌胃,治疗组每天给予司来吉兰0.5 mg/kg灌胃。分别于治疗后4 d、8 d测定大鼠1 h粪便排出量及含水量,并采用免疫组化法和蛋白质印迹法检测结肠α-Syn和nNOS的表达。结果 (1)与对照组比较,模型组各时间点1 h粪便排出量及含水量均减少 (均P<0.01);与模型组相比较,治疗组各时间点1 h粪便排出量及含水量均增加(均P<0.05),且治疗8 d亚组高于治疗4 d亚组(均P<0.05)。(2)与对照组比较,模型组各时间点结肠α-Syn、nNOS表达均增加(均P<0.01);与模型组比较,治疗组各时间点结肠α-Syn、nNOS表达均降低(均P<0.05)。与治疗4 d亚组比较,治疗8 d亚组的α-Syn、nNOS表达含量降低(均P<0.05)。结论 司来吉兰能够改善PD大鼠结肠功能障碍,其作用机制可能与其抑制α-Syn、nNOS表达有关。
帕金森病;α突触核蛋白;一氧化氮合酶;结肠;司来吉兰
帕金森病(Parkinsondisease,PD)患者常伴便秘等肠道功能障碍[1]。PD典型的病理改变是黑质多巴胺能神经元胞质内出现形成路易体(Lewybody,LB) ,而α-突触核蛋白(α-Synuclein,α-Syn)是LB的主要成分,其能减少多巴胺的释放,同时在肌间及黏膜下神经丛神经元也存在相同的改变[2]。Drolet等[3]研究发现, 随着便秘等肠道功能紊乱症状的出现,PD大鼠肠神经系统会出现α-Syn的聚集,提示α-Syn的聚集与便秘相关。一氧化氮(NO)是肠神经系统内最主要的抑制性神经递质之一,在体内由一氧化氮合酶(NOS)催化产生,介导平滑肌的松弛效应。在PD大鼠的肠肌丛,特别是在NO能神经元中发现存在α-Syn阳性包涵体,证实NO能神经元受损可能与PD肠功能障碍有关[4]。司来吉兰是一种单胺氧化酶B抑制剂,具有抗氧化应激、保护线粒体功能、减少炎性反应及减少兴奋性毒性等神经保护作用,可延缓PD的进展,但其对PD模型大鼠结肠功能障碍有何影响尚不明确[5]。本研究采用颈背部皮下注射鱼藤酮制备PD大鼠模型,观察司来吉兰对PD模型大鼠结肠α-Syn和nNOS表达的影响,探讨司来吉兰对PD患者结肠功能障碍的治疗机制。
1 材料和方法
1.1 主要试剂与仪器 司来吉兰(批号H20040400,规格5mg/片),购自OrionCorporationEspoo(Finland);鱼藤酮(批号201212,粉剂,1g/瓶)购自北京博奥森生物工程有限公司;市售葵花油;SP-0023免疫组化试剂盒(批号201302)、兔抗大鼠α-Syn抗体(批号:130926,0.1mL/支)和兔抗大鼠nNOS抗体(批号:909086W,0.1mL/支)均购自北京博奥森生物工程有限公司;DAB显色试剂盒(批号:375230AJ,3mL/支)购自北京中杉金桥生物技术有限公司;SDS-聚丙烯酰胺凝胶电泳低分子量标准蛋白购自华美生物工程有限公司;奥林巴斯BX63全自动显微镜扫描系统由日本奥林巴斯公司提供。
1.2 实验动物 健康雄性SD大鼠72只,体质量250~300g,3~4月龄,由北京华阜康生物科技股份有限公司供给,合格证号:SCXK(京)2013-0013。在河北联合大学屏障环境动物实验室饲养,室温控制在(23±2)℃,自然光照,自由进食。适应饲养2周后,将大鼠随机分为正常对照组、PD模型组和司来吉兰治疗组,并根据预实验结果将各组随机分为模型制备成功后4d、8d两亚组。每组各12只大鼠,其中6只用于免疫组织化学法检测,6只用于Westernblotting法检测。
1.3 方法
1.3.1PD模型制备:采用颈背部皮下注射鱼藤酮制备PD模型[6]。以出现行为学改变作为判定模型成功的指标[7]。以行为学检测评分2~6分的大鼠为PD造模成功标准。
1.3.2 干预处理:模型制备成功后,对照组和模型组每天给生理盐水灌胃,治疗组每天给予司来吉兰0.5mg/kg灌胃,分别连续给药4d和8d。
1.3.3 1h粪便排出量及含水量测定:参照朱红灿等[4]方法检测。
1.3.4 免疫组化法检测α-Syn和nNOS表达:按试剂说明书操作要求检测各组α-Syn和nNOS阳性细胞表达。各组分别取6只大鼠,用10%(质量浓度)水合氯醛(3mL/kg)腹腔麻醉动物,麻醉后经4%(质量浓度)多聚甲醛灌流固定,剖腹后取大鼠结肠1.5~2.0cm,清洗干净结肠内容物,剪去结肠周围的脂肪和结缔组织,用4%(质量浓度)多聚甲醛固定24h。常规包埋、切片、脱蜡、水化、抗原修复;置0.3%(质量分数)过氧化氢20min,分别加入α-Syn抗体、nNOS抗体,4℃孵育过夜;PBS浸洗 5min×3 次,加入HRP标记二抗,37℃孵育 60min;PBS浸洗 5min×3 次。DAB显色,选取位置相近,结构相似的结肠部位,并于400倍镜下选取互不重叠的6个视野,观察每个视野中每100个细胞中α-Syn或nNOS阳性细胞的个数,取其平均值。
1.3.5 蛋白质印迹法检测α-Syn和nNOS蛋白表达:各组分别取6只大鼠,用10%(质量浓度)水合氯醛(3mL/kg)腹腔麻醉动物,取结肠1.5~2.0cm,清洗干净结肠内容物,剪去结肠周围的脂肪和结缔组织,即刻投入液氮,然后放入EP管中-80℃保存。取上述保存的冷冻结肠,提取结肠组织蛋白80μg,15%(质量浓度)SDS-PAGE电泳分离,以湿转法电转移至PVDF膜上,封闭液中封闭1h,然后分别加入稀释好的Ⅰ抗α-Syn(1∶1000)、nNOS(1∶1000),4℃孵育过夜,PBS洗膜,加入相应稀释好的二抗(羊抗兔1∶2000),37℃反应1h,洗膜,以ECL显色,胶片曝光显影,结果用ImageJ图像程序分析软件分析目的蛋白条带及内参的吸光度值,以两者的比值反映目的蛋白相对表达量。

2 结果
2.1 各组大鼠1h粪便排出量及含水率 模型组大鼠各时间点1h粪便排出量及含水率均低于对照组(均P<0.01);治疗组大鼠各时间点1h粪便排出量及含水率均高于模型组(P<0.05),且治疗后8d亚组大鼠1h粪便排出量及含水率高于治疗4d亚组(P<0.05)(表1)。
2.2 各组大鼠结肠α-Syn和nNOS免疫组化检测 对照组大鼠各时间点结肠可见少量α-Syn和nNOS阳性细胞表达。与对照组比较,模型组各时间点结肠α-Syn和nNOS阳性细胞表达均明显增加(均P<0.01);与模型组比较,治疗组各时间点结肠α-Syn和nNOS阳性细胞表达均明显减少(均P<0.01);与治疗4d组比较,治疗8d组大鼠各时间点结肠α-Syn和nNOS阳性细胞数降低(P<0.05)(表2)。
2.3 各组大鼠结肠α-Syn和nNOS蛋白表达 对照组大鼠各时间点结肠可见少量α-Syn和nNOS蛋白表达。与对照组比较,模型组各时间点结肠α-Syn和nNOS蛋白表达均明显增加(均P<0.01);与模型组比较,治疗组各时间点结肠α-Syn和nNOS蛋白表达均明显减少(均P<0.01);与治疗4d组比较,治疗8d组大鼠各时间点结肠α-Syn和nNOS蛋白表达降低(均P<0.05)(表3,图1~2)。

表 1 各组大鼠1 h粪便排出量及含水率的比较
注:与对照组比,*P<0. 01;与模型组比,△P<0.05, △△P<0.01;与治疗4天组比,▲P<0.05。表2、3同
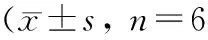
表 2 各组大鼠结肠α-Syn、nNOS阳性细胞数比较,个/高倍视野)

表 3 各组大鼠结肠α-Syn和nNOS蛋白表达检测(Western blot)结果

图1 各组大鼠结肠α-Syn蛋白 Western blotting结果
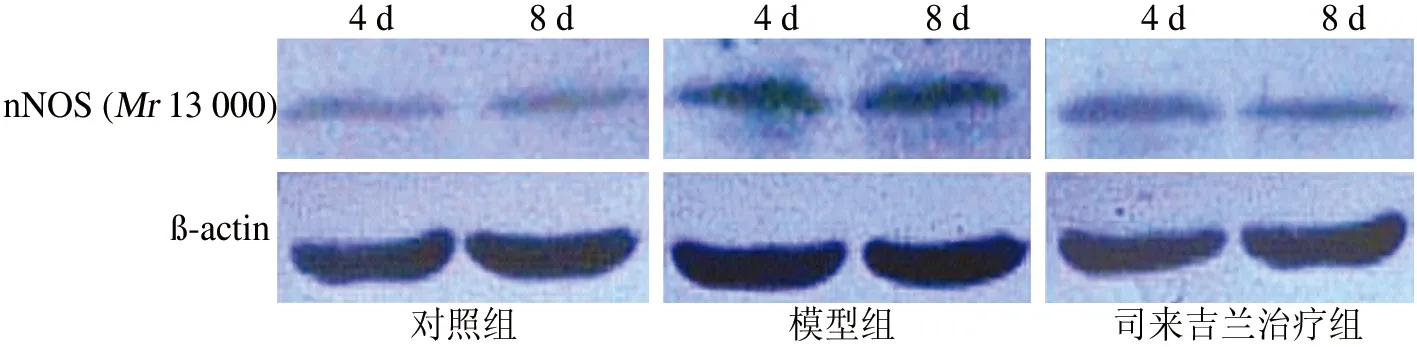
图2 各组大鼠结肠nNOS蛋白Western blotting结果
3 讨论
PD是一种常见中老年人的神经系统慢性退行性疾病,静止性震颤、肌强直、运动迟缓及姿势步态异常是其主要临床症状[8],但常伴便秘等肠道功能障碍[1]。PD的肠功能紊乱等非运动系统症状越来越受到临床关注[9],而便秘是PD患者肠功能紊乱的常见主诉[10]。研究表明,便秘的发生甚至早于PD运动障碍症状的出现[11],更有甚者,PD患者便秘早于锥体外系症状出现前10~20年[12]。本研究结果表明PD模型组大鼠1 h粪便排出量及含水量显著低于对照组,表明PD模型组大鼠结肠排空速度明显减慢,PD可引起结肠功能障碍。这与Greene等[10]报道的结果相一致。
中脑黑质多巴胺能神经元的变性丢失是PD 的主要病理改变,但PD肠功能障碍的发生机制目前尚不清楚。Lebouvier等[13]通过结肠镜取黏膜下丛组织活检证实PD患者黏膜下丛存在α-Syn,并且黏膜下丛存在α-Syn的患者便秘的发生率明显高于对照组。研究[2]发现,大脑和黏膜下神经丛都存在LB和α-Syn免疫反应的包涵体,认为PD病理改变可能开始于肠神经系统,并通过分布到肠道的迷走神经节前纤维逆行传入到中枢。朱红灿等[4]研究发现,6-羟基多巴胺(6-OHDA)组大鼠结肠肌间神经丛α-Syn表达显著增强,过度表达会导致细胞氧化应激增强,影响细胞的功能,从而引起肠功能障碍,进而推测PD患者便秘可能部分是由于直接损害肠神经系统所造成。NO是一种自由基性质的气体,NO可通过提高胃肠平滑肌内环磷酸鸟苷(cGMP)的浓度而导致平滑肌松弛,引起胃肠运动减弱;NO的半衰期短而难以控制,而NOS则相对稳定,NOS广泛分布于神经元中,并在神经系统损伤中的表达变化成为研究热点。一般将 NOS 分为神经元型(nNOS)、内皮型(eNOS)和诱导型(iNOS)。有报道[14]PD患者出现的便秘可能是由于nNOS在胃肠道蠕动反射中介导的下行性抑制作用受损所造成;另有学者报道,在采用 6-OHDA制备的PD模型的研究中,PD组nNOS阳性神经元和 nNOSmRNA 表达明显升高[15],而另一项研究结果则与之相反[16]。本研究的免疫组化法和蛋白质印迹检测结果均显示,模型组大鼠结肠α-Syn和nNOS的阳性细胞和蛋白表达均明显增多,表明结肠α-Syn和nNOS在PD的肠功能障碍发病中起重要作用。
司来吉兰(Selegiline)是一种常用的单胺氧化酶B抑制剂,它能选择性地抑制纹状体内促使多巴胺降解为高香草酸的单胺氧化酶(MAO-B),增加多巴胺的蓄积浓度;同时也减少多巴胺能神经元突触前膜对多巴胺的再摄取,促进了多巴胺的释放,延长外源性及内源性多巴胺的作用时间,使PD患者的临床症状得以改善[17],可用于PD 早期单药治疗及出现症状波动后的辅助治疗,司来吉兰具有神经保护作用[18],能够减慢和延缓疾病的进展,从而阻止PD进展。本研究各组大鼠1 h粪便排出量及含水量比较的结果显示,经司来吉兰治疗后,PD模型大鼠结肠排空速度明显增快,同时,本研究的免疫组化法和蛋白质印迹检测结果均显示,司来吉兰组大鼠结肠α-Syn和nNOS的表达含量均明显减少,并且随着时间的进展减少更明显,表明司来吉兰可能通过抑制PD大鼠α-Syn和nNOS的表达,发挥对结肠的保护作用,随着时间的延长,作用更明显。由此可知,司来吉兰能够改善PD患者的结肠功能障碍,其作用机制可能与其抑制PD模型大鼠结肠α-Syn和nNOS的表达有关。这可能为PD患者结肠功能障碍的防治提供了一定的理论依据。
[1]Pfeiffer RF. Gastrointestinal dysfunction in Parkinson’s disease [J]. Parkinsonism Relat Disord, 2011, 17(1): 10-15.
[2]Braak H, de Vos RA, Bohl J, et al. Gastric alpha-synuclein immunoreactive inclusions in Meissner’s and Auerbach’s plexuses in cases staged for Parkinson’s disease-related brain pathology [J]. Neurosci Lett, 2006, 396(1): 67-72.
[3]Drolet RE, Cannon JR, Montero L, et al. Chronic rotenone exposure reproduces Parkinson’s disease gastrointe-stinal neuropathology [J]. Neurobiol Dis, 2009, 36(1): 96-102.
[4]朱红灿, 赵静, 张华, 等. 帕金森病大鼠胃肠功能障碍的机制[J]. 临床神经病学杂志, 2011, 24(3): 202-205.
[5]Zhao Q, Cai D, Bai Y. Selegiline rescues gait deficits and the loss of dopaminergic neurons in a subacute MPTP mouse model of Parkinson’s disease[J]. Int J Mol Med, 2013, 32(4): 883-891.
[6]常宇涛, 罗小光, 任艳, 等. 鱼藤酮损伤大鼠黑质至行为学及黑质多巴胺能神经元损伤[J]. 解剖科学进展, 2011, 17(1): 60-62.
[7]陈忻, 张楠, 赵晖, 等. 鱼藤酮致帕金森病大鼠行为学与黑质病理损伤的关系[J]. 中国神经精神疾病杂志, 2008, 34: 232-234.
[8]刘斌, 孙静, 张晋霞, 等. 自噬及自噬相关蛋白在帕金森病模型大鼠黑质纹状体中的表达及意义[J]. 中国神经免疫学和神经病学杂志, 2014, 21(3): 187-191.
[9]Jost WH. Gastrointestinal dysfunction in Parkinson’s disease [J]. J Neurol Sci, 2010, 289(1-2): 69-73.
[10]Greene JG, Noorian AR, Srinivasan S. Delayed gastric emptying and enteric nervous system dysfunction in the rotenone model of Parkinson’s disease [J]. Exp Neurol, 2009, 218(1): 154-161.
[11]Abbott RD, Ross GW, Petrovitch H, et al. Bowel movement frequency in late-life and incidental Lewy bodies [J]. Mov Disord, 2007, 22 (11): 1581-1586.
[12]Ueki A, Otsuka M. Life style risks of Parkinson’s disease: Association between decreased water intake and constipation [J]. Neurol, 2004, 251(Suppl7): vII18-23.
[13]Lebouvier T, Neunlist M, Stanislas Bruley des Varannes, et al. Colonic biopsies to assess the neuropathology of Parkinson’s disease and it’s relationship with symptoms [J]. PLoS One, 2010, 5(9): e12728.
[14]Boeckxstaens GE, Pelckmans PA, Bogers JJ, et al. Release of nitric oxide upon stimulation of nonadrenergic noncholinergic nerves in the rat gastric fundus [J]. Pharmacol Exp Ther, 2009, 256(2): 441-447.
[15]朱红灿, 李倩倩, 赵静, 等. 左旋多巴对帕金森病大鼠结肠神经递质的影响[J]. 中国现代医学杂志, 2011, 21(20): 2365-2369.
[16]王伟, 张丽娟, 李燕, 等. 金森病模型大鼠结肠电机械活动的改变[J].首都医科大学学报, 2009, 30(4): 486- 493.
[17]杨新玲, 贾丛康, 张晨, 等.司来吉兰治疗帕金森病新进展[J].中国临床神经科学, 2008, 16(4): 407-410.
[18]Naoi M, aruyama W. Monoamine oxidase inhibitors as neuroprotective agents in age-dependent neurodegenerative disorders [J]. Curr Pharm Des, 2010, 16( 25) : 2799-2817.
(本文编辑:时秋宽)
Effects of selegiline on the expression of α-synuclein and neuronal nitric oxide synthase in colon of Parkinson’s disease model rats
BIShuli,LIUBin*,CHENGXiaohua,GAOHaiying,LIShiying.
*First Department of Neurology, the Affiliated Hospital of Hebei United University, Tangshan Hebei 063000, China
LIUBin,Email:liubintsh@126.com
ObjectiveToobservetheeffectsofselegilineoncolonicdysfunction,α-synuclein(α-Syn)andneuronalnitricoxidesynthase(nNOS)expressionsincolonofratmodelofParkinson’sdisease(PD),thentoinvestigatethetherapeuticaleffectandmechanismofselegilineoncolonicdysfunctionofPDpatients.MethodsSeventy-twoSDratswererandomlydividedintonormalcontrolgroup,PDmodelgroup,andselegilinetreatmentgroup.PDratsmodelwereestablishedbysubcutaneousrotenoneinjection.Afterthesuccessofmodelpreparation,PDgroupwasgivennormalsalinedaily,andtherapygroupwasgivenselegiline0.5mg/kgbyintragastricadministration.Atthetimepointof4dand8daftertherapy, 1hfecalexcretionandwatercontentwasassessed,andtheexpressionofα-SynandnNOSweredetectedbyimmunohistochemistryandwesternblotting.Results(1)Comparedwithcontrolgroup,modelgrouphadlower1hfecalexcretionandwatercontentateachtimepoint,andthedifferenceswerestatisticallysignificant(allP<0.01).Comparedwithmodelgroup, 1hfecalexcretionandwatercontentwereallincreasedintherapygroupateachtimepoint(allP<0.05),andintreatment8dsubgroup1hfecalexcretionandwatercontentwerehigherthanthoseoftreatment4dsubgroup(allP<0.05). (2)Comparedwithcontrolgroup,inmodelgroupateachtimepoint,theexpressionsofα-SynandnNOSweresignificantlyincreased(allP<0.01).Comparedwithmodelgroup,intreatmentgroupateachtimepoint,theexpressionsofα-SynandnNOSpositivewerealldecreased(allP<0.05);comparedwithtreatment4dsubgroup,theexpressionsofα-SynandnNOSweredecreasedintreatment8daysubgroup(allP<0.05).ConclusionsSelegilinecanimprovecolonicdysfunctioninPDrats,anditsmechanismmayberelatedtotheinhibitionofα-SynandnNOSexpressionsincolonofPDmodelrats.
Parkinson’sdisease;alpha-synuclein;nitricoxidesynthase;colon;selegiline
10.3969/j.issn.1006-2963.2015.01.007
唐山市科学技术研究与发展指导计划资助项目(项目编号: 13130292a)
063000 河北联合大学附属医院神经内一科〔毕树立(现工作于开平区医院急诊科)、刘斌、成晓华、李世英〕;063300 唐山市丰南区医院神经内科 (高海英)
刘斌,Email:liubintsh@126.com
R742.5
A
1006-2963 (2015)01-0025-05
2014-07-27)

