紫外分光光度法测定饮料中糖精钠的含量
宗水珍,王礼风,王 彬
(常熟理工学院 化学与材料工程学院,江苏 常熟 215500)
近年来,随着生活水平的提高,人们对饮品的质量和安全性的要求越来越高,发现的问题也越来越多.因此,找到更快捷、简单并能广泛应用的食品安全检测方法迫在眉睫.糖精钠(Sauharin Sodium)是饮料中常用的一种人工合成甜味剂[1-2],学名邻磺酰苯酰亚胺钠,分子式为C7H4O3NSNa·2H2O,相对分子质量241.19.有研究表明摄入大量的糖精钠会导致雄性大鼠患膀胱癌[3],过多摄入甜食及加糖饮料会增加人患胰腺癌的危险[4].美国肝脏疾病研究协会动物实验证明,含糖软性饮料同患肝病有关系.因此,世界卫生组织(WHO)规定糖精钠的人体每日允许摄入量ADI为0~0.005 g/Kg[5],中华人民共和国食品添加剂使用卫生标准GB276086规定糖精钠在蜜饯、冷饮类食品中的最大使用量为0.15 g/kg[6].因此,准确测定、严格控制食品中糖精钠的用量对保障食品安全和人体健康有重要意义.
目前测定糖精钠的方法有多种,主要有液相色谱法[7]、薄层色谱法[8]、非水滴定法[9]和极谱法[10]等,但由于设备昂贵、操作繁琐、耗时长、灵敏度较低[11]、污染等原因很难得到推广应用.
本文利用少量糖精钠可使亚甲基蓝的吸收增强,并且吸光度随糖精钠浓度的增加而增加,建立了亚甲基蓝-紫外分光光度法测定糖精钠的含量,并将此法用于饮料中糖精钠含量的测定,结果满意.
1 实验部分
1.1 仪器与试剂
TU-1901双光束紫外可见分光光度计(北京普析通用仪器有限责任公司);pHS-3C型精密pH计(上海精密科学仪器有限公司);电子分析天平(常熟市衡器厂).0.2 mg/mL糖精钠标准溶液:准确称取在120℃下烘干4 h的糖精钠0.1702 g,用水溶解,再定量转移到1000 mL容量瓶中定容;0.25 mg/mL亚甲基蓝溶液;pH=7.0的B-R缓冲溶液;其他试剂均为分析纯,实验用水为二次蒸馏水.
1.2 实验方法
精确移取一定量的糖精钠标准溶液于10 mL比色管中,再依次加入0.5 mL亚甲基蓝溶液和1 mLB-R缓冲溶液,加二次蒸馏水至刻度线,摇匀.在240~280 nm范围内测其吸光度曲线(查文献可知,亚甲基蓝在250 nm左右处有最大吸收波长),取其在最大波长处吸光度,即247 nm.另取一10 ml比色管,不添加糖精钠标准液,并按照上述实验方法操作,分别测定两个体系的吸光度A与A0,计算出△A(△A=A-A0),以△A对糖精钠标准溶液的浓度C作图,绘制出糖精钠浓度校准曲线,由样品测量出的△A就可以计算出糖精钠的含量.
2 结果与讨论
2.1 吸收光谱曲线
不同溶液在紫外分光光度仪上的吸收曲线如图1所示,亚甲基蓝以及亚甲基蓝与糖精钠形成的缔合物在247 nm处有最大吸收峰.曲线1表明,当体系中不加入亚甲基蓝,仅有糖精钠与B-R缓冲液时,糖精钠-B-R体系在247 nm处吸收峰很弱,说明糖精钠与B-R缓冲液在247 nm处对亚甲基蓝以及亚甲基蓝与糖精钠形成的缔合物在此处的吸光度的干扰很小;曲线2、3表明,固定其他条件,体系中加入少量糖精钠时,体系在247 nm处的吸光度显著增强.曲线3、4、5表明在糖精钠-亚甲基蓝-B-R缓冲溶液体系中,随着糖精钠浓度的增加,体系吸光度随之增加,由此推测,该体系吸光度的增长值△A与糖精钠加入量有线性关系,因此选择在247 nm处测定该体系的吸光度.
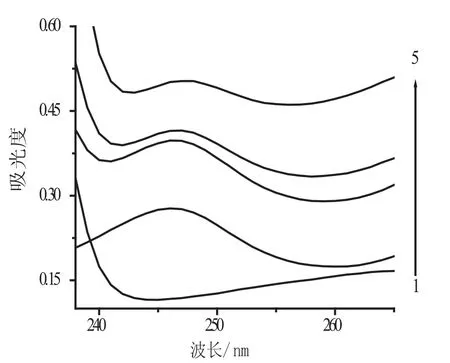
图1 吸收光谱曲线图
2.2 缓冲溶液的选择
图2所示的是糖精钠和亚甲基蓝在不同缓冲溶液中的相对吸光度,B-R缓冲溶液的相对吸光度(△A)远远大于其他四种缓冲溶液,说明糖精钠和亚甲基蓝所形成的络合物在B-R缓冲溶液中测定效果更好,所以选择B-R缓冲溶液.
2.3 缓冲溶液酸度对体系的影响
缓冲溶液pH=7.0时体系的△A值最大,且通过实验知,加入缓冲液体积为1 mL时,体系最为稳定,所以选择在体系中加入pH=7.0的B-R缓冲溶液1 mL.
图2 不同缓冲溶液吸收曲线图
2.4 染色剂用量的影响
在固定其他条件不变时,染色剂加入量为0.5 mL时,△A值达到最大值,故选择在体系中加入染色剂的量为0.5 mL.
2.5 反应时间的影响
在固定其他条件不变时,体系的反应时间在140 min内吸光度无明显变化,本次实验选取反应时间为20 min.
2.6 反应温度的影响
在固定其他条件不变的情况下,测定体系温度在15~40℃之间的吸光度变化值.当体系的温度在20~30℃之间时,体系的吸光度变化较小,可以忽略,而当温度低于20℃或高于30℃时,体系的吸光度变化较大,测定时会存在较大的误差,故本实验选择体系反应的温度为20~30℃.
2.7 干扰实验
运用控制变量法,在控制其他实验条件不变的前提下,向体系中加入糖精钠浓度100倍的干扰离子,测定其是否存在干扰.测定误差都在±5%以内,100倍Cl-、I-、NO3-、SO42-、K+、Na+、NH4+、Ca2+、Mg2+、Zn2+、Al3+、Ni2+、Ba2+、Cd2+、Mn2+、Pb2+对体系的测定无干扰.
2.8 校准曲线的绘制
通过控制变量法,控制实验在最佳条件下,以不加糖精钠的溶液体系为空白样,并测定其吸光度(A0);再测定加入不同量糖精钠的标准溶液的吸光度(Ai),并计算出其相对吸光度ΔA(ΔA=Ai-A0),最后再以不同浓度糖精钠标准溶液的ΔA对其浓度C绘制校准曲线,如图3所示.当糖精钠的浓度在0.08~44 ug/mL之间时,其相对吸光度(ΔA)与糖精钠的浓度C之间的线性关系非常好,其线性回归方程为△A=0.02034+0.00484×C,线性相关系数为r=0.99994,并且最小检出限为0.004 μg/ml.
2.9 实际样品分析
取雪碧、苹果醋、冰糖雪梨饮料100 ml于蒸发皿中,加热去除CO2.把浓缩样转移至150 ml烧杯中,加入5 g NaCl,0.6 ml H3PO4和几粒沸石,加热煮沸15 min,冷却后用水定容至250 ml[11].用此法处理实际样品的结果令人满意,能够有效消除实际样品中苯甲酸、山梨酸等物质对体系吸光度产生的影响.按照实验方法测定样品中糖精钠含量,通过△A与浓度C的关系,计算出食品中糖精钠的含量,结果见表1,并将结果与国标法相比较,由表1得到的结果与高效液相色谱法测定的糖精钠含量基本相同.

图3 △A对糖精钠浓度的校准曲线
2.10 加标回收实验
分别移取一定量的样品试样,再分别加入不同量的糖精钠标准溶液,按照试验方法做加标回收实验,结果如表2所示.从表2可以得出,加标回收率在98.17%~103.25%之间,结果令人满意,说明该实验方法的准确度很好.

表1 实际样品分析
3 结论
本文运用紫外分光光度法测定雪碧、苹果醋和冰糖雪梨饮料中糖精钠含量,得到苹果醋为0.113 g/kg,而雪碧与冰糖雪梨中未检出,这与国标法所测定的结果基本相同,加标回收率:98.17%~103.25%,相对标准偏差(n=6)均小于5.0%.本法具有干扰少、灵敏度较高、线性范围较宽、操作快速简单、节省试剂等特点,对于饮料中糖精钠含量的测定较为理想.
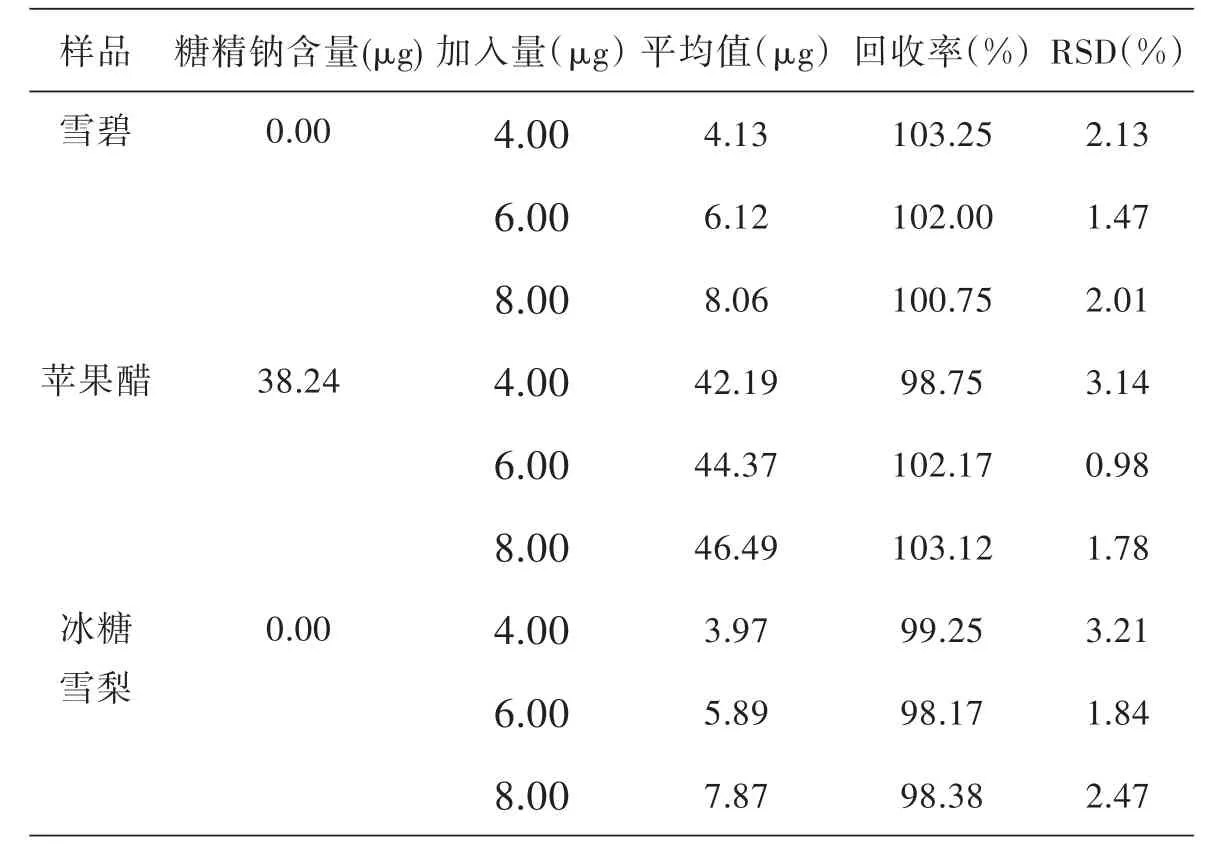
表2 加标回收实验
[1]周彤,戈早川.多波长线性回归导数分光光度法同时测定饮料中糖精钠和苯甲酸[J].分析试验室,1999,18(3):87-89.
[2]张国胜,董学芝,王爱芳,等.甲基紫-糖精钠体系共振瑞利散射光谱的研究及其应用研究[J].分析试验室,2008,27(增刊):358-361.
[3]Suzanne D T,Helen T Walter P,et al.The male rat carcinogens limonene and sodium sacchar in are not m utagenic to male Big Blue rats[J].Muta⁃genesis,2001,16(4):329-332.
[4]Susanna C L,Leif B,Alicja W.Consumption of sugar and sugar-sweetened foods and the risk of pancreatic cancer in a prospective study[J].Ameri⁃can Journal of Clinical Nutrition,2006,84(5):1171-1176.
[5]Qing C C,Wang J.Simultaneous determination of artificial sweeteners,preservatives,caffeine,theo⁃bromine and theophylline in food and pharmaceu⁃tical preparations by ionchromatography[J].J Chro⁃matogr A,2001,937:57-64.
[6]中国预防医学科学院标准处.食品卫生标准汇编(2)[S].北京:中国标准出版社,1992:133.
[7]Dossi N,Rtoniolo,Susmel S,et al.Simultaneous RP-LC determinati on of Additives in Soft Drinks[J].Chromatographia,2006,63(11-12):557-562.
[8]刘维华,郭银燕.薄层层析法同时测定饮料中甜蜜素和糖精钠[J].中国公共卫生,2000,16(8):766.
[9]李侠,武传贵.非水滴定法快速测定食品中的糖精钠[J].山东化工,2006,35(2):31-32.
[10]郑世荣.食品中糖精钠含量的极谱分析法[J].分析化学,1978,7(2):161.
[11]焦嫚,董学芝,胡卫平,等.结晶紫-紫外分光光度法测定食品中糖精钠的含量[J].光谱实验室,2010,27(1):287-290.

