摇蚊幼虫存活条件优化
徐建荣,蒋金成,曹 昆 ,李 明 ,韩晓磊
(常熟理工学院 生物与食品工程学院,江苏 常熟 215500)
摇蚊幼虫(Chironomid Larvae)又名血虫,在各类水体中都有广泛分布,其生物量常占水域底栖动物总量的50%~90%,是多种经济水生动物的优良天然饵料.世界上已知的摇蚊科昆虫约有5000种,中国最早的摇蚊记录是Wiedemann于1828年记载的Chironomus venastus.其蛹羽化后的成虫与常见的蚊类成虫比较相似,但主要的不同在于触角上密生细毛,如羽毛状,其次是它的口器(口针)已退化,不具吸食的功能[1-3].摇蚊生长快,繁殖力强,适宜人工培育.日本学者代田昭彦利用有机泥和下水道淤泥进行流水培养实验.获得每平方米活体质量为800 g的摇蚊幼虫产量[4].此外,摇蚊幼虫的饲养,不仅可为生态毒理学研究提供试验对象[5-7],还可利用摇蚊幼虫种类的敏感性和耐污染特性,反映水中的成分变化和污染程度,将其作为监测水体污染的主要指示生物[8-9].摇蚊幼虫营养丰富,蛋白质含量占干物重的41%~62%,脂肪占2%~8%.摇蚊幼虫是重要的水生生物资源,对维持和促进渔业发展,关系重大[10].又因其区系组成与环境性能有密切关系,其群落组成和变化能反映环境的变动情况[11],已被广泛应用于水环境的监测和评价.由于摇蚊幼虫繁殖较慢,且不容易保活,在市场上价格昂贵.本实验旨在对摇蚊幼虫暂存条件优化,延长摇蚊幼虫的存活周期,降低摇蚊幼虫作为饵料的成本,对渔业的发展具有重要意义.
1 材料与方法
1.1 实验地点与试验材料
本实验在常熟理工学院笃行楼水生生物实验室进行,实验所用摇蚊幼虫均为从市场上采购所得.
1.2 试验方法
1.2.1 摇蚊幼虫的培养
将称好的幼虫转移到盒内,盒子规格为长11 cm、宽7.5 cm、高6 cm,每个盒内按表1列出的试验顺序各加入对应的水量,贴好标签,随后按表2列出的试验顺序按标签将对应的盒子分别放入5℃、10℃、15℃、25℃的保温柜中养殖一个月.
在培养过程中,每天下午对各个保温柜中盒内的摇蚊幼虫进行换水,换进的水的水温需与当前盒内水的温度一致,并将死去的幼虫挑去,以保持水的清洁,每天用温度计观察盒内水的温度.一个月后将盒内水分用滤网滤干,用天平称得各盒内摇蚊幼虫的质量,求出各个盒内摇蚊幼虫的存活率.
1.2.2 单因素试验
分别考察温度(5、10、15、25 ℃)、质量(10、20、30、50 g)、水量(50、100、150、200 ml)对摇蚊幼虫存活率的影响.
1.2.3 正交试验
根据单因素的试验结果,设计正交试验的因素水平,(见表1),优化摇蚊幼虫存活率的条件.

表1 正交试验因素与水平
1.3 数据处理
参数计算依据及公式[12-13]为:
总偏差平方和(Total Bias Squares,SK)

因子偏差平方和(Factor Bias Squares,S)

均方和(Mean Squares,MS)

纯偏差平方和(Pure Bias Squares)

贡献率(Contribution Percentageρ因)

整个试验先采用单因素试验,随后采用正交试验,实验结果进行统计分析,每组试验都进行了1次重复.然后使用方差分析对可能影响摇蚊幼虫存活率的三个因素即温度、密度、水量进行显著性检验.
2 结果与分析
2.1 单因素试验
2.1.1 温度对摇蚊幼虫存活率的影响
在质量为30 g,水量为200 ml,保活温度分别为5℃、10℃、15℃、25℃时,培养一个月,摇蚊幼虫存活率见图1.
由图1可知,随着温度的升高,摇蚊幼虫存活率大幅度下降.温度越高,摇蚊幼虫新陈代谢越快,耗氧量增大.因此,在5℃~25℃范围内,保活温度选择在5℃较适宜.
2.1.2 质量对摇蚊幼虫存活率的影响
在温度为 5 ℃,水量为 200 ml,质量分别为 10、20、30、50 g时,培养一个月,摇蚊幼虫存活率见图2.由图2可以看出,随着质量的增加,摇蚊幼虫的存活率没有明显变化,都维持在90%左右.结果说明摇蚊幼虫能够在高密度环境下存活.
2.1.3 水量对摇蚊幼虫存活率的影响
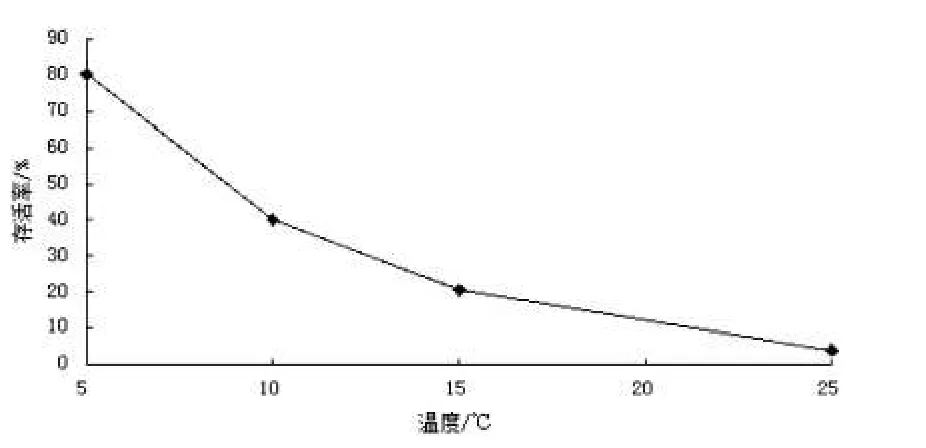
图1 温度对摇蚊幼虫存活率的影响
在温度为5 ℃,质量为30 g,水量分别为50 ml、100 ml、150 ml、200 ml时,培养一个月,摇蚊幼虫存活率见图3.
由图3可见,随着水量的增加,摇蚊幼虫存活率几乎没有变化.结果表明水量在50 ml~200 ml的变化对摇蚊幼虫存活率没有显著影响.

图2 质量对摇蚊幼虫存活率的影响
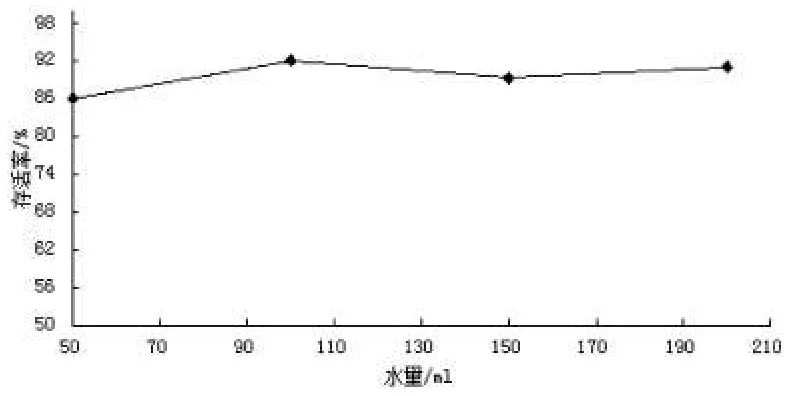
图3 水量对摇蚊幼虫存活率的影响
2.2 正交试验
为了确定在多因素条件下摇蚊幼虫存活的最佳条件,在单因素的基础试验的基础上,选择合适的参数范围,对温度(A)、质量(B)、水量(C),采用 L16(45)进行正交试验,优化最佳存活条件见表2.
从表2中直观分析得:Y=74.56存活率最高,最佳试验条件为AIB4C4.由于RA>RB>RC,因此因素重要性为A→B→C,最佳条件是AIB4C4.
假定试验指标服从正态分布用总偏差平方和SK描述数据的总波动,用SA表示除随机原因外(A因子偏差平方和)由于A因子的水平不同所引起的数据波动的变量.∵A至于第一列,∴SA=S1,B、C分别至于第二、三列,∴SB=S2,SC=S3.第四、五列为空白列(表上没有列出),仅反映误差造成的数据波动,称为误差的偏差平方和.
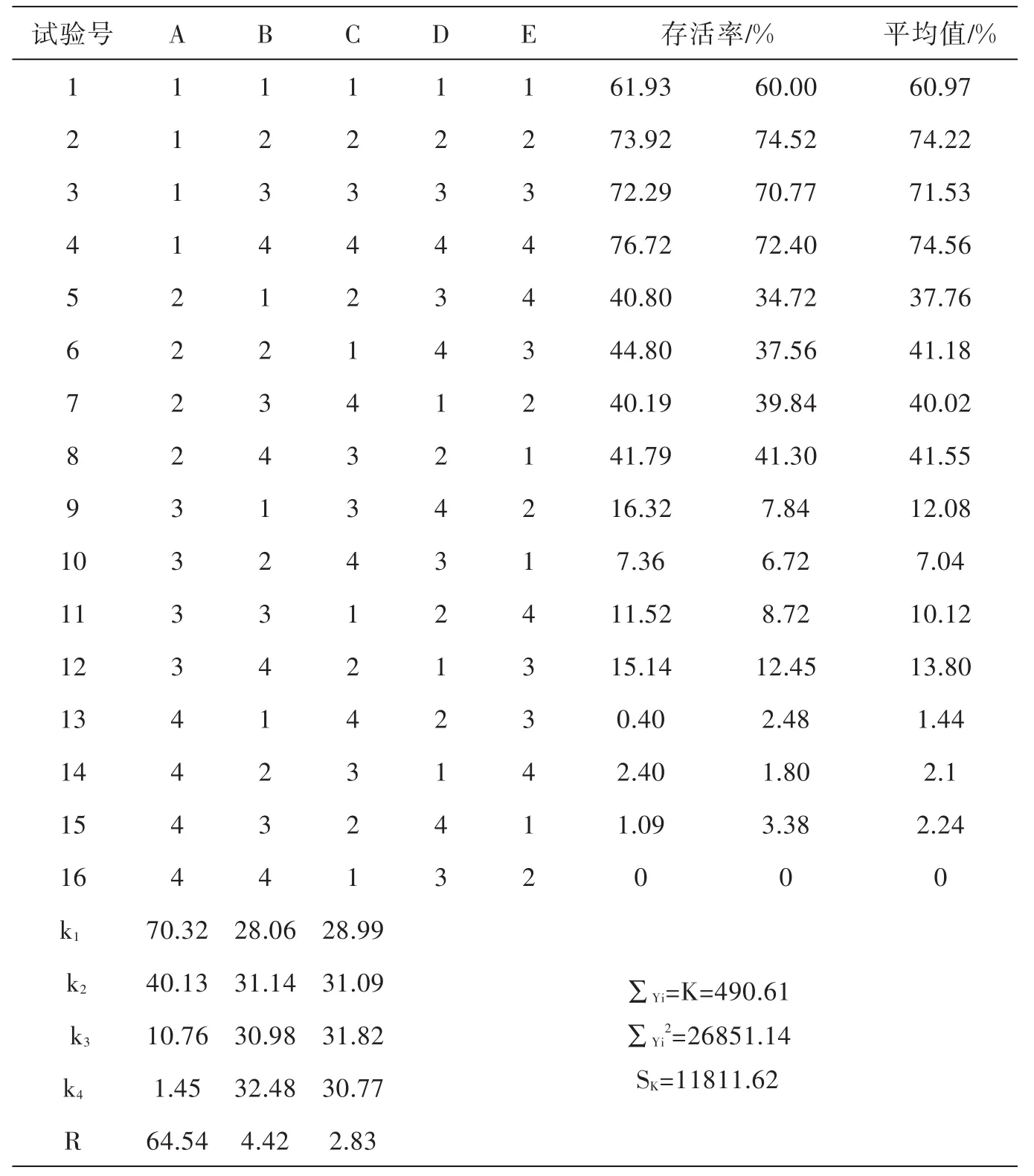
表2 L16(45)正交试验设计及结果
若 F因 =V因 /Ve>F1- α( f因,fe),则认为在显著水平α上因子是显著的.由于FA大于F3,6=4.757,因此因子A是显著的,因子B,C不显著,最佳条件的选择A1,因子B、C水平可任意选取.
当试验指标不服从正态分布时,进行方差分析的依据就不够充分,此时可以用贡献率来衡量因子作用的大小.由于S因中除了因子的效应外,还包括误差,从而称 S因-f因为因子的纯偏差平方和,称因子的纯偏差平方和与总纯偏差平方和的比为贡献率.
从表3中知因子A最重要,由A引起的波动占98.16%,因子B、C的贡献率不大,所以,B、C因子对摇蚊幼虫存活率的影响不显著.
2.3 水中溶解氧对摇蚊幼虫体色的影响
图4中,A、B、C、D四个盒内摇蚊幼虫的质量分别为10 g、20 g、30 g、50 g,四个盒内水量一致,测出A、B、C、D四个盒内水的溶解氧分别为4.6,2.0,1.6,0.7 mg/L.从图中可以很明显地看出摇蚊幼虫体色的鲜红程度为:A>B>C>D.说明摇蚊幼虫生活的水体中溶解氧越高,则摇蚊幼虫体色的鲜红程度越明显.
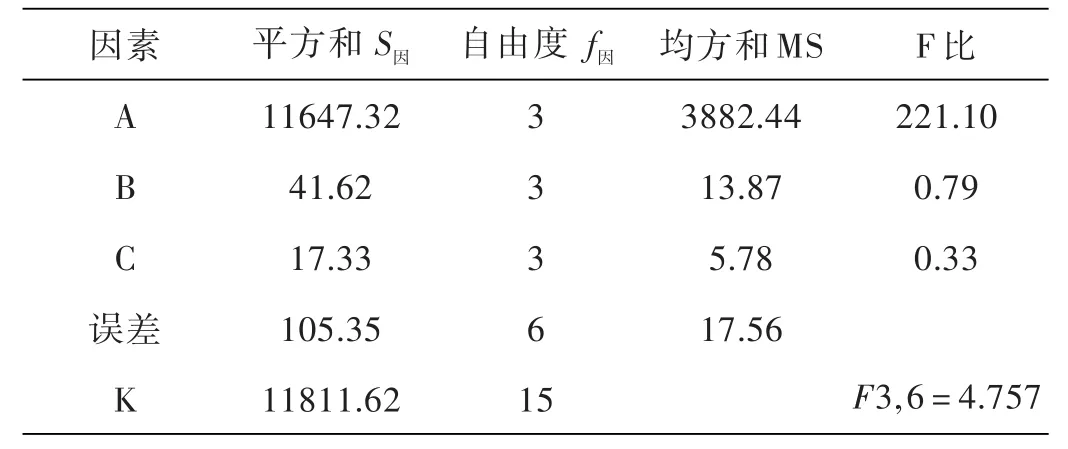
表3 L16(45)正交试验优化条件方差分析
3 讨论
3.1 温度对摇蚊幼虫存活率的影响
实验结果表明,温度是影响摇蚊幼虫存活率的最关键因素,温度越高,存活率越低.图5是摇蚊幼虫存活率与单因素温度的关系曲线.从图5中我们可以看到随着温度的升高,摇蚊幼虫的存活率呈直线下降状态.温度越高,新陈代谢越快,耗氧量增大,导致摇蚊幼虫生活环境恶化,如不及时换水就会影响其成活活率.图5显示当温度降到5℃时,存活率最高,但0℃环境下摇蚊幼虫不能存活.在日常生活中,温度是水产品活体运输的重要影响因素之一,而降低环境温度可减少水产品耗氧量、降低其新陈代谢、减少水质恶化、提高成活率、延长保活时间,确保产品在运输、贮藏和销售中的品质稳定和食用安全.而影响保活的因素主要有温度、氧气及水质[14].早在1999年,刘淇等就对牙鲆进行了低温保活实验,并探讨了其保活过程中的生理变化情况.张瑞霞[15]等通过测定3.5℃、6.5℃、9.5℃、20.0℃4种水温下鲫鱼的存活率、血液生化指标、排泄物氨态氮含量以及鱼体肌肉质构、色度和理化指标的变化,观察低温处理对鲫鱼生化特性及肉质的影响.结果表明,在6.5℃水温下暂养5 d后存活率高达100%,同样,低温也适合摇蚊幼虫的保活.
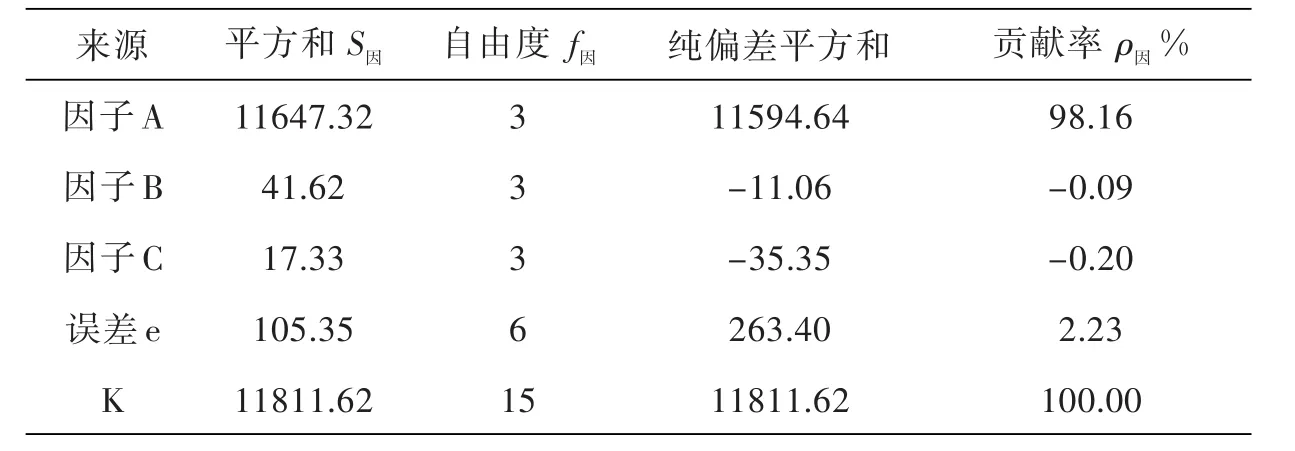
表4 因子与误差的差率

图4
3.2 水中溶解氧与摇蚊幼虫体色的关系
实验中发现处于水环境中的摇蚊幼虫,高密度时摇蚊幼虫的体色总体呈现暗黑色,低密度下时摇蚊幼虫呈现血红色.这是由于摇蚊幼虫在高密度时耗氧极快,水中溶解氧不足;而在低密度时摇蚊幼虫耗氧很慢,水中溶解氧较高.摇蚊幼虫体内含有血红蛋白,只有在有氧气时,血红蛋白才会与氧气结合成亮红色的氧合血红蛋白[16],从而使摇蚊幼虫身体呈现红色.所以,当将摇蚊幼虫暴露在空气中时,摇蚊幼虫的体色会比在高密度下生活的摇蚊幼虫的体色更加鲜红.当摇蚊幼虫质量增加时,若想保持摇蚊幼虫体色为血红色,则需要加入一定体积的水量保持水中溶解氧充足.

图5 摇蚊幼虫存活率与温度的关系
3.3 提高摇蚊幼虫存活率的有效方法
实验结果表明,在50~200 ml范围内,水量的变化对摇蚊幼虫的存活率没有显著影响.每天坚持换水能有效提高摇蚊幼虫的存活率.换水不仅能够提供摇蚊幼虫丰富的溶解氧,还能去除水体中摇蚊幼虫的排泄物,净化水质,从而改善摇蚊幼虫生活环境.此外,当摇蚊幼虫生活在有足够水量的环境中时,只要经常保持换水,摇蚊幼虫活力强盛;若摇蚊幼虫在浅水区生活,不能完全浸没在水体中时,摇蚊幼虫自身便会分泌出大量的深黄色絮状物来保护自己,活力减弱.刘伟东[17]等研究了大菱鲆在3℃±0.1℃条件下,有水和无水保活的成活率及生理变化情况.结果表明,有水保活72 h成活率达到100%,无水保活60 h成活率为95%.可见,对于生活在水环境中的摇蚊幼虫经常换水、保持适当的密度和低温是提高其存活率的有效方法.
[1]Armitage P D,Cranston P S,Pinder L C V.The Chironomidae Biology and ecology of norbiting midges[M].London:Chapman and Hall,1995:1-572.
[2]Sublette J E,Sublette MS.Family Chironomidae.In:Delfinado M&Hardy E D(eds.),Catalogue of the Diptera of the Oriental Re⁃gion[M].Honolulu:University Press of Hawaii,1973:389-422.
[3]王俊才,李开国.辽宁省摇蚊科幼虫分类与检索[M].沈阳:辽宁科学技术出版社,1989:1-107.
[4]代田昭彦.摇蚊幼虫的研究[M].北京:农业出版社,1986:1-186.
[5]Brooks B W,Turner P K,Stanley J K,et al.Wateborne and Sediment Toxicity of Fluxetine to Select Organisms[J].Chemsphere,2003,52(6):135-142.
[6]Vermeulen A C,Liberboo G,Dumont P,et al.Exposure of Chironomus riparius(Diptera)to Lead,Mercury and β-Sitosterol:Ef⁃fects on Mouthpart Deformation and Moulting[J].Chemosphere,2000,41(4):1581-1591.
[7]Martine E A,Moore B C,Schaumloffel J,et al.Morphological Abnormalities in Chironomus tentans Exposed to Cadmium-and Copper-Spiked Sediments[J].Ecotoxicology and Environmental Safety,2003,55(2):204-212.
[8]王俊才,方志刚,鞠复华.摇蚊幼虫分布及其与水质的关系[J].生态学杂志,2000,19(4):27-37.
[9]徐希莲.水生昆虫与水质的生物监测[J].莱阳农学院学报,2001,18(1):66-70.
[10]王波.摇蚊幼虫在水产上的应用[J]. 科学养鱼,2002,11(7):29.
[11]张平卿,王基琳.六盘山自然保护区的摇蚊科幼虫及国内新记录[J].宁夏大学学报:自然科学版,1987(1):70-86.
[12]吴翊.应用数理统计[M].长沙:国防科技大学出版社,1997.
[13]袁执法,周静芋.试验设计与分析[M].北京:高等教育出版社,2003.
[14]聂小宝,章艳,张长峰,等.水产品低温保活运输研究进展[J].食品研究与开发,2012,33(12):218-223.
[15]张瑞霞,张娟,熊善柏,等.低温处理对鲫生化特性及肉质的影响[J].华中农业大学学报,2008,27(4):532-534.
[16]汪青,项荣花,包永波,等.动物血红蛋白研究进展[J].宁波大学学报:理工版,2011,24(2):20-24.
[17]刘伟东,薛长湖,殷邦忠,等.低温下大菱鲆有水和无水保活过程中生理生化变化的研究[J].渔业科学进展,2009,30(5):69-74.

