湿疹纳米乳中丹皮酚包封率的测定
颜学军,陈光宇,钟 鸣,谢名君,康店如,何 群,2*
(1.湖南中医药大学药学院,湖南 长沙 410208;2.湖南省药学“十二五”重点学科,湖南 长沙 410208)
湿疹纳米乳中丹皮酚包封率的测定
颜学军1,陈光宇1,钟 鸣1,谢名君1,康店如1,何 群1,2*
(1.湖南中医药大学药学院,湖南 长沙 410208;2.湖南省药学“十二五”重点学科,湖南 长沙 410208)
目的 建立湿疹纳米乳中丹皮酚的包封率测定方法,用于评价湿疹纳米乳制备工艺。方法 采用葡聚糖凝胶G-50柱分离湿疹纳米乳中包封的丹皮酚与未包封的丹皮酚。HPLC法测定湿疹纳米乳中丹皮酚的含量,并计算其包封率。结果 纳米乳中丹皮酚的含量在0.4160~41.60 μg/mL浓度范围内线性关系良好,r为0.999 9,加样回收率平均值为98.43%,RSD为2.90%;纳米乳中丹皮酚的包封率值为 (92.43±0.44)%,RSD为0.43%(n=6),葡聚糖凝胶柱分离纳米乳上样回收率为 (90.5± 0.17)%,RSD为1.84%。结论 葡聚糖凝胶G-50可以将湿疹纳米乳和游离的丹皮酚较好地分开,湿疹纳米乳中丹皮酚的包封率测定方法可作为工艺研究的评价方法。
湿疹纳米乳;包封率;上样回收率;丹皮酚;葡聚糖凝胶G-50;徐长卿
湿疹纳米乳处方来源于湖南中医药大学皮肤科专家杨志波教授创制的治疗慢性湿疹的外用经验方,由徐长卿、苦参、黄柏等中药材提取的有效成分组成,前期药效及临床试验结果表明,该制剂具有止痒、抗菌、免疫抑制、抗炎作用,用于治疗慢性湿疹,疗效确切,无毒副作用。其中君药徐长卿提取的有效成分为丹皮酚,由于湿疹纳米乳工艺研究中需采用丹皮酚包封率作为评价指标,因此,本研究采用HPLC法测定丹皮酚含量,通过制备葡聚糖凝胶G-50分离湿疹纳米乳中包封的丹皮酚与游离的丹皮酚的流出曲线,研究湿疹纳米乳中丹皮酚包封率的测定方法,现报道如下。
1 仪器与试药
1.1 仪器
Agilent-1200高效液相色谱系统(美国安捷伦公司;包括G1311A四元梯度泵,G1313A标准型自动进样器,G1316A柱温箱,G1314A紫外检测器,Agilent Chemstation色谱工作站);AR124CN型电子天平(奥豪斯仪器有限公司);SK3300H型超声波清洗机(上海科导超声仪器有限公司)。
1.2 试药及材料
丹皮酚对照品 (中国食品药品检定研究院,批号110708-200506,纯度≥99.68%);葡聚糖凝胶G-50(粒径:50~150 μm,国药集团化学试剂有限公司);湿疹纳米乳(自制);色谱级甲醇(Tedia公司,批号CAS-67-56-1),分析级甲醇(成都市科龙化工试剂厂,批号20140214011);重蒸馏水(自制)。
2 方法与结果
2.1 湿疹纳米乳制备
称取徐长卿药材提取物丹皮酚0.3 g、助乳化剂1.1 g、油相1.4 g、乳化剂4.6 g,混合搅拌使溶解,加蒸馏水15 mL搅拌使其溶解。将水相缓慢滴加至油相中,边加边搅拌,得到无色的澄清液体,即含药纳米乳。含药湿疹纳米乳中丹皮酚含量为8.919 mg/g,含药内相总体积为33 mL。同法制备缺徐长卿药材提取物的空白湿疹纳米乳。湿疹纳米乳三元相图见图1。
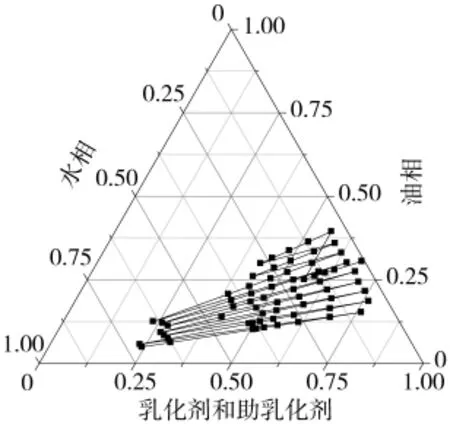
图1 湿疹纳米乳三元相图
2.2 湿疹纳米乳中丹皮酚含量测定方法的建立[1]
2.2.1 色谱条件与系统适应性试验 色谱柱为Ultimate XB-C18-ODS(4.6 mm×250 mm,5 μm),流动相为甲醇-水(45∶55),检测波长为274 nm,流速为1 mL/min,柱温为30℃。
2.2.2 对照品溶液的制备 取丹皮酚对照品约0.01 g,精密称定,加5 mL甲醇溶解后转移至10 mL的容量瓶中,再加甲醇定容至刻度线,摇匀,精密吸取1 mL对照品溶液至25 mL的容量瓶中,用甲醇稀释定容至刻度,即得每mL含41.6 μg的丹皮酚对照品溶液。
2.2.3 丹皮酚标准曲线的制备 分别取上述丹皮酚对照品溶液0.1、0.2、0.4、0.8、1、2、10 mL,分别加甲醇稀释并定容至10 mL,摇匀,取适量用0.45 μm微孔滤膜过滤,进样量 20 μL,按“2.2.1”项下色谱条件测峰面积,以峰面积A为纵坐标、丹皮酚浓度C为横坐标进行线性回归,得回归方程为:

即丹皮酚在0.416~41.6 μg/mL范围内线性关系良好。
2.2.4 供试品溶液的制备 精密吸取湿疹纳米乳样品1 mL,置于锥形瓶中,加入50 mL甲醇,摇匀,精密吸取1 mL溶液,加甲醇定容至5 mL,取适量用0.45 μm微孔滤膜过滤,即得供试品溶液。
2.2.5 阴性对照品溶液的制备 精密吸取缺徐长卿药材提取物的湿疹纳米乳样品1 mL,同“2.2.4”项下方法制成阴性对照品溶液。
2.2.6 专属性试验 分别精密吸取对照品溶液、阴性对照品溶液、供试品溶液各20 μL,进样进行分析,色谱图见图2、图3。
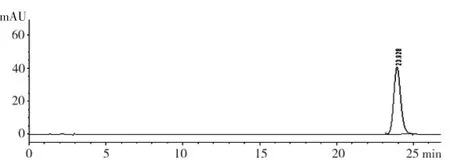
图2 丹皮酚对照品HPLC图
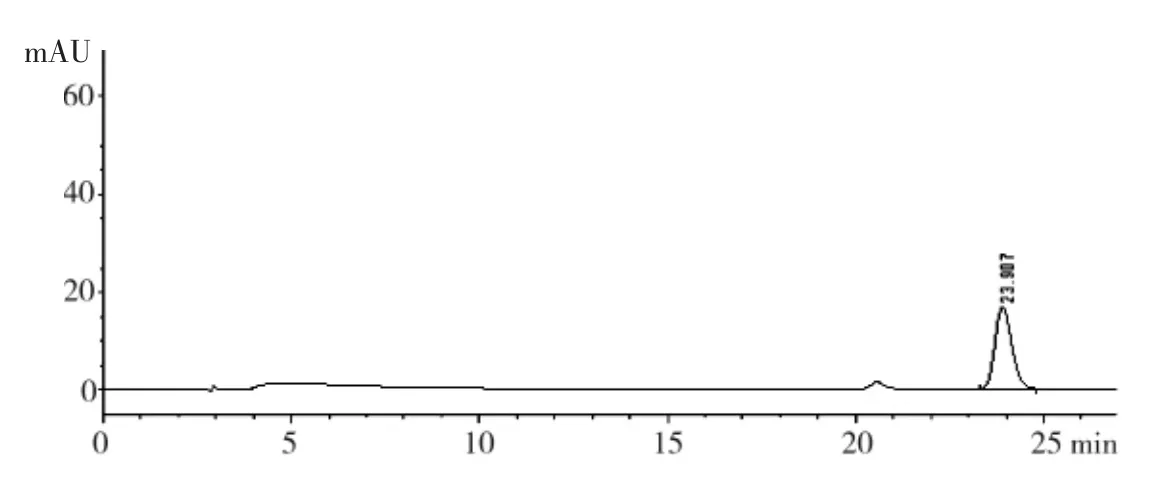
图3 湿疹纳米乳供试品HPLC图
由图2、图3、图4结果可知,供试品与对照品中丹皮酚峰在同一位置,阴性样品色谱在同一位置上无干扰,符合定量分析要求,可用于工艺研究。
2.2.7 湿疹纳米乳中丹皮酚含量测定方法学考察试验结果 精密试验结果RSD为0.99%(n=6),重复性试验结果表明,丹皮酚含量平均值为8.919 mg/g,RSD为1.77%(n=6),稳定性试验结果可知,从0到36小时各点的变异,即RSD为1.02%,表明36 h内稳定性良好,数据间的差异属取点误差,而非稳定性变化引起的。加样回收率试验结果表明,丹皮酚含量平均值为98.43%,RSD为2.90%(n=9),符合定量分析的规定,可用于湿疹纳米乳中丹皮酚含量测定。
2.3 纳米乳洗脱曲线的制备[2-4]
称取葡聚糖凝胶G-50 1.1 g于200 mL蒸馏水溶胀24 h,湿法装柱(内径1.0 cm,柱长45 cm),精密吸取0.2 mL湿疹纳米乳上样,用蒸馏水洗脱,流速0.6 mL/min,收集洗脱液,每3 mL 1管,共收集20管,将每管洗脱液转移至10 mL的容量瓶中,甲醇定容至刻度,摇匀后再吸取1 mL溶液至5 mL的容量瓶中,甲醇定容至刻度,摇匀后,用0.45 μm微孔滤膜过滤,在274 nm处按“2.2.1”项下色谱条件测定丹皮酚峰面积积分值,以管数为横坐标,丹皮酚峰面积积分值为纵坐标,绘制洗脱曲线,结果见图4。
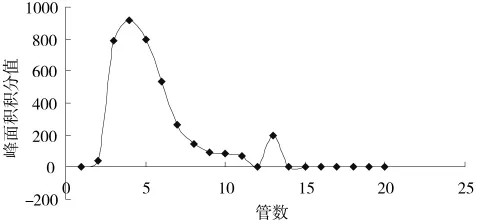
图4 湿疹纳米乳洗脱曲线
从图4中湿疹纳米乳洗脱曲线可知,纳米乳通过葡聚糖凝胶柱后,纳米乳与游离丹皮酚分离,前12管系纳米乳流出曲线,13管以后为游离丹皮酚流出曲线,因为葡聚糖凝胶分离系分子筛效应,即大分子(纳米乳)先被洗脱流出,小分子(游离丹皮酚)后被洗脱流出。
2.4 葡聚糖凝胶G-50前处理、上样及洗脱液样品处理
2.4.1 葡聚糖凝胶G-50的处理及上样实验方法 称取葡聚糖凝胶G-50 1.1 g,溶胀24 h,装柱及上样法同“2.3”项,蒸馏水洗脱,依照纳米乳洗脱曲线,先收集 12管前的 36 mL洗脱液,再收集 13管后的24 mL洗脱液。分别从收集的两部分洗脱液中精密吸取5mL洗脱液,置于10 mL的容量瓶中,甲醇定容至刻度线,摇匀,0.45 μm的微孔滤膜过滤,进样20 μL,按“2.2.1”项下色谱条件测定两部分洗脱液中丹皮酚含量。
2.4.2 湿疹纳米乳样品中丹皮酚投料量的测定精密吸取湿疹纳米乳1.0 mL置于10 mL的容量瓶中,甲醇定容至刻度,摇匀后再精密吸取0.5 mL的溶液,置于25 mL的容量瓶中,甲醇定容至刻度,摇匀,0.45 μm的微孔滤膜过滤,进样20 μL,供高效液相测定。
2.4.3 包封率计算 根据丹皮酚峰面积积分值,代入丹皮酚标准曲线方程,求出丹皮酚进样浓度,再按下式计算纳米乳包封率及上样回收率[5-6],见表1。
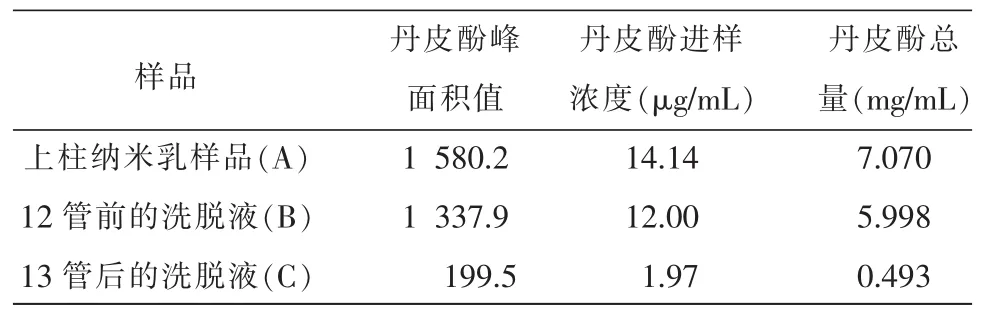
表1 包封率测定及计算结果

将表1中数据代入纳米乳包封率计算公式中,得包封率为92.41%,上样回收率为91.80%,其结果符合2010版《中华人民共和国药典》包封率不得小于80%有关规定。
按上述包封率测定方法,测定6批湿疹纳米乳样品中丹皮酚包封率均值为(92.43%±0.44)%,上样回收率为 (90.50±0.17)%包封率及上样回收率>80%,RSD<2%,可作为湿疹纳米乳制备工艺方法及工艺条件优化研究的评价指标。
3 讨论
3.1 葡聚糖凝胶类型的选择
目前常用的葡聚糖凝胶类型有G-50与G-25,预试验实验结果表明在湿疹纳米乳丹皮酚的洗脱曲线制备中,G-25与G-50的流出曲线基本相同,两者分离效果皆较理想,但是G-25的吸水能力差,所以用量大,载药量小,因此本实验选用葡聚糖凝胶G-50作为分离纳米乳中被包封丹皮酚纳米乳和游离丹皮酚的载体。
3.2 上样量及洗脱剂的选择
上样量与测定方法和层析柱的大小有关,如果检测方法灵敏度高或者柱床体积小,上样量可小,否则上样量需加大。一般来说,样品的上样量最好控制在柱床体积的1%~5%之间,最多不要超过10%,样品体积过大,分离效果不好。为了达到较好的分离效果本实验上样量0.20 mL,占柱体积的1.61%。层析柱一般用单一缓冲溶液或盐溶液作为洗脱液,有时甚至用蒸馏水作为洗脱剂。为了保持纳米乳在洗脱过程中的形态,避免洗脱剂的影响导致纳米乳在洗脱过程中破乳,从而影响分离效果,所以本实验经反复摸索,确定用重蒸馏水作为洗脱剂较合适。
3.3 测定上样回收率的意义
上样回收率也称为柱回收率,主要考察纳米乳通过葡聚糖凝胶到流出在整个上样、分离、洗脱过程中的损失,一般要求上样回收率不低于90%。
[1]陈光宇,毛骁丽,何群,等.HPLC测定湿疹纳米乳喷雾剂中丹皮
酚的含量[J].中国实验方剂学杂志,2012,18(24):98-100.
[2]郑稳生,方夏琴,张宇佳,等.多柔比星前体脂质体包封率测定及影响因素考察[J].医药导报,2012,31(11):1 497-1 499.
[3]陈大兵,张 强.紫杉醇表面修饰脂质纳米粒的制备和性质[J].北京大学学报:(医学版),2002,34(1):57-60.
[4]宋金春,黄 岭,陈佳丽.羟基喜树碱脂质体的制备及其包封率测定[J].中国医院药学杂志,2007,27(10):1 381-1 383.
[5]姜 展,刘 新,张桂平,等.复方辣椒碱纳米乳中辣椒碱包封率的测定方法研究[J].重庆医科大学学报,2011,26(2):195-197.
[6]赵菊香,程 怡,吴 琼,等.苦参素空间稳定脂质体的包封率测定和体外释放度考察[J].中国实验方剂学杂志,2013,19(3):4-7.
(本文编辑 苏 维)
Determination of Encapsulation Efficiency of Paeonol in Eczema Nanoemulsion
Xue-Jun Yan1,Guang-Yu Chen1,Ming Zhong1,Ming-Jun Xie1,Ding-Ru Kang1,Qun He1,2*
(1.School of Pharmacy,Hunan University of Chinese Medicine,Changsha,Hunan 410208,China;
2.Key Discipline of"Twelfth Five-Year"Pharmacy Plan in Hunan,Changsha 410208,Hunan China)
Objective To establish an encapsulation efficiency determination method of paeonol in eczema nanoemulsion for evaluating the preparation process of eczema nanoemulsion.Methods The paeonol of encapsulated and unencapsulated in eczema nanoemulsion was separated by Sephadex G-50 gel column,the concentration of Paeonol in the eczema nanoemulsion was detected by HPLC,then the encapsulation efficiency and column recovery rate of paeonol were calculated.Results The concentration of paeonol in nanoemulsion showed a fine linear relationship at 0.4160~41.60 μg/mL,with r values of 0.999 9, average recovery was 98.43%,with RSD of 2.90%.The average of encapsulatio efficiency was(92.43±0.44)%,with RSD of 0.43%.The column recovery rate was(90.50±0.17)%,with RSD of 1.84%.Conclusion Free Paeonol and eczema nanoemulsion can be separated perfectly by Sephadex G-50 column;the determination method of encapsulation efficiency of paeonol in eczema nanoemulsion can be used as evaluation index of processes study.
eczema nanoemulsion;encapsulation efficiency;column recovery rate;paeonol;Sephadex G-50;Cynanchum paniculatum
R283.6
A
10.3969/j.issn.1674-070X.2015.08.010
2015-04-16
国家科技部支撑计划资助项目(2008BAI53B042)。
颜学军,男,在读硕士研究生,研究方向:中药外用制剂、中药剂型与疗效的研究。
*何 群,女,教授,硕士研究生导师,E-mail:hequn88@126.com。

