钩端螺旋体脂多糖的结构和功能分析
夏碧丽,王砚春,郭晓奎,何 平,华允芬
钩端螺旋体脂多糖的结构和功能分析
夏碧丽1,2,王砚春2,郭晓奎2,何 平2,华允芬1
钩端螺旋体脂多糖(L-LPS)是钩体外膜上的主要成分,由O-抗原特异性多糖、核心寡糖和脂质A 3部分组成。L-LPS是一种重要的毒力因子,在钩体致病性、免疫性及与外部环境的相互作用中扮演着重要的角色。基于LPS结构特征的不同钩体分为不同的血清型。钩端螺旋体的LPS结构研究对于钩体的分子分型及钩体糖-偶联疫苗的开发具有重要意义。本文对L-LPS的结构、O-抗基因簇、生物学活性和钩体病预防方面的研究进展进行简要的综述。
钩端螺旋体;脂多糖;O-抗原簇;疫苗
钩端螺旋体病是由致病性问号钩端螺旋体(钩体)引起的全球广泛流行的人兽共患病,普遍流行于热带和亚热带地区[1]。我国大部分地区的气候条件适合钩体生长、繁殖,是主要的流行区之一。钩体可引起人类,牲畜和野生动物的感染,严重者可因肺弥漫性出血而死亡[2]。与其他一些主要的螺旋体如伯氏疏螺旋体不同,钩体的表面成分主要为脂多糖[3]。钩体脂多糖(L-LPS)不仅决定了钩体菌株血清学特异性[4],亦是一种重要的毒力因子,在钩体致病性、免疫性及与外部环境的相互作用中扮演着重要的角色[5-6]。研究L-LPS结构对于钩体的分子分型,钩体的致病性及钩体糖-偶联疫苗的开发具有重要意义。本文就L-LPS的研究现状做一综述。
1 L-LPS的结构特点
细菌的脂多糖由亲水性特异性多糖链(O-抗原)、非特异核心寡糖和疏水性脂质A 3部分组成。糖链暴露于细菌表面,由2~6个单糖组成的寡聚糖单位聚合组成,是LPS分子最容易变异的部分。O-抗原结构复杂多样,其组成的糖的种类多样,糖链的分支位点和长度也各不相同,决定了菌株血清学特异性[7]。核心寡糖由L-甘油-D-甘露庚糖(L,D-Hep)和2-酮-3-脱氧辛糖酸(KDO)组成,以共价键连接脂质A和O-抗原。脂质A是最保守的部分,是脂多糖的毒性和生物活性中心,但是单独脂质A部分的活性比完整的LPS低很多[8]。不同种属细菌的脂质A骨架基本一致,由磷酸化D-氨基葡萄糖双糖构成的亲水性骨架和疏水性脂肪酸链组成,主要差别是脂肪酸的种类和磷酸基团不同[7]。
钩体由于培养困难,其LPS结构研究亦极具挑战性。目前仅有问号钩体波摩那型菌株脂质A结构的报道,对于整个L-LPS结构仍未知,L-LPS糖链与其他细菌LPS有何差别也尚不明确[9]。经质谱和核磁共振分析发现,钩体脂质A 4条脂肪酸链均为N-酰基化脂肪酸链;脂肪酸链长度亦与一般的细菌的脂质A不同,而且有两条链含有不饱和键;最不寻常的是N-乙酰葡萄胺双糖的两端仅含一个甲基化磷酸基团(图1),该情况未在其他细菌的脂质A 中发现过[10]。
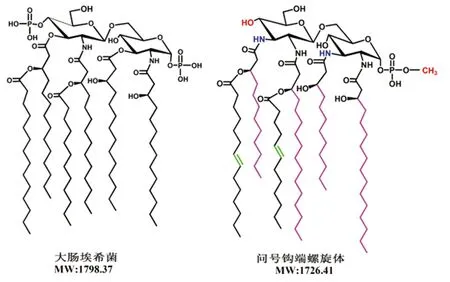
结构不同部分由不同颜色表示
The difference structure of lipid A between Leptospires andE.coliis denoted with different colors.
图1 大肠埃希菌和钩体两者的脂质A结构比较[9]
Fig.1 Comparative structure of lipid A fromEscherichiacoliand Leptospires
2 钩体O-抗原基因簇
革兰阴性菌中O-抗原结构的多样性是以O-抗原相关基因序列的多样性为基础的。血清型不同的细菌,其O-抗原相关基因也存在较大差异[11]。并且这些O-抗原相关基因常常在染色体上聚集在一起,形成一个基因簇[12]。钩体全基因测序并分析已确定了钩体LPS生物合成位点接近100个基因,主要覆盖了100 kb左右的基因组区域,比大肠埃希菌的O-抗原基因簇要大得多,推测钩体LPS结构非常复杂[3, 13]。根据O-抗原不同,钩体分为不同的血清型,经显微凝集试验和交叉凝集素吸收实验已分离并鉴定到200多个血清型[14-15]。然而交叉凝集素吸收实验操作复杂耗时,早期感染检测敏感性和特异性均较低。
目前,随着钩体基因组测序发展,通过对不同血清群钩体代表菌株的O-抗原相关基因进行分析,发现钩体中O-抗原两端是MarR 家族转录调节子的编码基因和硫酸钠转运体的编码基因,可以作为血清型钩体O-抗原基因簇始末的标记,并发现可使用PCR方法扩增O-抗原特异基因而进行血清群鉴定[16-17]。通常革兰阴性菌中的O-抗原特异基因的 PCR 的靶标基因如O-抗原翻转酶基因(wzx)和O-抗原聚合酶基因(wzy)在钩体中相似度极高[4]。而其它一些特有的功能酶基因,如犬群(Canicola)代表株桂44中脱氢鼠李糖还原酶(dehydrorhamnose reductase)基因是该血清群特异的;流感伤寒群(Grippotyphosa)代表株临六中,糖基转移酶(glycosyltransferase)是该血清群所特有的[4]。这些基因的序列与其它基因序列的相似度都比较低,适合作为PCR区分血清群的分子分型靶标。蔡成松等进一步对我国钩端螺旋体75株标准参考菌株以及40株野生分离菌株进行实验验证,证实了使用O-抗原特异基因区分血清群的可行性和可靠性[16]。
3 L-LPS生物学活性
细菌的LPS作用于机体内单核-巨噬细胞后,诱导其分泌多种细胞因子,在局部或随血液循环至全身各处而发挥其生物学效应[5]。研究发现大多数革兰阴性菌LPS的生物学活性作用涉及到TLR4,髓样分化蛋白2(MD-2)和CD14分子。CD14结合LPS并传递分子到MD-2[18]。当MD-2结合LPS分子的脂质A部分后,它经历一个结构变化,并形成了与TLR4相互作用的蛋白口袋[19]。这种相互作用启动细胞内TIR域聚到一起,形成一个位点使接头蛋白组装成寡聚体结构,并启动细胞内信号级联反应。
L-LPS与钩体的致病性密切相关。近年来有报道,LPS生物合成突变的Manilae血清型表现为对仓鼠的毒力减弱,无感染的临床体征[20]。该突变体也无法定植于小鼠的肾脏[21]。此外,亦发现钩体感染宿主后脂多糖代谢基因表达明显上调,说明L-LPS是致病性相关的重要分子[22]。与大多数细菌的LPS主要由TLR4识别不同,L-LPS在人类细胞中主要由TLR2/ TLR1识别[23]。而在小鼠中L-LPS即可由TLR4识别亦可通过TLR2识别[24]。其次,研究亦发现与宿主细胞作用时,L-LPS能刺激并诱导小鼠细胞表达相应的细胞因子,但诱导细胞因子表达水平比大肠埃希菌LPS刺激后要低得多[24]。L-LPS的生物学活性仅为大肠埃希菌LPS的1/10~1/100,与鲎试剂的反应亦非常弱[24]。其原因可能与钩体脂质A双糖骨架两端的4’-位磷酸基团缺失及甲基化有关[10, 25]。脂质A作为LPS重要的毒性组分,是模式识别受体识别配体的主要结构域,与天然免疫应答密切相关[19]。L-LPS在人和小鼠中识别的Toll样受体不同,可能与人感染后可以表现为严重的钩体病而小鼠感染钩体后症状轻微或无症状相关[9]。进一步研究L-LPS与不同宿主Toll样受体识别及相应天然免疫应答的差异,将对钩体致病机制有更深入的了解。
4 钩体 LPS在预防钩体病中的作用
LPS是钩端螺旋体外膜的主要成分,可引发保护性免疫,是钩体疫苗的主要组成成分[26]。已知抗L-LPS的单克隆抗体可以防止豚鼠和仓鼠的急性致死性感染[27]。其次在钩体病人的血清中也能够显著检测到L-LPS抗体的存在[28]。目前唯一批准上市的钩体疫苗即是以LPS为基础的全细胞灭活全菌疫苗。这一疫苗已广泛应用在牛、猪、狗和人。然而目前使用的钩体全菌疫苗存在较多缺陷。首先,钩体全菌疫苗引起的免疫反应由体液免疫介导[29]。并受L-LPS相关的血清型影响,不同血清型之间无交叉免疫。在多个血清型钩体流行的地区,需使用多价钩体疫苗[30-31]。其次,全菌疫苗所引起的免疫主要是针对L-LPS,为T细胞非依赖抗原,因此主要产生IgM抗体,缺乏记忆应答,免疫力的持续时间因此较短,需每年接种[32]。钩体新候选疫苗的研发成为近年来钩体研究领域的重点。新的候选疫苗的研究方向包括减毒活疫苗,重组蛋白疫苗及LPS偶联疫苗等,均处于探索初期阶段[32]。
L-LPS可引发保护性免疫,但持续时间较短。有研究者提出类似于流感嗜血杆菌的免疫偶联疫苗开发的可能性。研究发现L-LPS偶联白喉类毒素蛋白载体后可增强其免疫原性和保护性免疫[33]。其次在选择偶联载体蛋白时,选择包含2种或多种T细胞表位的载体蛋白,可诱导细胞介导免疫,产生记忆免疫,将有效增加疫苗保护时间[34-36]。但由于L-LPS有较多的血清型,且其结构复杂,糖链部分至今结构未知,钩体脂多糖-蛋白偶联疫苗的研发仍将是巨大的挑战。
5 展 望
尽管钩体发现迄今已有100余年,在L-LPS作用机制和预防钩体病方面已经取得许多成果,但L-LPS完整结构及与其特殊生物学活性之间关系至今仍不清楚。随着分子生物技术的发展和钩体全基因组测序完成,用生物信息学方法分析LPS的生物学功能将是一种较好的方法。其次钩体O-抗基因簇的确定使根据O-抗原特异基因进行血清群鉴定成为可能。进一步深入研究L-LPS的结构,亦将有利于钩体LPS-蛋白偶联疫苗的开发和L-LPS作用机制的研究,对疾病的防控将具有重要意义。
[1]Victoriano AF, Cavinta LL, Smythe LD, et al. Leptospirosis in the Asia Pacific region[J]. BMC Infect Dis, 2009, 9(147): 1-9.
[2]Assenga JA, Matemba LE, Muller SK, et al. Predominant leptospiral serogroups circulating among humans, livestock and wildlife in Katavi-Rukwa ecosystem, Tanzania[J]. PLoS Negl Trop Dis, 2015, 9(3): e0003607-e0003621.
[3]Ren SX, Fu G, Jiang XG, et al. Unique physiological and pathogenic features ofLeptospirainterrogansrevealed by whole-genome sequencing[J]. Nature, 2003, 422(6934): 888-893.
[4]Cai CS, Zhu YZ, Guo XK, et al. Development of O-antigen gene cluster-specific PCRs for rapid typing six epidemic serogroups ofLeptospirain China[J]. BMC Microbiol, 2010, 10(67): 1-6.
[5]Bazaka K, Crawford RJ, Ivanova EP, et al. Bacterial extracellular polysaccharides[J]. Adv Exp Med Biol, 2011, 715(13): 213-226.
[6]Murray GL, Srikram A, Adler B, et al. Mutations affectingLeptospirainterroganslipopolysaccharide attenuate virulence[J]. Mol Microbiol, 2010, 78(3): 701-709.
[7]Anwar MA, Choi S. Gram-negative marine bacteria: structural features of lipopolysaccharides and their relevance for economically important diseases[J]. Mar Drugs, 2014, 12(5): 2485-2514.
[8]Caroff M, Karibian D, Cavaillon NH, et al. Structural and functional analyses of bacterial lipopolysaccharides[J]. Microbes Infect, 2002, 4(9): 915-926.
[9]Werts C. Leptospirosis: a toll road from B lymphocytes[J]. Chang Gung Med J, 2010, 33(6): 591-601.
[10]Que-Gewirth NL, Ribeiro AA, Raetz RH, et al. A methylated phosphate group and four amide-linked acyl chains inLeptospirainterroganslipid A. The membrane anchor of an unusual lipopolysaccharide that activates TLR2[J]. J Biol Chem, 2004, 279(24): 25420-25429.
[11]Wang L, Wang Q, Reeves PR. The variation of O antigens in gram-negative bacteria[J]. Subcell Biochem, 2010, 53(6): 123-152.
[12]Stagg RM, Tang SS, Verma K, et al. A novel glucosyltransferase involved in O-antigen modification of Shigella flexneri serotype 1c[J]. J Bacteriol, 2009, 191(21): 6612-6617.
[13]Bulach DM, Zuerner RL, Adler B, et al. Genome reduction inLeptospiraborgpetersenii reflects limited transmission potential[J]. Proc Natl Acad Sci USA, 2006, 103(39): 14560-14565.
[14]Rajapakse S, Rodrigo C, Handunnetti SM, et al. Current immunological and molecular tools for leptospirosis: diagnostics, vaccine design, and biomarkers for predicting severity[J]. Ann Clin Microbiol Antimicrob, 2015, 14(2):1-8
[15]Bharti AR, Nally JE, Ricaldi JN, et al. Leptospirosis: a zoonotic disease of global importance[J]. Lancet Infect Dis, 2003, 3(12): 757-771.
[16]Cai CS. Comparative genomics ofLeptospiraand its application in serogroups typing[D]. Shanghai: Shanghai Jiao Tong University School of Medicine, 2010. (in Chinese) 蔡成松.钩端螺旋体比较基因组研究及其在分群方法中的应用[D].上海:上海交通大学医学院, 2010.
[17]Silva JB, Carvalho E, Rudy A, et al. Evaluation of the use of selective PCR amplification of LPS biosynthesis genes for molecular typing ofLeptospiraat the serovar level[J]. Curr Microbiol, 2011, 62(2): 518-524.
[18]Kawai T, Akira S. The role of pattern-recognition receptors in innate immunity: update on Toll-like receptors[J]. Nat Immunol, 2010, 11(5): 373-384.
[19]Park BS, Song DH, Lee JO, et al. The structural basis of lipopolysaccharide recognition by the TLR4-MD-2 complex[J]. Nature, 2009, 458(7242): 1191-1195.
[20]Srikram A, Zhang K, Murray GL, et al. Cross-protective immunity against leptospirosis elicited by a live, attenuated lipopolysaccharide mutant[J]. J Infect Dis, 2011, 203(6): 870-879.
[21]Marcsisin RA, Bartpho T, Murray GL, et al. Use of a high-throughput screen to identifyLeptospiramutants unable to colonize the carrier host or cause disease in the acute model of infection[J]. J Med Microbiol, 2013, 62(10): 1601-1608.
[22]Zhang CL. Responses ofLeptospirainterrogansto host innate immunity: modification, increasing quantity and activity of LPS[D]. Hangzhou: Zhejiang University School of Medicine, 2012. (in Chinese) 张成林.感染状态下问号钩体脂多糖合成、修饰及其调控机制的研究[D].杭州: 浙江大学医学院, 2012.
[23]Werts C, Tapping RI, Mathison JC, et al. Leptospiral lipopolysaccharide activates cells through a TLR2-dependent mechanism[J]. Nat Immunol, 2001, 2(4): 346-352.
[24]Nahori MA, Balloy V, Chignard M, et al. Differential TLR recognition of leptospiral lipid A and lipopolysaccharide in murine and human cells[J]. J Immunol, 2005, 175(9): 6022-6031.
[25]Kaconis Y, Kowalski I, Brandenburg K, et al. Biophysical mechanisms of endotoxin neutralization by cationic amphiphilic peptides[J]. Biophys J, 2011, 100(11): 2652-2661.
[26]Challa S, Nally JE, Sheoran AS, et al. Passive immunization withLeptospiraLPS-specific agglutinating but not non-agglutinating monoclonal antibodies protect guinea pigs from fatal pulmonary hemorrhages induced by serovar Copenhageni challenge[J]. Vaccine, 2011, 29(27): 4431-4434.
[27]Schoone GJ, Everard CO, Terpstra WJ, et al. An immunoprotective monoclonal antibody directed againstLeptospirainterrogansserovar copenhageni[J]. J Gen Microbiol, 1989, 135(1): 73-78.
[28]Widiyanti D, Koizumi N, Fukui T, et al. Development of immunochromatography-based methods for detection of leptospiral lipopolysaccharide antigen in urine[J]. Clin Vaccine Immunol, 2013, 20(5): 683-690.
[29]Naiman BM, Alt D, Baldwin CL, et al. Protective killedLeptospiraborgpetersenii vaccine induces potent Th1 immunity comprising responses by CD4 and gammadelta T lymphocytes[J]. Infect Immun, 2001, 69(12): 7550-7558.
[30]Rinehart CL, Zimmerman AD, Buterbaugh RE, et al. Efficacy of vaccination of cattle with theLeptospirainterrogansserovar hardjo type hardjoprajitno component of a pentavalentLeptospirabacterin against experimental challenge withLeptospiraborgpetersenii serovar hardjo type hardjo-bovis[J]. Am J Vet Res, 2012, 73(5): 735-740.
[31]Klaasen HL, Veen MV, Molkenboer MJ, et al. A novel tetravalentLeptospirabacterin protects against infection and shedding following challenge in dogs[J]. Vet Rec, 2013, 172(7): 181-187.
[32]Ben Adler.Leptospiraand leptospirosis[M]. Berlin: Springer-Verlag, 2015: 252-267.
[33]Midwinter AC, Vinh T, Faine S, et al. Characterization of an antigenic oligosaccharide fromLeptospirainterrogansserovar pomona and its role in immunity[J]. Infect Immun, 1994, 62(12): 5477-5482.
[34]Terra VS, Mills DC, Yates LE, et al. Recent developments in bacterial protein glycan coupling technology and glycoconjugate vaccine design[J]. J Med Microbiol, 2012, 61(Pt 7): 919-926.
[35]Ciocchini AE, Serantes DA, Melli LJ, et al. A bacterial engineered glycoprotein as a novel antigen for diagnosis of bovine brucellosis[J]. Vet Microbiol, 2014, 172(3/4): 455-465.
[36]Micoli F, Romano MR, Tontini M, et al. Development of a glycoconjugate vaccine to prevent meningitis in Africa caused by meningococcal serogroup X[J]. Proc Natl Acad Sci USA, 2013, 110(47): 19077-19082.
Stucture and function of leptospiral lipopolysaccharide
XIA Bi-li1,2,WANG Yan-chun2,GUO Xiao-kui2,HE Ping2,HUA Yun-fen1
(1.DepartmentofPharmaceutical,ZhejiangUniversityofTechnology,Hangzhou310012,China; 2.DepartmentofMedicalMicrobiologyandParasitology,BasicMedicalCollege,ShanghaiJiaotongUniversity,Shanghai200025,China)
Leptospiral lipopolysaccharide (L-LPS) is a major component of leptospires outer membrane which consists of three parts, namely O-antigen, core oligosaccharide and lipid A. L-LPS is one of the virulence factors which plays an important role in its pathogenicity, antigenicity, and interacts with external environment. Based on the structural characteristic of LPS, leptospires can be divided into different serotypes. The study of L-LPS structure is important for leptospires molecular typing and Glycan-Conjugate vaccines development. This article gives a brief review on the research progress of L-LPS structure, O-antigen gene cluster, biological activity of L-LPS and L-LPS related vaccine.
leptospires; lipopolysaccharide; O-antigen cluster; vaccine
Hua Yun-feng, Email: huayfyxwd@hotmail.com
10.3969/j.issn.1002-2694.2015.12.020
国家自然科学基金(No.81471908)
华允芬,Email: huayfyxwd@hotmail.com
1.浙江工业大学药学院,杭州 310014; 2.上海交通大学基础医学院病原生物学教研室,上海 200025
R377
A
1002-2694(2015)12-1185-04
2015-08-04;
2015-10-12
Supported by the National Natural Science Foundation of China (No. 81471908)

