皮内变态反应试验和IFN-γ试验在奶牛结核病检测中的比较研究
王曲直,沈素芳,杨显超,赵洪进,卢 军,唐文红,王 建,夏炉明
皮内变态反应试验和IFN-γ试验在奶牛结核病检测中的比较研究
王曲直,沈素芳,杨显超,赵洪进,卢 军,唐文红,王 建,夏炉明
目的 比较分析皮内变态反应试验和IFN-γ试验,为临床应用提供依据。方法 对4个奶牛场的奶牛开展单纯颈部皮内变态反应试验(SICT)、比较皮内变态反应试验(SICCT)、尾根试验(CFT)和IFN-γ试验的比较研究。结果 国产牛型PPD和进口牛型PPD在1 745头试验牛中检出阳性符合牛19头,两种方法一致性高;进口牛型PPD SICT和SICCT在1 107头试验牛中检出阳性符合牛5头,两种方法一致性中度;国产牛型PPD SICT和SICCT在1 316头试验牛中检出阳性符合牛3头,两种方法一致性弱;SICT和CFT在599头试验牛中检出阳性符合牛17头,两种方法一致性高;SICT和 IFN-γ试验在236头试验牛中检出阳性符合数为1头,两种方法一致性微弱;SICCT和 IFN-γ试验在362头试验牛中检出阳性符合牛10头,两种方法一致性中度。结论 应根据不同地区的结核病流行率和结核病净化进程选择适合的检测方法。
皮内变态反应试验;IFN-γ试验;奶牛结核病
牛结核病是一种主要由牛分枝杆菌(Mycobacteriumbovis)引起的慢性消耗性人兽共患传染病,该病对养牛业发展、奶产品安全与人类健康具有重大威胁[1]。中国是全球结核病高负担国家之一,2000年第4次全国结核病流行病学抽样调查报告显示,结核感染率为44.5%[2]。有研究发现肺结核病人中约有15%的病人是饮用了结核病牛的奶而发病[3]。世界卫生组织在其第7次专家委员会报告中指出:在那些流行牛结核病的国家,除非扑灭牛结核病,否则人类结核病的控制是不会成功的。近年来未见全国奶牛结核病流行率的官方数据,而1985、1987年进行的2次全国奶牛抽样调查结果,牛结核病患病率分别为5.83%和5.34%[4]。1979、1985、1990年3次全国结核病流行病学调查显示,由牛分枝杆菌导致的结核病所占的比例分别为3.8%、4.2%、6.4%[4]。
世界动物卫生组织(Office International Des Epizooties, OIE)推荐的牛结核病检测方法有皮内变态反应试验、γ-干扰素试验(IFN-γ)等[1]。皮内变态反应试验包括颈部单纯皮内变态反应试验(Single Intradermal Cervical Tuberculin, SICT)、颈部比较皮内变态反应试验(Single Intradermal Comparative Cervical Tuberculin, SICCT)、尾根皮内变态反应试验(Caudal Fold Test, CFT)等。目前,我国普遍采用的方法是用牛分枝杆菌提纯蛋白衍生物(Purified Protein Derivative, PPD)进行SICT检测,而 SICCT、CFT和γ-干扰素试验在一些发达国家得到普遍应用[5-6]。本研究旨在对皮内变态反应试验和IFN-γ试验进行比较,为我国的奶牛结核检疫方法积累实验数据,为临床应用提供依据。
1 材料与方法
1.1 试剂 国产牛型PPD购于哈药集团生物疫苗有限公司。进口牛型PPD和禽型PPD购于荷兰Prionics公司。BOVIGAM牛分枝杆菌IFN-γ检测试剂盒购于瑞士PRIONICS公司。
1.2 试验用牛 来自4个奶牛场,这些奶牛场每年上、下半年各进行一次结核病全群监测,对检出的阳性牛进行扑杀和无害化处理。
1.3 皮内变态反应试验
1.3.1 颈部皮内变态反应试验 在颈部采用国产牛型PPD、进口牛型PPD进行二点试验,采用国产牛型PPD、进口牛型PPD和进口禽型PPD进行三点试验。国产牛型PPD注射于右侧颈部,进口牛型PPD和进口禽型PPD注射于左侧颈部。使用剂量为国产牛型PPD 2 000 IU,进口牛型PPD 3 000 IU,进口禽型PPD2 500 IU。SICT参照国标《动物结核病诊断技术(GB/T18645-2002)》进行判定,SICCT参照OIE《动物疫苗和诊断手册》中牛结核病诊断方法进行判定[1]。
1.3.2 尾根皮内变态反应试验 CFT参照OIE《动物疫苗和诊断手册》中牛结核病诊断方法进行[1],在牛尾根部位尾褶处注射0.1 mL国产牛型PPD,剂量为5 000 IU。注射后72 h手触注射部位,如有肿胀情况,判定为阳性反应。
1.4 IFN-γ试验 采集试验牛抗凝血,经培养后,按照IFN-γ检测试剂盒说明书进行牛IFN-γ酶联免疫吸附试验(ELISA),并判定结果。
1.5 统计学方法 采用SPSS20.0统计软件对不同方法的检测结果进行χ2检验;结果一致性进行Kappa检验:0~0.2一致性微弱;0.21~0.4一致性弱;0.41~0.6一致性中度;0.61~0.8一致性高度;0.81~1.0一致性极强[7]。
2 结 果
2.1 颈部皮内变态反应试验
2.1.1 国产牛型PPD和进口牛型PPD SICT的比对 1 745头试验牛中,国产牛型PPD检出阳性牛32头,阳性率1.83%(32/1 745);进口牛型PPD检出阳性牛27头,阳性率1.55%(27/1 745)。国产牛型PPD和进口牛型PPD的阳性牛符合数为19头,阴性符合数1 705头。见表1。结果经χ2检验,P<0.01。结果一致性经Kappa检验,Kappa值为0.638,两种方法一致性高。
2.1.2 进口牛型PPD SICT和SICCT的比对 1 107头试验牛中,进口牛型PPD SICT检出阳性牛13头,阳性率1.17%(13/1 107);进口牛型PPD SICCT检出阳性牛5头,阳性率0.45%(5/1 107)。两者之间的阳性符合数为5头,阴性符合数1 094头。见表2。如果以进口牛型PPD的SICCT为金标准,5头阳性牛中,进口牛型PPD的SICT检出阳性牛5头,敏感性为100%(5/5),1 102头进口牛型PPD的SICCT阴性牛中,进口牛型PPD SICT检出阴性牛1 094头,特异性为99.27%(1 094/1 102)。结果显示,进口牛型PPD的SICT具有很好的敏感性,阳性检出率明显高于SICCT,但与SICCT相比,特异性较低。结果经χ2检验,P<0.01。结果一致性经Kappa检验,Kappa值为0.553,两种方法一致性为中度。
2.1.3 国产牛型PPD SICT和SICCT的比对 1 316头试验牛中,国产牛型PPD SICT检出阳性牛19头,阳性率1.44%(19/1 316);国产牛型PPDSICCT检出阳性牛3头,阳性率0.23%(3/1 316)。两者之间的阳性符合数为3头,阴性符合数1 297头,见表3。如果以国产牛型PPD的SICCT为金标准,3头阳性牛中,国产牛型PPD的SICT检出阳性牛3头,敏感性为100%(3/3);1 313头国产牛型PPD的SICCT阴性牛中,国产牛型PPD SICT检出阴性牛1 297头,特异性为98.78%(1 297/1 313)。结果显示,国产牛型PPD的SICT具有很好的敏感性,阳性检出率明显高于SICCT,但与SICCT相比,特异性较低。该结论与进口牛型PPD的SICT和SICCT比对结果一致。结果经χ2检验,P<0.01。结果一致性经Kappa检验,Kappa值为0.270,两种方法一致性弱。
表1 国产牛型PPD和进口牛型PPD的比对试验(单位:头)
Tab.1 Comparative result of bovine PPD of domestic and imported

国产牛型PPDSICTDomesticbovinePPDSICT进口牛型PPDImportedbovinePPDSICT阳性Positive阴性Negative合计TotalPositive191332Negative817051713Total2717181745
表2 进口牛型PPD SICT和SICCT的比对试验(单位:头)
Tab.2 Comparative result of SICT and SICCT of bovine PPD of Holland
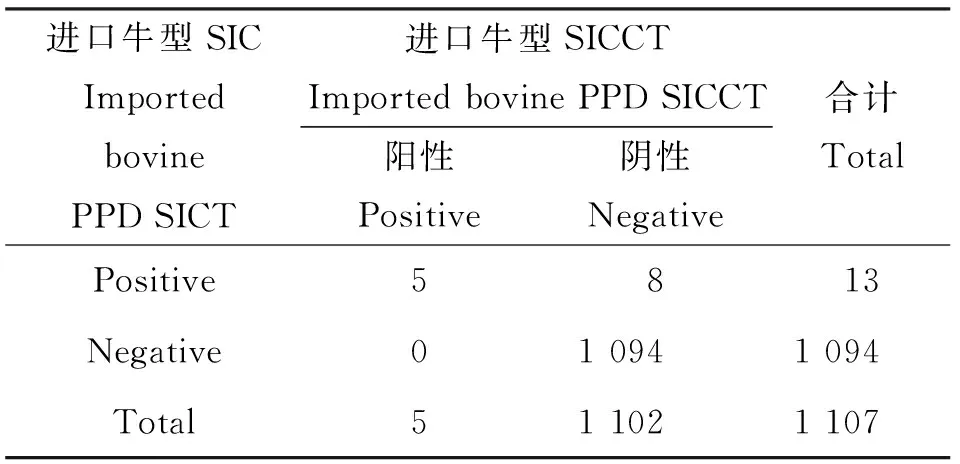
进口牛型SICImportedbovinePPDSICT进口牛型SICCTImportedbovinePPDSICCT阳性Positive阴性Negative合计TotalPositive5813Negative010941094Total511021107
2.2 CFT和SICT的比对 599头试验牛中,SICT检出阳性牛32头,阳性率5.34%(32/599);CFT检出阳性牛17头,阳性率2.84%(17/599)。两者之间的阳性符合数为17头,阴性符合数567头,见表4。结果显示, SICT具更高的敏感性,阳性检出率明显高于CFT。在试验中发现,CFT注射部位为尾根,常被粪便污染,不利于判定工作的开展。结果经χ2检验,P<0.01。结果一致性经检验,Kappa值为0.682,两种方法一致性高。
表3 国产牛型PPD SICT和SICCT的比对试验(单位:头)
Tab.3 Comparative result of SICT and SICCT of bovine PPD of China

国产牛型PPDSICTDomesticbovinePPDSICT国产牛型SICCTDomesticbovinePPDSICCT阳性Positive阴性Negative合计TotalPositive31619Negative012971297Total313131316

表4 CFT和SICT的比对试验(单位:头)
2.3 IFN-γ试验
2.3.1 IFN-γ试验和SICT比对结果 236头试验牛中,SICT检出阳性牛46头,阳性率19.49%(19/236);IFN-γ试验检出阳性牛5头,阳性率2.12%(5/236)。两者之间的阳性符合数为1头,阴性符合数186头,见表5。结果显示,IFN-γ试验的阳性率低于SICT。结果经χ2检验,P<0.01。结果一致性经Kappa检验,Kappa值为0.001,两种方法一致性微弱。
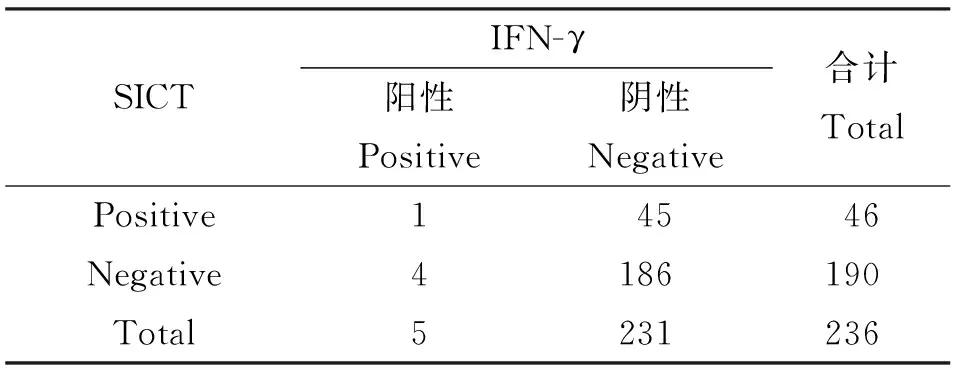
表5 IFN-γ和SICT的比对试验(单位:头)
2.3.2 IFN-γ试验和SICCT比对结果 362头试验牛中,SICCT检出阳性牛24头,阳性率6.63%(24/362);IFN-γ试验检出阳性牛15头,阳性率4.14%(15/362)。两者之间的阳性符合数为10头,阴性符合数333头。见表6。结果显示,IFN-γ试验的阳性率略低于SICCT。结果经χ2检验,P<0.01。结果一致性经检验,Kappa值为0.487,两种方法一致性中度。

表6 IFN-γ和SICCT的比对试验(单位:头)
3 讨 论
参与本试验的4个奶牛场历年来每年开展2次SICT全群监测,对检出的阳性牛进行扑杀和无害化处理,故试验奶牛场的结核流行率处于较低水平。本试验结合奶牛场的结核病集中监测开展,试验观察持续了2年。试验牛涉及不同年龄段奶牛,部分奶牛因淘汰或怀孕无法全程参与所有比对试验,故出现不同比对试验的试验牛总数不一致的情况,因试验样本量较大,并不影响试验最后结果。本试验采用的χ2检验和Kappa一致性检验。χ2检验重在检验两种方法间的差异;Kappa一致性检验旨在评估两种方法的一致性,无法判定哪个方法更好,但Kappa值越大,表明两种结果可靠程度越高[8]。对同一样本数据,这两种检验可能给出矛盾的结论,主要原因是两者对所提供的有统计学意义的结论要求非常严格所致。本试验结果经χ2检验,6组比对试验结果差异均有统计学意义。经Kappa一致性检验:国产牛型PPD和进口牛型PPD SICT、CFT和SICT两对检测方法一致性高;进口牛型PPD SICT和SICCT、IFN-γ试验和SICCT两对检测方法一致性中度;国产牛型PPD SICT和SICCT一致性弱;IFN-γ试验和SICT一致性微弱。
SICT存在较高的非特异性,在实际工作中,常出现采用不同厂家、不同批次牛型PPD的SICT阳性率差异较大的情况。我们对国产牛型PPD和进口牛型PPD进行SICT比对试验,结果显示两者一致性高。本试验无意于比较两种牛型PPD的质量差异,很多因素如气候、牛只体况、细菌或病毒感染等都会影响SICT结果。特别是非结核分枝杆菌(Nontuberculous Mycobacteria, NTM)感染,常造成假阳性的结果。在自然环境和健康牛体内中,NTM的存在比较普遍,林世平等对牛鼻腔分泌物中的NTM进行分离,分离率高达50.5%[10],毛冉等在健康牛的颌下淋巴结和肠系膜淋巴结中分离出NTM[11]。一些研究者在STCT阳性牛的病原菌分离中发现NTM占分离株的81.5%[12]。付少刚等采用SICT的方法在1 867头奶牛中检出阳性牛22头,对采集的阳性牛病料进行病原学检测,未发现牛分枝杆菌[13]。虽然SICT特异性较差,但敏感性高,故可用于结核病流行地区的全群普检,尽早发现阳性牛群,尽快采取控制措施。
SICCT在美国、欧盟国家得到广泛应用[5-6,14]。我国从2013年开始,由农业部印发的《国家动物疫病监测与流行病学调查计划》规定,对SICT阳性动物,要用SICCT或IFN-γ试验进行确诊。国内有研究者将SICT和SICCT进行比较分析,证明了SICCT在不降低敏感性的同时,提高了试验特异性[15]。我们对SICT和SICCT进行了比较分析,结果显示进口牛型PPD SICT和SICCT一致性中度,国产牛型PPD SICT和SICCT一致性弱。总体上看,SICCT排除了禽型PPD反应阳性牛,阳性率低于SICT。在结核病已达到控制或稳定控制的低流行率地区,仅靠单一的SICT,常出现较多的非特异性干扰,不利于结核病的净化,可以采用SICCT作为日常监测的主要手段,同时,可以引入γ-IFN试验、细菌分离等方法作为SICCT的补充。
CFT也是OIE推荐的皮内变态反应试验中的一种,澳大利亚等国家采用CFT进行牛结核病筛查工作[6],该方法操作简便,省时省力。一般认为CFT的敏感性较高,并可以通过增加PPD使用剂量,进一步提高试验的敏感性。我们在试验中使用5 000 IU国产牛型,发现其检测结果和SICT的检测结果一致性高,但敏感性低于同步开展的SICT,且尾根注射部位常被粪便污染,不利于判定工作的开展。
IFN-γ试验作为OIE推荐的结核病检测方法之一[1],美国、加拿大、澳大利亚、新西兰等国家均利用IFN-γ试验辅助诊断牛结核[16-17]。国内一些研究者在结核污染牛群进行IFN-γ试验和皮内变态反应的比对,阳性符合率很高[15,18]。而我们开展试验的奶牛场结核流行率常年处于较低水平,检测结果显示IFN-γ试验和SICT的一致性弱,和SICCT的一致性中度。
我们认为,应根据不同地区结核病流行率高低选择不同的检测方法。高流行率地区应选择敏感性较强的方法如SICT作为主要检测手段,低流行率地区应选择特异性较强的方法如SICCT作为主要检测手段。在结核病流行地区,采用SICT对全群进行普检,有利于尽早发现阳性牛群,尽快采取控制措施。在结核病已达到控制或稳定控制的低流行率地区,可采用SICCT排除禽型PPD反应阳性牛,减少非特异性反应。在结核病净化地区,可在SICCT的基础上,引入IFN-γ试验等方法作为复核确诊试验,进一步提高检测试验的特异性。采用SICT、SICCT或CFT等皮内变态反应试验,其主旨并非是诊断阳性牛个体,而是发现阳性牛群体,并采取相应的处置方法。阳性牛个体确诊应平行使用皮内变态反应试验、IFN-γ试验、病原菌分离培养等方法。一些成功消灭牛结核病国家的经验告诉我们,当牛群的结核病始终处于低流行率的情况下,在持续使用皮内变态反应试验开展监测的同时,应引入分子流行病学,重视对皮试阳性牛病原菌分离以及对分离菌株从基因水平上的分离鉴定。
[1]World Organization for Animal Health. Manual of diagnostic tests and vaccines for terrestrial animals[M]. Paris: Bovine tuberculosis, 2009: 16-22.
[2]National Technic Steering Group of the Epidemiological Sampling Survey for Tuberculosis. Report on fourth national epidemiological sampling survey of tuberculosis[J]. Chin J Tuberc Respir Dis, 2002, 25(1): 3-7. (in Chinese) 全国结核病流行病学抽样调查技术指导组.第四次全国结核病流行病学抽样调查报告[J]. 中华结核和呼吸杂志, 2002, 25(1): 3-7.
[3]Xu GX, Zhao DM. Comparision of genome between Mycobacterium bovis and Mycobacterium tuberculosis[J]. Progr Mod Biomed, 2006, 6 (7): 67-69. (in Chinese) 徐广贤,赵德明.牛分枝杆菌与肺结核分枝杆菌基因组的比较[J].现代生物医学进展, 2006, 6 (7): 67-69.
[4]Xu MY, Liu TY, Zhong NR, et al. Report of 17Mycobacteriumtuberculosiscases[J]. Chin J Zoonoses, 1998, 14( 6): 76. (in Chinese) 徐美英, 刘坦业, 钟能荣, 等. 牛分枝杆菌肺结核17例报告[J]. 中国人兽共患病杂志, 1998, 14( 6): 76.
[5]Buddle BM, Ryan TJ, Pollock JM, et al. Use of ESAT-6 in the interferon-gamma test for diagnosis of bovine tuberculosis following skin testing[J]. Vet Microbiol, 2001, 80: 37-46.
[6]Robert L. Eradication documentary of bovine brucellosis and tuberculosis in Australian[M]. Beijing: Chin Agri Press, 2007: 87-108 (in Chinese) 罗伯特.澳大利亚根除牛布鲁氏菌病和结核病纪实[M].北京:中国农业出版社, 2007: 87-108.
[7]Landis JR, Koch GG. The measurement of observer agreement for Categorical data[J]. Biometrics, 1977, 33: 159-174.
[8]Zhang B. The application of Kappa coincidence test in the epidemiological study[J]. J Ningxia Med Coll, 1995(17): 336-337. (in Chinese) 张波. Kappa一致性检验在流行病学中的应用举例[J]. 宁夏医学院学报, 1995(17): 336-337.
[9]Rajesh K, Wayne Halfpenny JK. Rare presentation of Mycobacterium avium-intracellulare infection[J].British J Oral Maxillofacial Surg, 2007, 45: 670-672.
[10]Lin SP, Yang YZ, Tan WG, et al. Analysis of results in isolation and culture of nontuberculousMycobacteriain secretions of cattle nasal cavity[J]. Chin Tropical Med, 2005, 5(6): 1207-1209. (in Chinese) 林世平,杨应周,谭卫国,等.牛鼻腔分泌物非结核分枝杆菌分离培养结果分析[J].中国热带医学, 2005, 5(6): 1207-1209.
[11]Mao R, Zhang Y, Wang TF, et al. Isolation and Analysis of Non-tuberculous Mycobacteria from Bovine[J]. J Hebei Normal Univ Sci Tec, 2010, 24(4): 32-35. (in Chinese) 毛冉,张宇,王铁锋,等.牛源非结核分枝杆菌的分离培养与结果分析[J].河北科技师范学院学报, 2010, 24(4): 32-35.
[12]He ZY, Hu XR, Wang ZG, et al. solation and identification of the atypical mycobacteria from cattle positive allergic reaction to tuberculosis PPD[J]. Acta Vet et Zootechnica sinica, 1994, 25(3): 247-251. (in Chinese) 何昭阳,胡希荣,王振国,等.结核变态反应阳性牛的非典型性分枝杆菌的分离和鉴定[J].畜牧兽医学报,1994,25(3): 247-251.
[13]Fu SG, Cao XZ, Ma JC, et al. The interpretation of delayed allergic reaction test in monitoring of the tuberculosis of dairy cattle in Yinchuan[J]. Chin Anim Quaranti:Quaranti, 2012, 29(2): 36-37. (in Chinese) 付少刚,曹晓真,马建春,等. 迟发性变态反应试验监测银川奶牛结核病的结果分析[J].中国动物检疫, 2012, 29(2): 36-37.
[14]United States Department of Agriculture. Bovine tuberculosis eradication uniform methods and rules[M]. New York: Law Press, 2005: 14-19.
[15]Chen X, Xu ZZ,Shi ZH, et al. Comparision of gamma-interferon assay and tuberculin skin test for detection of bovine tuberculosis[J]. Chin J Zoonoses, 2011, 27(2): 97-100. (in Chinese) 陈祥,徐正中,时振华,等. γ-干扰素试验和皮试变态反应对检测奶牛结核病的比较[J].中国人兽共患病学报, 2011, 27(2): 97-100.
[16]Gormely E, Doyle MB, Fitzsimon T, et al. Diagnosis ofMycobacteriumbovisinfection in cattle by use of the gamma-interferon (Bovigam) assay[J]. Vet Microbiol, 2006, 12(2/4): 171-179.
[17]Alicia A, Lucia DE, Bezos J, et al. Assessment of diagnostic tools for eradication of bovine tuberculosis in cattle co-infected withMycobacteriumbovineandM.aviumsubsp[J]. Paratuberculosisi Vet Res, 2006, 37: 593-606. DOI:
[18]Zhang XY, Hu XD, Yang JW, et al. Application of interferon-γ testing and the comparative cervical skin test in herds infected withMycobacteriumbovis[J]. Chin J Zoonoses, 2010, 26(1): 53-56. (in Chinese) 张喜悦,呼西旦,杨经纬,等. γ-干扰素试验及比较皮试在结核污染牛群的应用研究[J].中国人兽共患病学报, 2010, 26(1): 53-56.
Comparative study of delayed hypersensitivity test and IFN-γ test in detection of bovine tuberculosis
WANG Qu-zhi,SHEN Su-fang,YANG Xian-chao,ZHAO Hong-jin,LU Jun,TANG Wen-hong,WANG Jian,XIA Lu-ming
(ShanghaiAnimalDiseaseControlCenter,Shanghai201103,China)
In order to compare the bovine tuberculosis (TB) diagnosis methods of delayed hypersensitivity test and IFN-γ test, and provide the basis for clinical application, Single Intradermal Cervical Tuberculin (SICT), Single Intradermal Comparative Cervical Tuberculin (SICCT), Caudal Fold Test (CFT) and Gamma-interferon assay (IFN-γ) were made in 4 dairy farms. Results showed that the coincidence of SICT positive cows by imported bovine PPD and domestic bovine PPD was 19 among 1 745 tested cows and the consistency was high. The coincidence of SICT and SICCT positive cows by imported bovine PPD was 5 among 1 107 tested cows and the consistency was moderate. The coincidence of SICT and SICCT positive cows by domestic bovine PPD was 3 among 1 316 tested cows and the consistency was weak. The coincidence of SICT and CFT positive cows was 17 among 599 tested cows and the consistency was high. The coincidence of SICT and IFN-γ test positive cows was 1 among 236 tested cows and the consistency was weak. The coincidence of SICCT and IFN-γ test positive cows was 10 among 362 tested cows and the consistency was moderate. The test results show that using high sensitivity test of entire herd is conducive to early detection of TB carriers and can accelerate the pace of TB control in epidemic areas. Tests with high specificity should be introduced into TB detection in control or stability control area, which can further improve the specificity of detection of TB.
delayed hypersensitivity test; IFN-γ test; bovine tuberculosis
Wang Qu-zhi, Email: shdwfy@163.com
10.3969/j.issn.1002-2694.2015.12.015
王曲直,Email: shdwfy@163.com
上海市动物疫病预防控制中心,上海 201103
R378.91
A
1002-2694(2015)12-1162-05
2015-01-25;
2015-07-24
上海市市级农口系统青年人才成长计划[沪农青字(2014)第2-13号]和上海市科技兴农推广项目[沪农科推字(2010)第1-2号]联合资助
Supported by the Shanghai Municipal Agricultural System Plan for Growth of Young Talents [Hu Nong Qing Zi(2014)No.2-13]; Shanghai Science and Technology Promotion Project [Hu Nong Ke Tui Zi(2010)No. 1-2]

