牛源大肠杆菌O157∶H7分离与鉴定及其毒力基因检测
张 桃,苏战强,夏利宁,王雨朦,周银萍,刘媛媛,买占海,张彩云,姚 刚,况 玲
牛源大肠杆菌O157∶H7分离与鉴定及其毒力基因检测
张 桃,苏战强,夏利宁,王雨朦,周银萍,刘媛媛,买占海,张彩云,姚 刚,况 玲
目的 研究新疆肉牛主产区健康牛群中该菌的携带情况及致病的可能性。方法 对采自新疆伊犁昭苏县某牛场健康牛的85份新鲜牛粪样本,增菌后用SMAC平板和MUG实验进行筛选,再用PCR技术和生化试验鉴定;对分离到的E.coliO157∶H7用PCR法检测其Stx1、Stx2、eaeA、tccp和Hly等基因携带情况;用腹腔注射EC肉汤增菌原液的方法进行动物攻毒实验,确定分离菌株的致病性。结果 85份粪样中只鉴定出1株E.coliO157∶H7,检出率为1.176%;而这株菌同时携带被检测的5种毒力基因;攻毒实验所有的小白鼠于24 h内全部死亡。结论 新疆伊犁地区牛群携带有E.coliO157∶H7,从所分离到菌株所携带的毒力基因情况和对小白鼠攻毒实验结果发现,这株菌对人有很强的潜在致病性。
牛源大肠杆菌;E.coliO157∶H7;分离鉴定;毒力基因;动物毒性试验
肠出血性大肠杆菌(EnterohemorrhageE.coli,EHEC) O157∶H7是一种致病力很强的,严重危害人类生命安全的食源性病原微生物[1]。被该菌感染后能引起人和动物的出血性肠炎、溶血性尿毒综合征(Hemolyticuremicsyndrome, HUS) 和血栓形成性血小板减少性紫癜(Thromboticthrombocytopenicpurpura, TTP)而致较高的死亡率,已在全球范围内引起关注[2]。1982年欧美首次报告该病暴发流行后[3],世界各地不断出现人感染E.coliO157∶H7病例的报道,有的是因为食用了被污染的肉制品[4]和奶制品[5-6],有的则是因为食用了被污染的蔬菜。虽然许多动物都是E.coliO157∶H7的储存宿主[7-8],但是许多研究者都从牛粪便中分离到了该菌,并证明了其与食源性疾病的相关性,认为牛是该病的主要传染源[9]。携带E.coliO157∶H7的牛在排菌的同时可能没有任何可见的临床症状[10],而由它们生产的牛肉或牛乳产品就可能被污染,其污染源主要是牛粪[11],事实也证明人类食用被牛粪中E.coliO157∶H7污染了的牛肉是该病的主要发病原因之一[12]。因此许多研究者都致力于如何减少或消除牛体携带和排出E.coliO157∶H7的技术研究。
本实验研究对新疆牛源E.coliO157∶H7进行特异性基因及毒力基因的检测,调查新疆牛源大肠杆菌的流行现状及毒力因子的携带情况,为新疆牛源E.coliO157∶H7污染状况评估和源头防控提供了科学依据。
1 材料及方法
1.1 样品来源 采样时间,2014年7月1日。采样地点,新疆伊犁昭苏县某牛场。采样方法,用一次性无菌塑料手套从健康牛排出的新鲜粪便中央进行采集,根据圈舍分组后进行编号,共85份。
1.2 标准菌株 出血性大肠埃希氏菌(EscherichiacoliEHEC O157∶H7 )标准质控菌株,菌号:CICC 21530;非EHEC O157∶H7大肠埃希氏菌(Escherichiacoli)标准质控菌株,菌号:CICC 10389;两株菌均购自中国工业微生物菌株保藏中心。
1.3 主要试剂与仪器 EC肉汤、山梨醇麦康凯培养基(SMAC)(北京奥博星生物技术有限责任公司)、DNA marker DL2000、2xTaq PCR Green Mix、DNA提取试剂盒(北京鼎国昌盛生物技术有限责任公司)、4-甲基伞形酮-β-D葡萄糖醛酸苷(MUG)培养基(广东环凯微生物科技有限公司)、肠杆菌科细菌生化编码鉴定管GYZ-15e(杭州天和微生物试剂有限公司)、生理盐水(氯化钠0.9 g、蒸馏水100 mL,高压备用);
空气浴振荡培养箱(型号MODEL:ST-F160AC)、TPro fessional 高性能梯度PCR仪(Biometra)、DYY-6C 型电泳仪(北京市六一仪器厂)、凝胶成像系统:TransilluminatorGULABO。
1.4 引物选择与合成 根据GenBank及参考相关文献选取和设计E.coliO157∶H7 rfbE、fliC、志贺样毒素1(Stx1)、志贺样毒素2(Stx2)、紧密黏附素基因(eaeA)和内膜素受体偶联细胞骨架蛋白(tccp)、溶血素基因(Hly)、16S rRNA。引物由上海生工生物技术有限公司合成。PCR扩增引物序列和反应运行参数等见表1。

表1 PCR扩增引物序列和反应运行参数
Note: F:上游;R:下游 F: Forward; R: Reverse
1.5 实验动物 昆明白鼠(20±2)g,购于新疆医科大学实验动物中心,SCXK(新)2015-0001。
1.6 方法
1.6.1 增菌和SMAC平板培养 在无菌环境下称取2 g粪样加到10 mL的EC肉汤培养基中,37 ℃、180 r/min震荡培养18~24 h。然后划线接种SMAC平板,培养18~24 h。
1.6.2 MUG实验 挑选SMAC平板上生长的5~10个典型或可疑的灰白色菌落,接种MUG培养基,37 ℃、180 r/min培养18 h。将培养后的MUG培养基在暗处用波长为365 nm功率为6 W的紫外光灯照射观察,保存MUG试验不发荧光的菌株,并进行进一步PCR和生化鉴定。
1.6.3 PCR扩增及同源性比较
1.6.3.1 细菌DNA模板的制备 在SMAC平板上挑取单个菌落至60 μL TE buffer中,用移液枪反复吹打混匀, PCR 仪中95 ℃ 5 min加热,制成 PCR体系的基因组DNA。
1.6.3.2 rfbE、fliC及16S rRNA的检测及序列测定PCR反应体系 各反应体系总量均为25 μL,其中Taq聚合酶预混染料(2× Taq PCR Green Mix)12.5 μL;F-Primer 1 μL;R-Primer 1 μL;细菌 DNA 模板1 μL;无菌水加至25 μL。按照表1中的运行参数进行扩增,反应结束后,取6 μL扩增产物经 1%琼脂糖凝胶电泳检测,缓冲液为1×TAE,120 V恒压电泳30 min,在EB 中浸泡 15 min 后,用凝胶成像分析系统观察结果。将16S rRNA扩增产物送上海生工生物技术有限公司进行序列测定,将测定结果登录GenBank进行Blast,进行同源性比对。
1.6.4 生化鉴定 对rfbE、fliC同时阳性的菌株接种于 EC肉汤活化,37 ℃、180 r/min培养12 h后,接种于SMAC平板,37 ℃培养12 h,在无菌环境下挑取单个菌落分别接种于肠杆菌科细菌生化编码鉴定管中,同时以CICC 21530质控菌株做对照,37 ℃培养箱内培养 24~48 h,观察并记录结果。
1.6.5E.coliO157∶H7毒力因子的PCR检测 各毒力基因的PCR反应体系同1.6.3.2,PCR 反应运行参数见表 1。反应结束后,操作同1.6.3.2。
1.6.6 动物致病性实验
1.6.6.1 菌液的制备 挑取4 ℃斜面保存的E.coliO157∶H7菌株在EC肉汤培养液中37 ℃、180 r/min震荡培养12 h后,随后接种SMAC平板,37 ℃培养12 h后,挑取单个圆形、光滑的灰白色菌落于EC肉汤中37 ℃、180 r/min震荡培养12 h,测定OD600,将OD值固定在1。
1.6.6.2 动物攻毒试验 取20只体重为(20±2)g的昆明小鼠(雌雄各半)分为两组,禁食不禁水12 h后,按0.5 mL/只的剂量腹腔注射,对照组小鼠注射同剂量灭菌生理盐水。隔离饲养,观察小白鼠的临床症状。对死亡小鼠进行剖检,观察病变并采集小鼠脾脏和肝脏直接涂片镜检,对无菌采取的脾脏、肝脏的培养物进行病原分离[19]。
2 结 果
2.1 MUG实验结果 SMAC平板筛选出的疑似E.coliO157∶H7菌株进行MUG 试验后总计11株细菌不产生蓝白色荧光。
2.2 rfbE、fliC、16S rRNA扩增结果及序列比对 结果以CICC 21530菌株、CICC 10389菌株作为标准质控,对11株MUG实验疑似阳性菌株进行PCR特异性扩增。经rfbE基因PCR 特异性扩增后,1 株细菌可在500 bp出现典型单一条带(图1);该菌株进行fliC基因扩增后可在625 bp出现单一目的DNA条带(图2);又经16S rRNA扩增后在1 439 bp出现单一条带,命名该菌株为E.ZS-1。
将16S rRNA PCR产物进行测序,对其序列进行Blast分析,结果显示,本试验分离的菌株与EscherichiacoliO157∶H7 str. SS52的同源性为98%,该序列GenBank登录号为CP010304.1。

M:DL2 000 marker;1: Negative control; 2: Positive control; 3: rfbE positive stripe.
图1 rfbE扩增
Fig.1 PCR amplification of rfbE
2.3 生化实验结果 E.ZS-1菌株的生化试验结果符合GBT 4789.36-2008标准所列大肠埃希菌O157∶H7/NM的特征,结合PCR 试验rfbE、fliC的扩增结果,确认所分离的E.ZS-1是一株E.coliO157∶H7。生化结果见表2和图3。
2.4E.coliO157∶H7毒力基因扩增结果 对E.ZS-1E.coliO157∶H7菌株进行毒力因子的检测,结果显示:Stxl基因(130 bp)、Stx2基因(346 bp)、eaeA基因(375 bp)、tccp基因(1 000 bp)、Hly基因(319 bp)均可扩增出特异性目的片段(图4)。
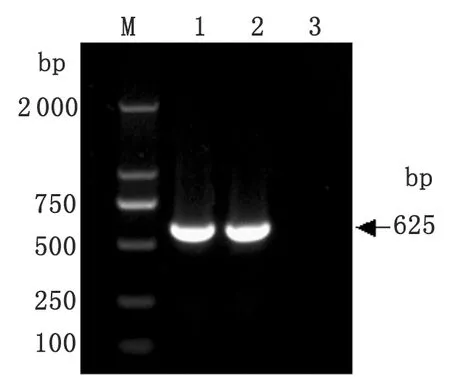
M:DL2 000 marker;1: fliC positive stripe;2:Positive control; 3: Negative control.
图2 fliC扩增
Fig.2 PCR amplification of fliC

M:DL2 000 marker;1: 16S rRNA positive stripe; 2:Positive control; 3: Negative control.
图3 16S rRNA PCR扩增
Fig.3 PCR amplification of 16S rRNA

表2 生化鉴定结果
Note: +:表示阳性结果;-:表示阴性结果;+ indicates positive result; -indicates negative result.

图4 分离菌的生化鉴定结果图
2.5 分离菌株E.ZS-1的致病性试验结果
2.5.1 临床症状及剖检变化将E.ZS-1菌株原液注射昆明小鼠,试验组小鼠经腹腔注射菌液后均表现出了明显的临床症状,主要有精神沉郁、弓背、被毛松乱、昏睡等症状,小鼠在8~24 h全部死亡;空白对照组无异常。剖检小鼠可见:实验组小鼠胸腔、腹腔有大量出血、小肠出血、肝脏淤血(图5);空白对照组无变化(图6)。
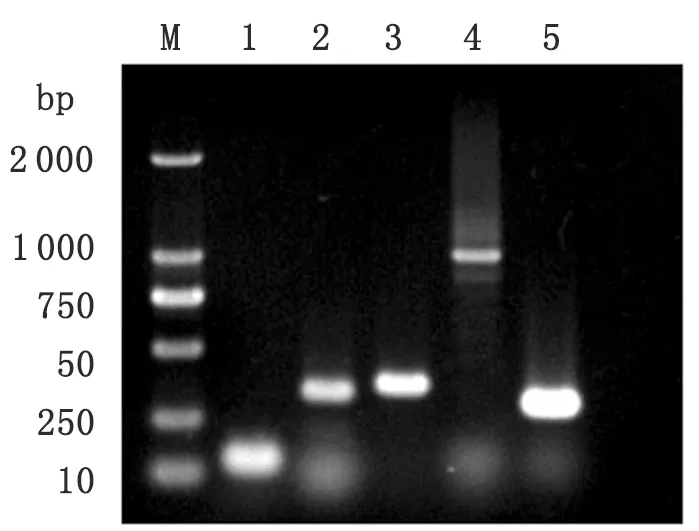
M: DL2 000 marker; 1:Stxlpositive stripe (130 bp); 2:Stx2 positive stripe (346 bp); 3:eaeApositive stripe (375 bp); 4:tccppositive stripe (1 000 bp); 5:Hlypositive stripe (319 bp)
图5E.coliO157∶H7毒力基因扩增
Fig.5 PCR amplification ofE.coliO157∶H7virulence gene
3 讨 论
调查牛群E.coliO157∶H7的感染情况,是控制其感染人继而引发该病流行的关键措施。本研究从新疆伊犁某牛场采集的85份新鲜粪样中只分离鉴定到一株E.coliO157∶H7,检出率仅为1.18%。而赵璐[20]等从新疆4个地区不同牛场的208份粪便样品中共检出5株E.coliO157∶H7,检出率为2.40%。戴贤君[21]等从浙江某屠宰场的采集240个猪肉样本进行E.coliO157∶H7的检测,结果分离到3株阳性菌株,检出率为1.25%。赵秋华[22]等从上海地区不同猪场的280份样品分离得到2株E.coliO157∶H7,检出率为0.71%。可见在我国不管是牛源的还是猪源的E.coliO157∶H7的检出率都不是很高。

图6 实验组小鼠剖检图
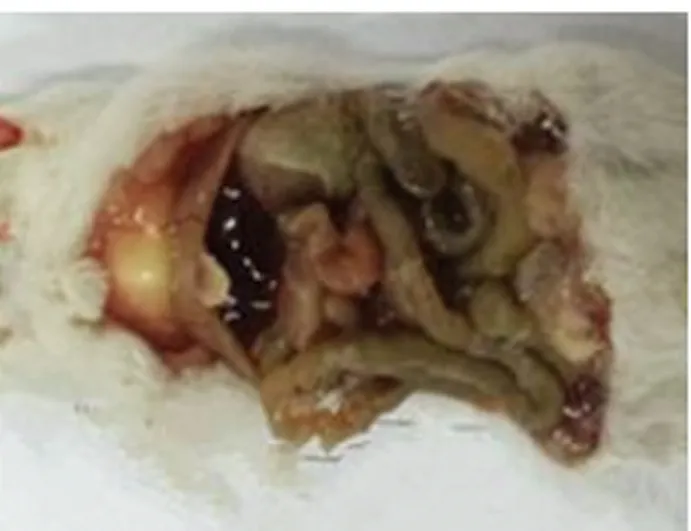
图7 对照组小鼠剖检图
从牛粪便中分离鉴定E.coliO157∶H7的方法有许多,但目前最常用的方法是用PCR的方法对经选择性培养基初筛选的菌株进行鉴定,一般检测菌体是否有菌体O抗原基因(rfbEO157)和鞭毛H抗原基因(fliCH7)即可[23]。本试验采用SMAC平板和MUG实验进行初步筛选,再用PCR检测rfbE和fliC基因,最后用生化试验进行验证。这种方法的优点是在保证准确率的前提下减少了工作量。缺点则是因为未使用免疫磁珠富集技术,检出率可能相对较低,同时不能检出那些不发酵山梨醇的E.coliO157∶H7。
E.coliO157∶H7致病力主要取决于其所能产生的毒力因子。E.coliO157∶H7毒力因子主要有志贺毒素(Shiga toxin,Stx)、溶血素(Haemolysin, Hly)和黏附与脱落(attach-ment and effacement ,A/E)损伤因子等。编码这些因子的毒力基因主要有Stx1、Stx2、Hly和肠细胞脱落位点(Locus of Enterocyte Effacement, LEE)[24]等。LEE 毒力岛区域含有编码 A/E 损伤的所有基因以及编码其它的一些毒力基因[25],主要包括3个功能区:第1个区是编码Ⅲ型分泌系统的基因,第2个区由eaeA与tir组成,第3个区则包括espD,espB和espA等[26]。本次分离到的这株E.coliO157∶H7同时携带所有被检测的5种毒力基因,与我国其他地方分离到的一些菌株,具有明显的区别。戴贤君[21]分离的3株猪源E.coliO157∶H7中,有2株同时含有SLT1、SLT2和eaeA3种毒力基因,而另外1株仅含有eaeA毒力基因。赵秋华[22]分离的2株猪源E.coliO157∶H7中1株含有Stx1和eaeA基因,而另1株仅检测出eaeA基因。韦小瑜[27]等从贵州省1例腹泻病例的粪便标本中分离鉴定O157肠出血性大肠杆菌并对其进行毒力基因检测,基因eaeA、Stx2和hly均阳性,而Stx1阴性。多数学者认为包含Stx2和eaeA的细菌致病力较强,但其对某个动物的致病性则是多因子综合作用的结果。小鼠经腹腔注射菌液后均表现出了明显的临床症状,小鼠在8 h开始死亡,24 h时全部死亡,说明该分离株有高致病性。
[1]Svab D, Balint B,Maroti G, et al. A novel transducible chimeric phage fromEscherichiacoliO157∶H7 Sakai strain encoding Stx1 production[J]. Infect Genet Evol, 2015, 29: 42-47. DOI:10.1016/j.meegid.2014.10.019
[2]Tang B, Li Q, Zhao XH, et al. Shiga toxins induce autophagic cell death in intestinal epithelial cells via the endoplasmic reticulum stress pathway[J]. Autophagy, 2015, 11(2): 344-354. DOI: 10.1080/15548627.2015.1023682
[3]Centers for Disease Control and Prevention (CDC). Isolation ofE.coliO157∶H7 from sporadic cases of hemorrhagic colitis-United States[J]. MMWR, 1977, 46(30): 700-704.
[4]Wells JE. Meat science and muscle biology symposium:EscherichiacoliO157∶H7, diet, and fecal microbiome in beef cattle[J]. J Anim Sci, 2014, 92(4): 1345-1355. DOI: 10.2527/jas.2013-7282
[5]Perrin F, Tenenhaus-Aziza F, Michel V, et al. Quantitative risk assessment of haemolytic and uremic syndrome linked to O157∶H7 and non-O157∶H7 Shiga-toxin producingEscherichiacolistrains in raw milk soft cheeses[J].Risk Anal, 2015, 35(1): 109-128. DOI: 10.1111/risa.12267
[6]Addo KK, Mensah GI, Aning KG, et al. Microbiological quality and antibiotic residues in informally marketed raw cow milk within the coastal savannah zone of Ghana[J]. Trop Med Int Health, 2011,16(2):227-232.DOI:10.1111/j.1365-3156.2010.02666.x
[7]Tseng M, Fratamico PM, Manning SD, et al. Shiga toxin-producingEscherichiacoliin swine: the public health perspective[J]. Anim Health Res Rev, 2014, 15(1): 63-75. DOI: 10.1017/S1466252313000170
[8]Amezquita-Lopez BA. Virulence profiling of Shiga toxin-producingEscherichiacolirecovered from domestic farm animals in Northwestern Mexico[J]. Front Cell Infect Microbiol, 2014, 4: 7.DOI: 10.3389/fcimb.2014.00007
[9]Munns KD, Selinger LB, Stanford K, et al. Perspectives on super-shedding ofEscherichiacoliO157∶H7 by cattle[J]. Foodborne Pathog Dis, 2015. 12(2): 89-103. DOI: 10.1089/fpd.2014.1829
[10]Kieckens E, Rybarczyk J, De Zutter L, et al. Clearance ofEscherichiacoliO157∶H7 infection in calves by rectal administration of bovine lactoferrin[J]. Appl Environ Microbiol, 2015, 81(5): 1644-1651. DOI: 10.1128/AEM.03724-14
[11]Bosilevac JM, Gassem MA, Al Sheddy IA, et al. Prevalence ofEscherichiacoliO157∶H7 and Salmonella in camels, cattle, goats, and sheep harvested for meat in Riyadh[J]. J Food Prot, 2015, 78(1): 89-96. DOI: 4315/0362-028X.JFP-14-176
[12]Reyes-Rodriguez NE, Soriano-Vargas E, Barba-Leon J, et al. Genetic characterization ofEscherichiacoliisolates from cattle carcasses and feces in Mexico State[J]. J Food Prot, 2015, 78(4): 796-801. DOI: 10.4315/0362-028X.JFP-14-425
[13]Gong YW. Investigation onE.coliO157∶H7 among poultry and livestock in Changchun Area[J]. J Microbiol, 2006, 26(6): 102-105. (in Chinese) 龚云伟.长春地区家禽(家畜)中E.coliO157∶H7 调查[J].微生物学杂志,2006,26(6):102-105.
[14]Guo WZ. Preliminary investigationon enteuohemorrhagieEseheriehiacoliO157 from domestie animals and fowl in Fujian Province[J]. Chin J Zoonoses, 1998, 14(2): 3-6. (in Chinese) 郭维植.福建省家畜家禽大肠杆菌 O157 初查[J].中国人兽共患病杂志,1998,14(2):3-6.
[15]Zhou Z,Nishikawa Y,Zhu P, et al. Isolation and characterization of Shiga toxin-producingEscherichiacoliO157∶H7 from beef, pork and cattle fecal samples in Changchun, China[J]. J Vet Med Sci, 2002, 64(11): 1041-1044.
[16]Ye Q, Zhang XH, He KW, et al. Isolation ofEscherichiacoiO157∶H7 from cattle and detection of its virulence genes[J]. China J Vet Sci, 2012(8): 1148-1153. (in Chinese) 叶青,张雪寒,何孔旺,等.牛源大肠杆菌O157∶H7的分离及毒力基因鉴定[J].中国兽医学报,2012(8):1148-1153.
[17]Ji XW. The molecular evolution of enterohemorrhagicEscherichiacoli(EHEC) O157∶H7[D]. Chongqing: Third Military Medical University, 2010. (in Chinese) 姬小薇.肠出血性大肠杆菌EHEC O157∶H7的分子进化研究[D]. 重庆:第三军医大学, 2010.
[18]Zhang LG, Lu T, Zhao ML, et al. Detection of virulence genes ofEscherichiacoilfrom cattle and pathogenicity of the isolate in mice[J]. Chin Vet Sci,2014(8): 817-822. (in Chinese) 张力国,卢婷,赵明礼,等.牛源大肠杆菌毒力基因的检测及其对小鼠致病性的研究[J].中国兽医科学,2014(8):817-822.
[19]Liu XM, Yang H, Zhang RX, et al. Isolation and identification ofBordetellabronchiseptica from calves[J]. Chin Vet Sci, 2009(11): 964-967. (in Chinese) 刘晓民,杨华,张润祥,等.牛源支气管败血波氏杆菌的分离与鉴定[J].中国兽医科学,2009(11):964-967.
[20]Zhao L. To detect the dungE.coliO157∶H7 and toxicity studies in different regions of Xinjiang[D]. Urumqi:Xingjiang Agricultural University, 2014. (in Chinese) 赵璐. 新疆不同地区牛粪源大肠杆菌O157∶H7分离鉴定及毒性研究[D]. 乌鲁木齐:新疆农业大学, 2014.
[21]Dai XJ, Yang ZZ, Zhang FM. Solation, identification and biological characteristics ofE.coliO157: H7 from pork production process[J]. J Chin Food Sci Technol, 2010(5): 237-242. (in Chinese) 戴贤君,杨宗照,张富明.猪肉生产过程中大肠杆菌O157∶H7的分离、鉴定及生物学特性[J].中国食品学报,2010(5):237-242.
[22]Zhao QH, Wang SH, Liu PP, et al. Epidemiologic survey ofEscherichiacoliO157∶H7 in pig herds in Minhang district of Shanghai[J].Chin J Vet Parasit, 2013(3): 38-44. (in Chinese) 赵秋华,王少辉,刘萍萍,等.上海市闵行区猪场中大肠杆菌O157∶H7的分离鉴定及生物学特性研究[J].中国动物传染病学报,2013(3):38-44.
[23]Abong'o BO,Momba MN. Prevalence and potential link betweenE.coliO157∶H7 isolated from drinking water, meat and vegetables and stools of diarrhoeic confirmed and non-confirmed HIV/AIDS patients in the Amathole District-South Africa[J]. J Appl Microbiol, 2008, 105(2): 424-431. DOI: 10.1111/j.1365-2672.2008.03756.x
[24]Allen KJ, Laing CR, Cancarevic A, et al. Characteristics of clinical Shiga toxin-producingEscherichiacoliisolated from British Columbia[J]. Biomed Res Int, 2013, 2013: 878956. DOI: 10.1155/2013/878956
[25]Dong PC. The Prevalence and biological property ofSalmonellaandE.coliO157∶H7 during processing in Chinese cattle slaughtering plants[D]. Tai’an: Shangdong Agricultural University, 2012. (in Chinese) 董鹏程.沙门氏菌和大肠杆菌 O157∶H7 在肉牛屠宰过程中的流行特点及其生物学特性的研究[D]. 泰安:山东农业大学, 2012.
[26]Yang Z,Kim J,Zhang C, et al. Genomic instability in regions adjacent to a highly conserved pch prophage inEscherichiacoliO157∶H7 generates diversity in expression patterns of the LEE pathogenicity island[J]. J Bacteriol,2009, 191(11): 3553-3568. DOI: 10.1128/JB.01738-08
[27]Wei XY, Tian KC, Tang GP, et al. Isolation and identification of the first strain of enterohemorrhagicEscherichiacoliO157∶H7 isolated from a patient with infectious diarrhea in Guizhou Province, China[J]. Chin J Zoonoses, 2015, 31(2): 183-188.DOI: 10.3969/j.issn.1002-2694.2015.02.019 (in Chinese) 韦小瑜,田克诚,唐光鹏,等.贵州省首次从腹泻病例中检出肠出血性大肠杆菌O157∶H7[J]. 中国人兽共患病学报, 2015,31(2):183-188.DOI: 10.3969/j.issn.1002-2694.2015.02.019
Isolation and identification ofE.coliO157∶H7 strain from cattle and detection of its virulence genes
ZHANG Tao,SU Zhan-qiang,XIA Li-ning,WANG Yu-meng,ZHOU Yin-ping, LIU Yuan-yuan,MAI Zhan-hai,ZHANG Cai-yun,YAO Gang,KUANG Ling
(CollegeofVeterinaryMedicine,XinjiangAgriculturalUniversity,Urumqi830052,China)
To study theE.coliO157∶H7 carrying status of healthy cattle and the possibilities of the bacteria cause illness of human beings, 85 freshly collected healthy cattle fecal samples were screened with SMAC plate and MUG test after enrichment, and then PCR and biochemical tests were used to identify those SMAC and MUG negative strains. In order to determine the virulence of isolatedE.coliO157: H7,Stx1,Stx2,eaeA,tccpandHlywere detected by PCR, and mice were challenged by intraperitoneal injection of the bacteria. Result showed that only one strain ofE.coliO157: H7 was isolated and identified among 85 fecal samples; the isolate rate was 1.176%; and the isolate carried all five virulence genes which has been detected before; all challenged mouse died within 24 hrs.In conclusion,E.coliO157∶H7 strains are existed in cattle of Yili Prefecture in Xinjiang, considering the reality that the isolated strain carrying all five virulence genes and the capability of killing the mouse, there is a potential threatening to those people who consume cattle productions.
cattle;E.coliO157∶H7; isolation and identification; virulence genes; animal toxicity test
s: Kuang Ling, Email:Kuangling62@126.com; Yao Gang, Email: yaogang516@163.com
10.3969/j.issn.1002-2694.2015.12.010
新疆维吾尔自治区自然科学基金项目(No.2014211A028)
况玲,Email:Kuangling62@126.com 姚刚,Email: yaogang516@163.com
新疆农业大学动物医学学院,乌鲁木齐 830052
R378.2
A
1002-2694(2015)12-1136-06
2015-06-05;
2015-09-03
Supported by the Natural Science Foundation of the Xinjiang Uygur Autonomonus Region(No.2014211A028)

