以减毒沙门氏菌为载体的抗贾第虫肠溶疫苗制备及免疫效果检测
崔佰吉,李 瑶,张宏梅,姜晓明,冯宪敏
以减毒沙门氏菌为载体的抗贾第虫肠溶疫苗制备及免疫效果检测
崔佰吉,李 瑶,张宏梅,姜晓明,冯宪敏
目的 以携带α1-giardin DNA的减毒沙门菌为对象,探讨肠溶制剂的制备、免疫剂量和免疫效果。方法 携带有贾第虫α1-giardin基因的重组减毒沙门菌经培养扩增冻干后,对各种辅料,包括微分硅胶、分散剂、润滑剂、崩解剂、包衣液等成分与减毒沙门菌的相容性,及包衣条件进行检测。采用最佳配方制备肠溶片剂,用于动物免疫试验。初始免疫后第25 d后,分别检测血清和小肠灌洗液中抗rα1-giardin特异性IgG和SIgA的水平;并用106个贾第虫滋养体灌胃,每天检测各组小鼠粪便中的滋养体和(或)包囊的排出率。结果 肠溶片剂的处方中微分硅胶和分散剂的用量分别为菌粉用量的10%和2倍;润滑剂和崩解剂的用量分别占处方量的0.8%和2%;包衣液的浓度为20%,包衣增重为处方量的6%。每个包衣片活菌含量在4×106以上。动物试验表明,以SL7207/pVAX1-rα1-giardin肠溶片剂免疫鼠小肠灌洗液中特异性抗rα1-giardin SIgA的水平明显高于对照组,并在攻虫试验具有46.7%的减虫率,明显高于rα1-giardin肌注免疫组(23%)(P<0.01)。结论 本研究为多种以减毒沙门菌为载体的DNA疫苗的肠溶制剂的研究提供了实验依据,如规模化生产,该处方尚需进一步完善。
减毒沙门菌;蓝氏贾第鞭毛虫;α1-贾第素;肠溶疫苗
利用侵袭性胞内细菌作为载体传递外源抗原基因疫苗是目前基因免疫研究的热点。沙门菌是一种胞内侵袭性细菌,通过化学诱变、抗生素诱变和基因工程等方法使其失去了对动物的致病性,但不影响其在体内的繁殖和侵袭能力,此为减毒沙门菌[1]。研究表明,减毒沙门菌能够有效地刺激机体产生黏膜、细胞和体液免疫应答,是携带外源基因的良好载体和天然黏膜免疫佐剂,已广泛应用于多种病原菌(如链球菌、结核杆菌、幽门螺杆菌和艰难梭菌等)[2-5]、病毒(如新城疫病毒等)[6]、寄生虫(旋毛虫和疟原虫等)[7-8]和抗肿瘤[9-10]疫苗的研发。目前,减毒沙门菌作为载体,其最为有效的免疫途径为黏膜免疫,免疫的最终效果取决于活菌疫苗的有效剂量。对于贾第虫等肠道寄生病原体,主要刺激肠黏膜产生分泌型IgA抗体,通过黏膜免疫途径可大大提高免疫接种的效果。而肠溶制剂则可有效控制活菌疫苗的使用剂量,提高疫苗的有效性和安全性。
贾第虫α1-贾第素(α1-giardin)是定位于贾第虫滋养体浆膜表面的一组胶连蛋白(Annexin),在贾第虫包囊向滋养体转化(出囊),及滋养体感染粘附过程中发挥重要的作用。研究表明以减毒沙门菌作为载体的α1-giardin基因活菌疫苗,通过灌胃的方法,可有效减少小鼠模型小肠中滋养体的寄生数量,表现了有意义的保护性作用[11]。本研究以携带α1-giardin DNA的减毒沙门菌为对象,探讨肠溶制剂的制备、免疫剂量和免疫效果。
1 材料与方法
1.1 仪器与试药 单冲压片机(TDP-5 中南制药机械厂);小型包衣机(BY300A 上海黄海药检仪器有限公司);冷冻干燥机(Scientz-12SN 宁波生物科技股份有限公司)。微晶纤维素(德国VIVAPUR Type101,批号:6610124526);淀粉(天津市瑞金特化学品有限公司,批号:2010年01月22日);微分硅胶(安徽山河药用辅料有限公司,批号:091201);羧甲基淀粉钠(安徽山河药用辅料有限公司,批号:091220);硬脂酸镁(国药集团化学试剂有限公司,批号:F20061128);欧巴代薄膜包衣预混剂93018509白色(上海卡乐康包衣技术有限公司,批号:SH563179);磷酸二氢钾(天津市福晨化学试剂厂,批号:20110512);氢氧化钠(天津市瑞金特化学品有限公司,批号:2010年01月19日)。
1.2 重组减毒沙门菌制备 携带有贾第虫α1-giardin基因的重组减毒沙门菌由本实验室前期构建,-80 ℃冻存。用时,取少量接种于含有1 mg/mL卡那霉素的50 mL LB培养基中,37 ℃培养过夜。次日离心(8 000 r/min 10 min),收集菌体,重悬于5 mL菌体保护剂中(2.5%蔗糖,5%脱脂奶粉),冻干。称取0.001 g菌粉溶于5 mL无菌生理盐水中,用生理盐水稀释104倍后,分别取5 μL、10 μL、20 μL和50 μL,在含有1 mg/mL的LB琼脂培养基上进行培养,计数菌落,计算冻干粉的细菌活性。
1.3 处方的选择
1.3.1 微分硅胶用量 称取4份1g菌粉,分别按比例加入0.06 g(6%)、0.08 g(8%)、0.10 g(10%)和0.12 g(12%)的微分硅胶,在研钵中研匀,以混合物分散均匀、无粘连为考察指标,进行微分硅胶用量的选择。
1.3.2 稀释剂的用量 微晶纤维素和淀粉为片剂常用的稀释剂,微晶纤维素成型效果好,但粘合度欠缺,添加淀粉进行补充,使制剂制备过程中的颗粒成型效果良好。以稀释剂用量选择为菌粉用量的2倍,分别考察微晶纤维素∶淀粉(3∶1、2∶1、1∶1、1∶2)的用量比例,用量选择设计见表1。以颗粒的制备难易程度和颗粒成型效果为考察指标。
1.3.3 润滑剂用量 硬脂酸镁为润滑剂,主要考察颗粒的流动性,以休止角为考察指标确定硬脂酸镁的用量,硬脂酸镁用量分别为处方量0.6%、0.8%、1.0%,设计处方见表2。
休止角测定方法:底盘为直径3.5 cm的平皿,将两只玻璃漏斗上下交错重叠,固定在铁架台上,下漏斗出口与底盘距离为3.5~6.0 cm之间。分别取样品若干,从上部漏斗慢慢加入,使样品经过两只漏斗的缓冲逐渐堆积在底盘上,形成锥体,直至得到最高的锥体为止。测定锥体的高H,每种样品各测定3次,取平均值,按公式计算休止角:α=arctg(H/R),α为休止角,R为底盘半径。

表1 稀释剂用量考察处方设计
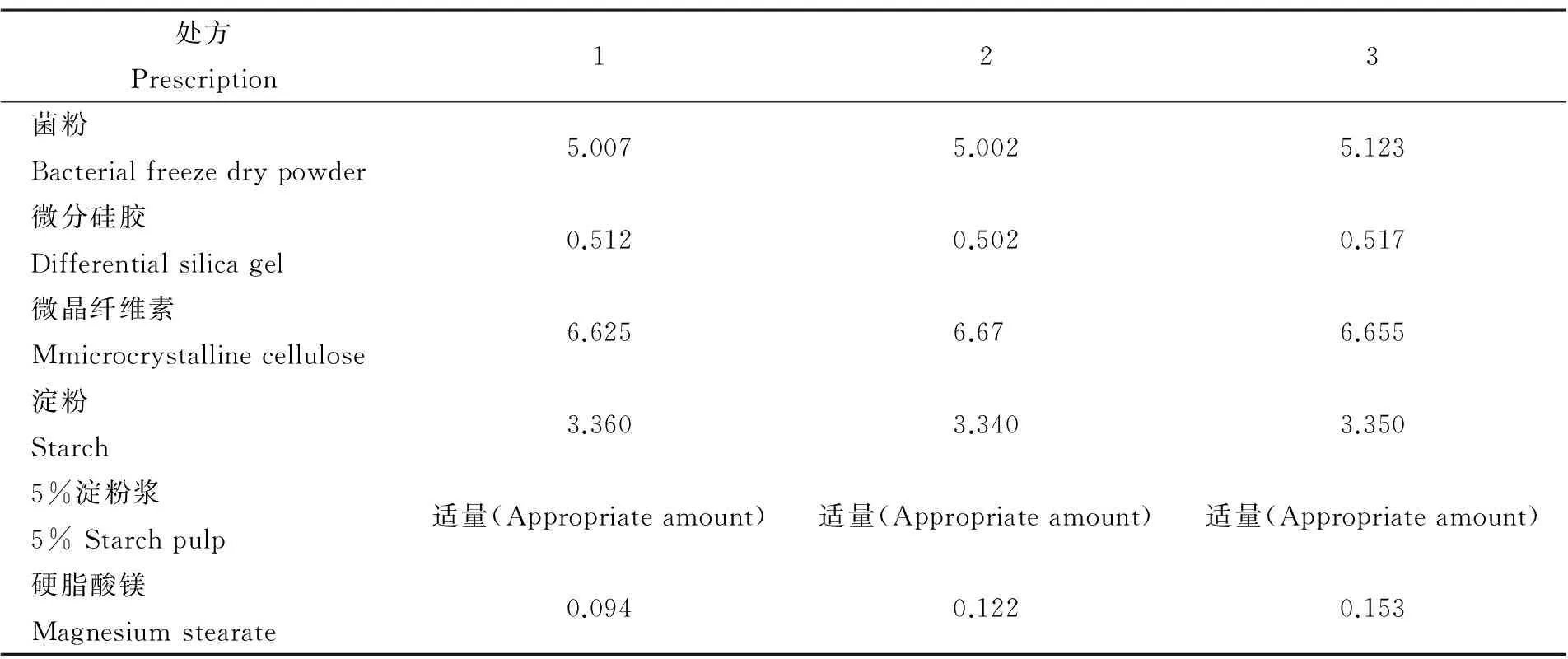
表2 硬脂酸镁用量考察处方设计
1.3.4 崩解剂用量 为保证片剂能够在体内快速释放,本制剂采用羧甲基淀粉钠(2%、4%、6%)作为崩解剂,进行片剂的制备,并按照2010版《中国药典》附录ⅩA方法[13],以片剂在pH6.8的人工肠液中的崩解速度作为考察指标,选择羧甲基淀粉钠的用量。处方设计见表3。
1.3.5 包衣液浓度 包衣采用卡乐康公司的欧巴代(雅克宜93018509)作为肠溶制剂的包衣材料。对包衣的厚度、时间、温度等加以控制。选择包衣液浓度为10%、20%、30%进行试验,以片剂增重3%为基准,记录包衣所需时间和包衣后片剂的外观。
1.3.6 片剂包衣增重 选择同一批产品3份,采用20%包衣液进行包衣,使包衣后片剂增重分别为4%、6%、8%。分别考察3个处方片剂在pH1.0人工胃液和pH6.8人工肠液中的崩解时限,以崩解时限作为考察指标,选择包衣增重量。
1.3.7 包衣工艺对菌群活力的影响 菌群的活力对温度变化比较敏感,高温可使大量的菌群失活,所以温度控制不佳会对菌群活力产生极大的影响,故选择一个处方的片剂,使用室温干燥,进行包衣,对比包衣前后细菌活力。
1.4 片剂制备 根据上述,得到最佳处方(表4)。称取适量菌粉(每片细菌含量为4×108),加入处方量微分硅胶,研磨分散均匀后加入处方量的微晶纤维素和淀粉,混匀,加入处方量的羧甲基淀粉钠,混匀。5%淀粉浆适量制软材,20目筛制颗粒,避光、室温下干燥4 h得干燥颗粒,加入处方量的硬脂酸镁,混匀、压片,制备好的片剂采用预先制备好的浓度为20%包衣液进行包衣,包衣至片剂增重6%,即得。共进行3个批次产品的制备,并进行崩解时限和菌群活力的检查。

表3 崩解剂考察处方设计

表4 最佳处方标
1.5 免疫效果检测
1.5.1 免疫与抗体检测 清洁级雌性BABL/c小鼠30只,适应性培养1周后,随机分为3组,每组10只,5只用于抗体检测,5只用于攻虫实验。组1为正常对照组。组2为肌注rα1-giardin免疫对照组,以含有rα1-giardin 20 μg/100 μL的抗原加等量完全弗氏佐剂背部多点皮下注射。隔周用不完全佐剂与重组蛋白混合,以同样剂量加强,共加强2次。末次免疫后10 d(初始免疫后第25 d),随机挑取5只小鼠,眼球取血处死,采集血液置37 ℃,孵育30 min,3 000 r/min,4 ℃离心10 min,收集血清,1∶3 000稀释,以rα1-giardin蛋白包被96孔板,进行血清IgG抗体检测。收集小鼠十二指肠灌洗液,检测总SIgA抗体浓度。抗体检测采用酶联免疫吸附法进行,所用抗体购自美国R&D公司。组3为喂饲肠溶片剂组。分组后禁食4 h,每只小鼠经食管喂饲肠溶片剂1片,2 h后正常饮食。隔周以同样的方法加强喂饲1片。初始免疫后第25 d随机挑取5只小鼠,眼球取血处死,收集血清和小肠灌洗液,以rα1-giardin蛋白包被96孔板进行血清特异性IgG抗体和小肠特异性SIgA抗体检测。
1.5.2 攻虫实验与减虫率 蓝氏贾第鞭毛虫滋养体由本室液氮保存。实验前复苏,用改良TYI-S-33培养基培养、传代。收集对数期虫体,用无菌生理盐水稀释至106/mL用于攻虫实验。各组剩余5只小鼠在初始免疫后25 d开始禁食10 h,期间仅喂饲2%碳酸氢钠水中和胃酸。用灌胃器吸取1 mL虫液,进行灌胃,灌胃2 h后开始正常饮食。攻虫后,分别收集3组小鼠每天的粪便,连续2周,进行贾第虫滋养体和包囊检查,计算感染率和减虫率。
2 结 果
2.1 微分硅胶与稀释剂用量 微分硅胶用量考察结果显示,当微分硅胶用量为菌粉用量10%时,混合物无粘连,分散均匀,故不再增加微分硅胶的用量,选择菌粉用量10%计入处方用量。
稀释剂考察结果显示,淀粉用量越多,颗粒制备过程中越容易,主要是淀粉的粘合作用使得制软材的过程较容易,但淀粉用量过多,成型效果受到一定的影响。综合考虑,选取成型好,且制备较容易的处方2的用量,即稀释剂用量为菌粉用量的2倍,微晶纤维素∶淀粉为2∶1计入处方用量。
2.2 润滑剂与崩解剂用量 润滑剂用量考察结果显示,3个处方的硬脂酸镁的用量均能满足大生产的需求,休止角计算值分别为39°、31°和27°。为保证制剂的顺利生产,避免各批次的差异,选择表2列举的处方2中硬脂酸镁的用量计入处方量,占处方量的0.8%。
崩解剂用量考察试验结果显示,崩解剂用量为2%、4%、6%的处方量时,崩解时间分别为541 s、492 s和507 s,对该片剂的崩解影响差别不显著,所以预选崩解剂量为2%计入处方。
2.3 包衣液浓度 包衣液浓度考察结果见表5,由实验结果可知,各浓度下包衣效果区别不明显,但是在操作过程中,10%和30%的包衣液,等待干燥的时间过长,故本研究暂定包衣液浓度为20%。
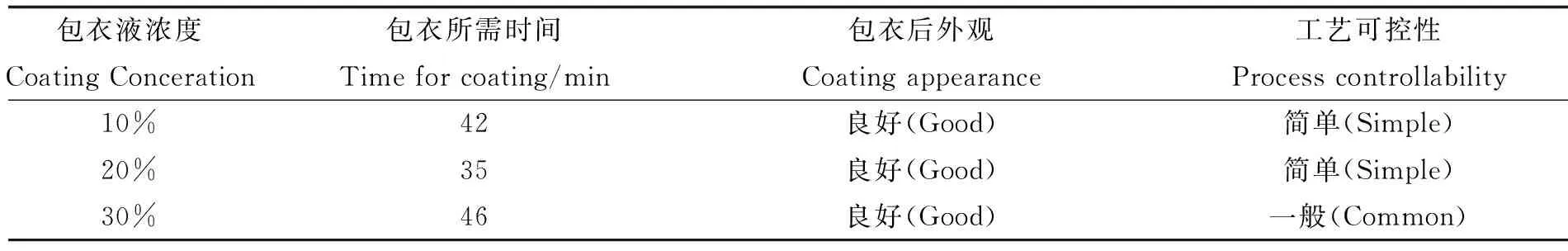
表5 包衣液浓度
2.6 片剂包衣增重 当包衣增重4%、6%、8%时, 在pH1.0的人工胃液中120 min内均没有崩解的片剂,但是增重4%的片剂外观有软化现象,故首先排除此方案。进一步考查6%、8%的处方片剂在pH6.8的人工肠液中的崩解时限,分别为18 min和25 min。均满足本制剂在胃内不崩解、不释放,在人工肠液中能够快速释放的制剂要求。本研究选择包衣增重较小的6%计入处方。
2.7 包衣工艺对菌群活力的影响 选用包衣液浓度为20%,包衣增重为6%的处方,在室温干燥的条件下进行包衣。随机挑取3个片剂,研磨后,溶于无菌生理盐水中,检测包衣前后细菌活力的变化。与包衣前平均每片4×108个细菌相比,随机挑取的3个包衣片中活菌的含量分别为4.94×106、4.25×106和4.10×106,平均接近4.3×106个活菌/片,表明包衣工序对于菌群的活力有一定的灭活作用,但是单位制剂量的活菌数均能达到4×106/片以上。
2.8 片剂制备 根据试验得到的最佳处方进行3批次片剂制备,并检测片剂的崩解时效和细菌活力。3批次(140401、140402和140403)的平均活菌数分别为5.1×106、4.50×106和4.99×106/片。崩解时间分别为21.34、20.45和21.07 min,能够满足进一步免疫效果检测的需要。
2.9 免疫效果检测 初始免疫后25 d,随机处死3组各5只小鼠,收集血清和小肠灌洗液,进行血清特异性IgG和小肠灌洗液特异性SIgA检测。正常对照组(组1)血清特异性IgG的OD450值为0.06,小肠灌洗液总特异性SIgA的浓度为150 ng/mL。组2和组3的血清特异性IgG和小肠灌洗液总SIgA抗体均出现不同程度的增高(图 1)。其中,组2血清特异性IgG(OD450=0.70)的增高,明显高于组3(OD450=0.450)(P<0.01)。组3小肠灌洗液中总特异性SIgA浓度(801 ng/mL)的增高明显高于组2(442 ng/mL)(P<0.01)。
于免疫后25 d,通过106对数期贾第虫滋养体灌胃的方法对各组小鼠进行攻虫试验。攻虫后,连续2周,计数每天粪便中的滋养体或包囊,检测感染率和减虫率。3组的感染率分别为100%、100%和40%(表6)。其中,组1在攻虫后次日,2只小鼠出现腹泻症状,并在腹泻粪便中查到滋养体,另外3只在第5日开始有形粪便中可查到包囊,第5和第6日平均包囊排出数为15个/只。组2在攻虫后次日,1只出现轻微腹泻症状,可查见滋养体,其余4只分别于第5和第6日开始在粪便中查到包囊,第5日和第6日平均包囊排出数为11.5个/只,同组1相比减虫率为23%(3.5/15)。组3的在第5和第6日的包囊平均排出数为8,同组1相比减虫率为46.7%(7/15)。

图1 3组实验小鼠免疫后血清IgG和小肠灌洗液SIgA检测
表6 免疫后贾第虫感染率和减虫率标亮处加英文对照
Tab.6 Infection and reduction rates ofGiardialambliain mouse after immunization

组别Group滋养体Trophozoites包囊Cysts感染率*(%)Infectionrates减虫率*(%)ProtozoanreductionrateGroup12/53/5100-Group21/54/510023Group30/52/54046.7
Note: *P<0.01
3 讨 论
减毒沙门菌活载体因其特殊的优势日渐成为目前基因免疫研究的热点。基于减毒沙门菌构建的疫苗株可持续表达相应抗原,不仅刺激机体产生相应的体液和细胞免疫,更可激发机体的黏膜免疫。对于提高机体的黏膜免疫屏障作用,预防黏膜病原体的入侵和定植具有重要的意义[14]。目前以减毒沙门菌为载体构建的多种口服疫苗均以菌液灌胃方式为主,虽然对相应病原体的感染可以产生很好的免疫效果,但很难对减毒沙门菌疫苗的使用剂量进行标准化。
贾第虫是引起人和多种哺乳动物腹泻的主要病原体之一。感染贾第虫后,急性期主要以腹泻为主,并排出滋养体,而慢性期一般无明显症状,但粪便中可以检出包囊[15]。本研究以携带α1-giardin DNA的减毒沙门菌为对象,进行肠溶制剂的制备,对免疫剂量进行规范。通过免疫后,受染动物滋养体和包囊的检出,对所制备肠溶疫苗的免疫效果进行分析。
在冻干过程中,由于冻干保护剂的存在,菌粉普遍存在粘性,具有一定的吸湿性,因此处方中选择加入少量微分硅胶,以达到抗粘的作用。稀释剂选择成型性较好的微晶纤维素为主,配以适量的淀粉进行调节,以达到良好的成型效果。本制剂为肠溶制剂,为保证其良好崩解、迅速释药的特性,故选择崩解效果良好的羧甲基淀粉钠作为崩解剂进行处方研究。此外,为保证制剂制备过程中颗粒流动性良好,选择硬脂酸镁作为润滑剂,5%淀粉浆为粘合剂。
本肠溶疫苗制备的重点和难点在于原料菌的活力保持。片剂制备过程中,进行了各种辅料与减毒沙门菌相容性研究。结果表明,在上述试验条件下,各种辅料不影响减毒沙门菌的活力,能够很好的应用于减毒沙门菌肠溶制剂的制备。预实验中,检测了颗粒干燥温度和压片压力对于菌活力的影响,结果颗粒干燥温度30 ℃,45 min时菌群失活明显,所以本研究采用室温风干的方法进行颗粒干燥,在大生产过程中有待进一步改进。本研究分别选择压力40、60和80 KN的片剂进行活力检查,结果表明,各种压力下菌群活力没有明显差异,因此压片过程中的压力可以根据实际需要进行调节。
此外,根据本研究包衣过程存在一定的菌群失活的现象,主要是由包衣过程中热风干燥引起,且在整个包衣过程的初始阶段最为明显。为最大限度的保证菌群活力的保持,干燥过程中热风的使用应该严格控制,在大生产过程中应进行严格的量化标准。
采用标准免疫流程,初始免疫为1片,隔周1片加强免疫1次。初始免疫后25 d进行攻虫实验。结果表明,以减毒沙门菌为载体的肠溶免疫的方式可以产生更有效的减虫率(46.7%)。胃酸对口服活菌疫苗具有杀伤作用。因此以往直接采用菌液灌胃的免疫,很难对所用菌量进行规范。而肠溶片剂可避免胃酸的影响,使携带有目的抗原DNA的减毒沙门菌直接到达小肠,呈递目的抗原,并刺激肠粘膜淋巴细胞分泌SIgA,有效防止经黏膜感染的病原体在肠粘膜表面的定居和致病。
综上,本研究为多种以减毒沙门菌为载体的DNA疫苗的研发和规模化生产提供了依据。然而由于本研究所制备的片剂处方对细菌的活力具有一定的影响,因此尚需进一步的完善。
[1]Zhang ML, Zhang CJ, Cheng XC. Advances in attenuation for salmonella and attenuated salmonella as vaccine carrier[J]. J Biol, 2012, 29(2): 65-68. (in Chinese) 张明亮,张春杰,程相朝.沙门氏菌减毒及其作为疫苗活载体的研究进展[J].生物学杂志,2012,29(2):65-68.
[2]Muralinath M, Kuehn MJ, Roland KL, et al. Immunization withSalmenellaentericaserovar Typhimurium-derived outer membrane vesicles delivering the pneumococcal protein PspA confers protection against challenge withStreptococcuspneumoniae[J]. Infect Immun, 2011, 79(2): 887-894.
[3]Hess J, Grode L, Hellwig J, et al. Protection against murine tuberculosis by an attenuated recombinantSalmonellatyphimuriumvaccine strain that secretes the 30-kDa antigen ofMycobacteriumbovisBCG[J]. FEMS Immunol Med Microbiol, 2000, 27(4): 283-289.
[4]Liao WJ, Chen H, Zhu SL, et al. AttenuatedSalmonellatyphimuriumbivalent vaccine strain expressing urease A subunit and catalase induces protective immunity againstHelicobacterpyloriinfection[J]. Chin J Microbiol Immunol, 2001, 21(6): 642-646. (in Chinese) 廖文俊,陈湖,朱森林,等. UreA/ KatA 双价减毒沙门菌疫苗株抗幽门螺杆菌的免疫保护作用[J]. 中华微生物学和免疫学杂志, 2001,21(6):642-646.
[5]Ghose C, Verhagen JM, Chen X, et al. Toll-like receptor 5-dependent immunogenicity and protective efficacy of a recombinant fusion protein vaccine containing the nontoxic domains of Clostridium difficile toxins A and B andSalmonellaentericaserovar typhimurium flagellin in a mouse model ofClostridiumdifficiledisease[J]. Infect Immun, 2013, 81(6): 2190-2196. DOI: 10.1128/IAI.01074-12
[6]Fang WH, Liang XY, Li JR. Induction of protective immune responses against Newcastle Disease Virus by DNA vaccine using attenuatedSalmonellatyphimuriumas carrier[J]. Chin J Vet Sci, 2003, 23(6): 527-529. (in Chinese) 方维焕,梁雪芽,李建荣. 减毒沙门氏菌为载体传递DNA疫苗诱导对新城疫病毒的免疫保护[J].中国兽医学报,2003,23(6):527-529.
[7]Yang Y, Zhang Z, Yang J, et al. Oral vaccination with Ts87 DNA vaccine delivered by attenuatedSalmonellatyphimuriumelicits a protective immune response againstTrichinellaspiralislarval challenge[J]. Vaccine, 2010, 28(15): 2735-2742. DOI: 10.1016/j.vaccine.2010.01.026
[8]Leal MT, Camacho AG, Teixeira LH, et al. Immunogenicity of recombinant proteins consisting ofPlasmodiumvivaxcircumsporozoite protein allelic variant-derived epitopes fused withSalmonellaentericaSerovar Typhimurium flagellin[J]. Clin Vaccine Immunol, 2013, 20(9): 1418-1425. DOI: 10.1128/CVI.00312-13
[9]Xu X, Hegazy WA, Guo L, et al. Effective cancer vaccine platform based on attenuated salmonella and a type III secretion system[J]. Cancer Res, 2014, 74(21): 6260-6270. DOI: 10.1158/0008-5472.CAN-14-1169
[10]Drees J, Mertensotto M, Liu G, et al. AttenuatedSalmonellaentericaTyphimurium reduces tumor burden in an autochthonous breast cancer model[J]. Anticancer Res, 2015, 35(2): 843-849.
[11]Weeratunga SK, Osman A, Hu NJ, et al. Alpha-1 giardin is an annexin with highly unusual calcium-regulated mechanisms[J]. J Mol Biol, 2012, 423(2): 169-181. DOI: 10.1016/j.jmb.2012.06.041
[12]Jenikova G, Hruz P, Andersson MK. A1-giardin based live heterologous vaccine protects againstGiardialambliainfection in a murine model[J]. Vaccine, 2011, 29(51): 9529-9537. DOI: 10.1016/j.vaccine.2011.09.126
[13]Chinese Pharmacopoeia Commission. Chinese Pharmacopoeia 2010 Edition[S]. Beijing: CPC medical science and Technology Press, 2005,22-283. (in Chinese) 国家药典委员会.中国药典2010版[S]. 北京:中共医药科技出版社,2005:22-283.
[14]Loessner H, Endmann A, Leschner S, et al. Improving live attenuated bacterial carriers for vaccination and therapy[J]. Int J Med Microbiol, 2008, 298(1/2): 21-26.
[15]Adam RD. Biology ofGiardialamblia[J]. Clin Microbiol Rev, 2001, 14: 447-475.
Preparation and immune effect of an anti-Giardiaenteric vaccine using attenuatedSalmonellatyphimuriumas a carrier
CUI Bai-ji,LI Yao,ZHANG Hong-mei,JIANG Xiao-ming,FENG Xian-min
(JilinMedicalUniversity,Changchun132013,China)
This study further investigated the preparation of enteric coated capsule of attenuatedSalmonellacarrying α1-giardin DNA, its immunization regime and vaccine efficacy againstGiardiachallenge. AttenuatedSalmonellacarrying α1-giardin DNA was cultured and freeze lyophilized, then formulated with different ingredients including colloidal silicon dioxide, dispersant (microcrystalline cellulose and starch), lubricants (magnesium stearate), disintegrating agents (sodium starch glycolate), and the coating liquid was at optimized ratio. The enteric formulation was optimized and used for mouse vaccine trial. Total 30 female BABL/c mice were randomly divided into three groups: the first group of 10 mice was just given PBS orally as normal control (Group 1), second group of 10 mice were immunized with recombinant α1-giardin protein intramuscularly as control (Group 2), another 10 mice was orally immunized with enteric capsule of DNA vaccine (Group 3). On day 25 post immunization, five mice from each group were sacrificed and anti-α1-giardin IgG level was measured in sera, IgA antibody measured in intestinal lavage. The remaining five mice from each group were challenged with 105ofGiardiatrophozoites by gavage after being fasted for 10 hours. TheGiardiatrophozoites and cysts were examined in the feces for two consecutive weeks. Based on the compatibility test results, the best formulation was obtained as following composition: colloidal silicon dioxide was as 10% and dispersant (the ratio of microcrystalline cellulose and starch is 2∶1) as 8% of bacterial pellet volume; the amount of lubricant and disintegrant were as 0.8% and 2% of the dose, respectively; concentration of coating liquid was 20%, the coating weight gained 6% of the formulated amount. Each coated capsule contained viable bacteria of 4 × 106or more. Results of immunological tests and challenge showed that the specific anti-α1-giardin IgA level in intestinal lavage in the group given with enteric capsule of DNA vaccine was significantly higher than that in groups of intramuscular immunization and normal control, which reflected on the parasite reduction rate of 46.7% in enteric vaccine compared to normal control that was significant higher than 23% in intramuscular immunization group (P<0.01). This study provides an experimental basis for making DNA vaccine delivered by attenuatedSalmonellaand enteric coated vaccine formulation, however, the formulation still needs to be further optimized for large scale production.
attenuatedSalmonellatyphimurium;Giardialamblia; α1-giardin; enteric vaccine
Feng Xian-min, Email: fengxianmin28@163.com
10.3969/j.issn.1002-2694.2015.12.009
国家自然科学基金(No.81301450,31572262),吉林省科技厅国际合作项目(No.20130413035GH),吉林省教育厅科研项目(No.2014367)和吉林市杰出青年项目(No.201464037)联合资助
冯宪敏,Email:fengxianmin28@163.com
吉林医药学院,长春 132013
R378.2
A
1002-2694(2015)12-1129-07
2015-03-20;
2015-07-06
Supported by grants from the National Natural Science Foundation of China (No. 81301450,31572262), a grant from the Jilin Provincial Science, the Technology Department of China (No. 20130413035GH),a grant from the Education Department of Jilin Province (No. 2014367) and grant for Preeminent Youth Fund of Jilin City(No.201464037)

