羊口疮病毒F1L和B2L基因真核表达质粒构建及其在MDBK细胞中的表达
刘 嫒,冯 将,鲜思美,刘宗胜,李鹏飞,罗代兵
羊口疮病毒F1L和B2L基因真核表达质粒构建及其在MDBK细胞中的表达
刘 嫒1, 2,冯 将1, 2,鲜思美1, 2,刘宗胜3,李鹏飞1,2,罗代兵1, 2
目的 为构建羊口疮病毒F1L和B2L基因真核表达质粒,同时验证其在MDBK细胞中的表达。方法 本试验以pVAX1为真核表达载体,在前期构建的克隆质粒pMD18-T-B2L和pMD18-T-F1L基础上,构建真核表达质粒pVAX1-F1L和pVAX1-B2L,对其分别进行双酶切和测序鉴定,将鉴定正确的真核表达质粒pVAX1-F1L和pVAX1-B2L转染至MDBK细胞,采用RT-PCR和间接免疫荧光试验(IFA)检测目的基因表达。结果 双酶切鉴定和序列测定表明真核表达质粒pVAX1-F1L和pVAX1-B2L构建成功,RT-PCR和IFA同时验证目的基因在MDBK细胞浆中能瞬时表达。结论 本试验构建成功的真核表达质粒为下一步羊口疮病毒核酸疫苗研究奠定基础。
羊口疮病毒;F1L基因;B2L基因;真核表达
羊口疮(Orf),又名羊传染性脓疱、羊传染性脓疱皮炎、羊传染性脓疱口炎,是由羊口疮病毒(Orf virus,OrfV)引起的绵羊和山羊急性、高度接触性、嗜上皮性人兽共患传染病[1]。羊口疮病毒为副痘病毒属成员之一,基因组全长134~139 kb,中央编码区(ORFs009-111)较为保守。B2L与F1L基因分别位于羊口疮病毒第11和第59个完整开放阅读框,高度保守,编码42 kD和39 kD蛋白[2]。其中,42 kD蛋白是病毒核衣壳主要结构蛋白之一,可诱导机体产生强烈的免疫应答;39 kD蛋白是构成病毒表面微管的主要成分之一,能刺激机体产生中和抗体[3]。 二者均能引起机体产生免疫应答,同时与病毒的吸附和侵入有关,是研究较多的、具良好免疫原性的蛋白。
羊口疮感染的典型症状是口、鼻、唇及外阴部皮肤出现菜花样增生性损伤,也可感染齿龈、舌头或其它部位。通常羊口疮病毒引起羊群发病率高,致死率低,但羊口疮病导致病羊呼吸、采食困难和继发其他病毒或细菌混合感染,从而引起病羊死亡[4],3~6月龄羔羊易发本病。临床治疗羊口疮一般采用保守疗法,消炎收敛,主要以抗生素控制继发感染为主。疫苗接种为控制羊口疮病的较为有效的手段。国外常用D1701株弱毒疫苗,国内关于羊口疮地方株自制灭活疫苗和弱毒苗的研究。由于羊口疮疫苗仍处于研究阶段,且需求量相对较少,国内很难买到羊口疮市售疫苗。此外,传统疫苗可能会出现免疫后抗体水平不高、毒力返强等现象,快速高效、经济适用、安全方便的新型疫苗则解决这一难题。核酸疫苗是近年来研究较为多的新型疫苗。关于羊口疮病的核酸疫苗研究较少,赵魁[5]用真核表达载体pCDNA3.1(+)成功构建并表达了pCDNA3.1-ORFV 011(B2L)、pCDNA3.1-ORFV 059(F1L)和pCDNA3.1-ORFV 011(B2L)-linker-ORFV(F1L)疫苗质粒;张克山[6]等用真核表达载体pVAX1取代pCDNA3.1,成功构建了更为安全的DNA疫苗质粒pVAX1-B2L。但采用pVAX1载体构建OrfV B2L和F1L基因核酸疫苗未见报道。
本试验以羊口疮病毒B2L和F1L基因为目的基因,构建真核表达质粒pVAX1-B2L和pVAX1-F1L,二者转染至MDBK细胞后,通过RT-PCR和IFA验证该基因的表达,为羊口疮病毒基因核酸疫苗及下一步双基因核酸疫苗研究奠定基础。
1 材料与方法
1.1 材料 大肠杆菌DH5α感受态细胞、pMD18-T-F1L、pMD18-T-B2L克隆质粒、pVAX1质粒及OrfV 高免阳性血清由贵州大学动物疫病研究室保存;T4 DNA 连接酶、质粒小提试剂盒、RNA提取试剂盒、HiFiScript cDNA第一链合成试剂盒购自北京康为世纪生物科技有限公司;胶回收试剂盒、无内毒素质粒提取试剂盒购自天根生化科技(北京)有限公司,脂质体2000(Lipofatamiane 2000)购自美国Invitrogen公司;兔抗羊IgG-FITC购自北京博奥森公司。
1.2 引物设计与合成 根据本研究前期提交的OrfV-GZF1L基因(登录号:KP057582)和B2L基因(登录号:KP994595),结合pVAX1真核表达载体多克隆位点,设计B2L和F1L基因特异性引物。选用Hind Ⅲ和EcoR Ⅰ作为酶切位点,在5′端的Hind Ⅲ酶切位点后添加Kozak序列(ACCACC)。引物由上海英潍捷基公司合成,序列见表1:
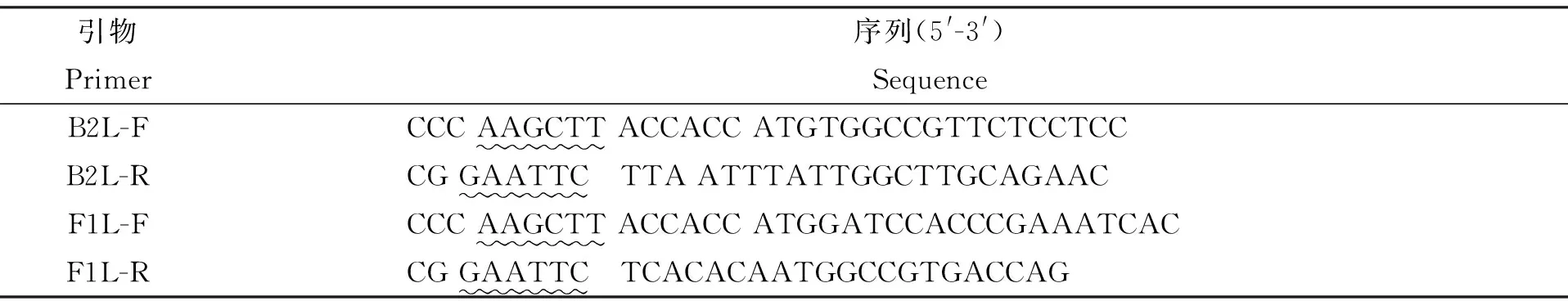
表1 加Kozak序列的F1L和B2L基因的引物序列
1.3 目的基因扩增 以pMD18-T-B2L和pMD18-T-F1L克隆质粒为模板,进行PCR扩增。PCR反应体系为25 μL,分别取模板2 μL,上、下游引物(10 μmol/L)各1 μL,2× PCR Mix 12.5 μL ,ddH2O补至25 μL。PCR反应条件:94 ℃预变性3 min;94 ℃变性45 s,54℃退火45 s,72 ℃延伸1min,30个循环;72 ℃终延伸10 min。取扩增产物10 μL于1%琼脂糖凝胶电泳上检测。
1.4F1L和B2L基因重组真核表达质粒的构建 按照胶回收试剂盒说明书,分别回收纯化目的片段,将F1L和B2L基因及真核表达载体pVAX1均用Hind Ⅲ和EcoR Ⅰ进行双酶切,酶切体系20 μL,分别取目的基因或载体6 μL,10×buffer 2 μL,Hind Ⅲ(10 U/μL)和EcoR Ⅰ(10 U/μL)各取1 μL,ddH2O补至20 μL, 37 ℃酶切3 h。酶切后用胶回收试剂盒,分别将目的基因和pVAX1载体回收,再用T4 DNA连接酶连接,连接体系为pVAX1载体5 μL,目的DNA片段1 μL,10×Ligation Buffer 2 μL,T4 DNA Ligase(5 U/μL) 0.2 μL,ddH2O 11.8 μL,22 ℃孵育10 min。将连接产物转化至感受态DH5α大肠杆菌,涂布于含Kana霉素抗性LB平板,37 ℃过夜培养,挑选单菌落于含Kana霉素的LB液体培养基中,37 ℃恒温振荡培养过夜。使用质粒小量提取试剂盒,提取菌液中质粒。
1.5F1L和B2L基因重组真核质粒的鉴定 对1.4所提的重组质粒双酶切鉴定,同时送往上海英潍捷基公司测序。
1.6 重组质粒pVAX1-F1L和pVAX1-B2L的转染 使用无内毒素质粒提取试剂盒,抽提真核表达质粒pVAX1-F1L和pVAX-B2L,分光光度计测定浓度及纯度,选择OD260与OD280比值在1.8~2.0之间对应的质粒,并计算浓度。按脂质体转染说明书,将真核表达质粒转染至培养MDBK细胞12孔板内。转染前MDBK细胞约90%~100%铺满,空载体对照组为相同剂量的pVAX1载体,空白对照组为正常培养细胞。
1.7 RT-PCR检测重组真核表达质粒瞬时表达 转染48 h后,使用RNA提取试剂盒提取真核质粒转染组以及对照组细胞总RNA,用HiFiScript cDNA第一链合成试剂盒将RNA逆转录成cDNA,再采用1.2 中特异性引物通过1.3中PCR方法检测重组质粒表达情况。
1.8 间接免疫荧光检测真核质粒瞬时表达 转染48 h后,取出12孔板,弃掉培养液,PBS洗涤3次,每次5 min,自然干燥后,滴加40 g/L多聚甲醛固定20 min,PBS洗涤3次,每次5 min;滴加0.5% Trition穿透细胞15 min,PBS洗涤,5% BSA 37 ℃封闭1 h,PBS洗涤。加入1∶50倍比稀释OrfV 高免阳性血清,37 ℃孵育1 h,PBS洗涤;加入兔抗羊IgG-FITC(1∶500),PBS洗涤3次,自然干燥后置于荧光显微镜下观察。同时设正常对照组,空载体组和同形对照组。同形对照组不加阳性血清,其余步骤相同,用于观察细胞与荧光标记抗体间的本底显色。
2 结 果
2.1 目的基因扩增 以构建好的pMD18-T-F1L和pMD18-T-B2L克隆质粒为模板分别扩增F1L和B2L基因,经琼脂糖凝胶电泳显示,F1L基因大小约为1 029 bp,B2L基因大小约为1 137 bp,与预期片段大小相符(图1)。
2.2 重组真核质粒鉴定 通过HindⅢ和EcoRⅠ将构建好的pVAX1-F1L和pVAX1-B2L分别双酶切,可见pVAX1-F1L有一条约1 029 bp的目的条带及约3.0 kb的空载体条带,pVAX1-B2L有一条约1 137 bp的目的条带及约3.0 kb的空载体条带,与预期相符(图2)。测序结果表示F1L和B2L基因和pVAX1载体连接正确。将双酶切与测序结果鉴定为阳性的重组真核表达质粒,命名为pVAX1-F1L和pVAX1-B2L。
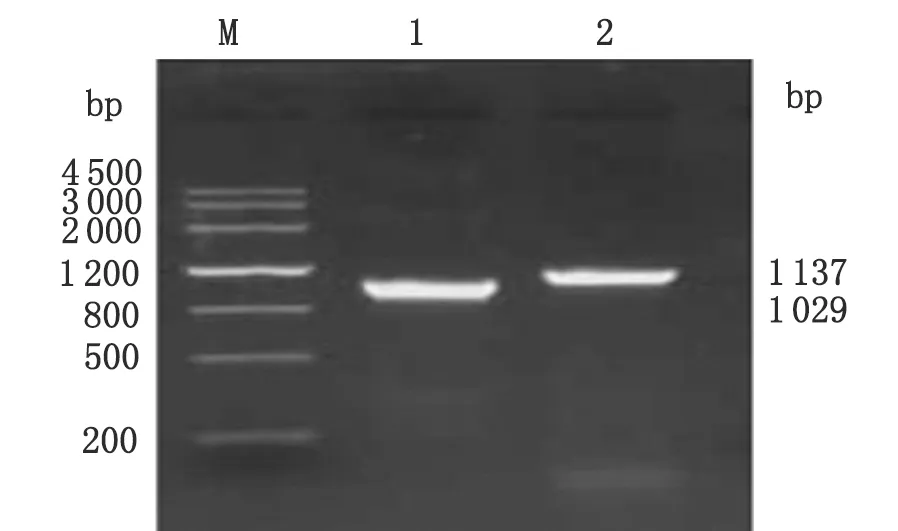
M:DNA Marker III; 1: F1L products; 2: B2L products.

M: DNA Marker III; 1: Recombinant plasmid of pVAX1-F1L; 2: The pVAX1-F1L digested withHind Ⅲ andEcoR I;3: Recombinant plasmid of pVAX1-B2L; 4: The pVAX1-B2L digested withHindⅢ andEcoRI; 5: The non-carrier of pVAX1 vector.
图2 pVAX1-F1L和pVAX1-B2L酶切鉴定
Fig.2 Enzyme digestion identification of recombinant plasmid pVAX1-F1L and pVAX1-B2L
2.3 RT-PCR检测重组真核表达质粒瞬时表达 真核表达质粒pVAX1-B2L和pVAX1-F1L转染MDBK细胞48 h后,提取细胞总RNA,用F1L和B2L基因特异性引物,通过两步法RT-PCR检测细胞总RNA,检测到目的基因表达(图3)。
2.4 IFA检测B2L和F1L基因的表达 按1.7方法进行IFA检测,结果显示,重组质粒pVAX1-F1L和pVAX1-B2L组转染MDBK细胞48 h后,细胞胞浆可见绿色荧光(图A,图B),同形对照组未见荧光(图A-1,图B-1),pVAX1空载体组及正常细胞组未见绿色荧光(图C,图D)。
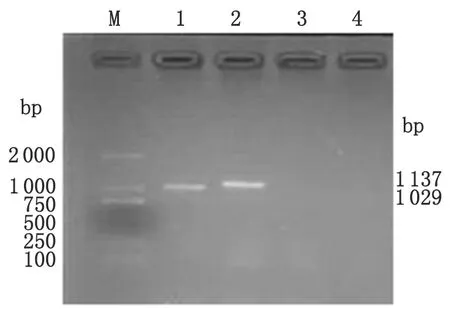
M: Marker D2 000; 1: MDBK cells transfected by pVAX1-F1L ; 2: MDBK cells transfected by pVAX1-B2L; 3: MDBK cells transfected by non-carrier of pVAX1 vector; 4: The normal MDBK cells.
图3 F1L和B2L基因 mRNA的RT-PCR鉴定
Fig.3 RT-PCR identification of F1L and B2L
3 讨 论
Orf具高度接触性、传染性、诱导继发感染,且人兽共患[7-8],同时OrfV能在结痂部位或环境中长期存在,重复感染同一宿主,还引起继发感染,造成该病的防治较为困难。羊口疮病的临床治疗采用保守疗法,国内通常是对患部进行清洗,擦涂5%碘酊、高锰酸钾,也可灌服解毒消疮饮[9],或使用抗生素控制继发感染。国外有报道一些抗病毒药物用于羊口疮的治疗,其中西多福韦常用于多种痘病毒的治疗,包含西多福韦/硫酸铝的一种胶体喷雾治疗羔羊口疮效果较好[10-11]。疫苗接种为防控羊口疮的有效途径,国外研究常用D1701株弱毒活疫苗,国内也有各地方株活疫苗或灭活疫苗研究。郭良兴[12]、田婷婷[13]等制备的OrfV灭活疫苗,具较好的免疫保护力。但常规疫苗免疫后可能会出现抗体持续时间短、抗体水平低、毒力返强等现象发生,同时国内较难买到市售羊口疮疫苗,所以研究羊口疮新型疫苗具有重要意义。
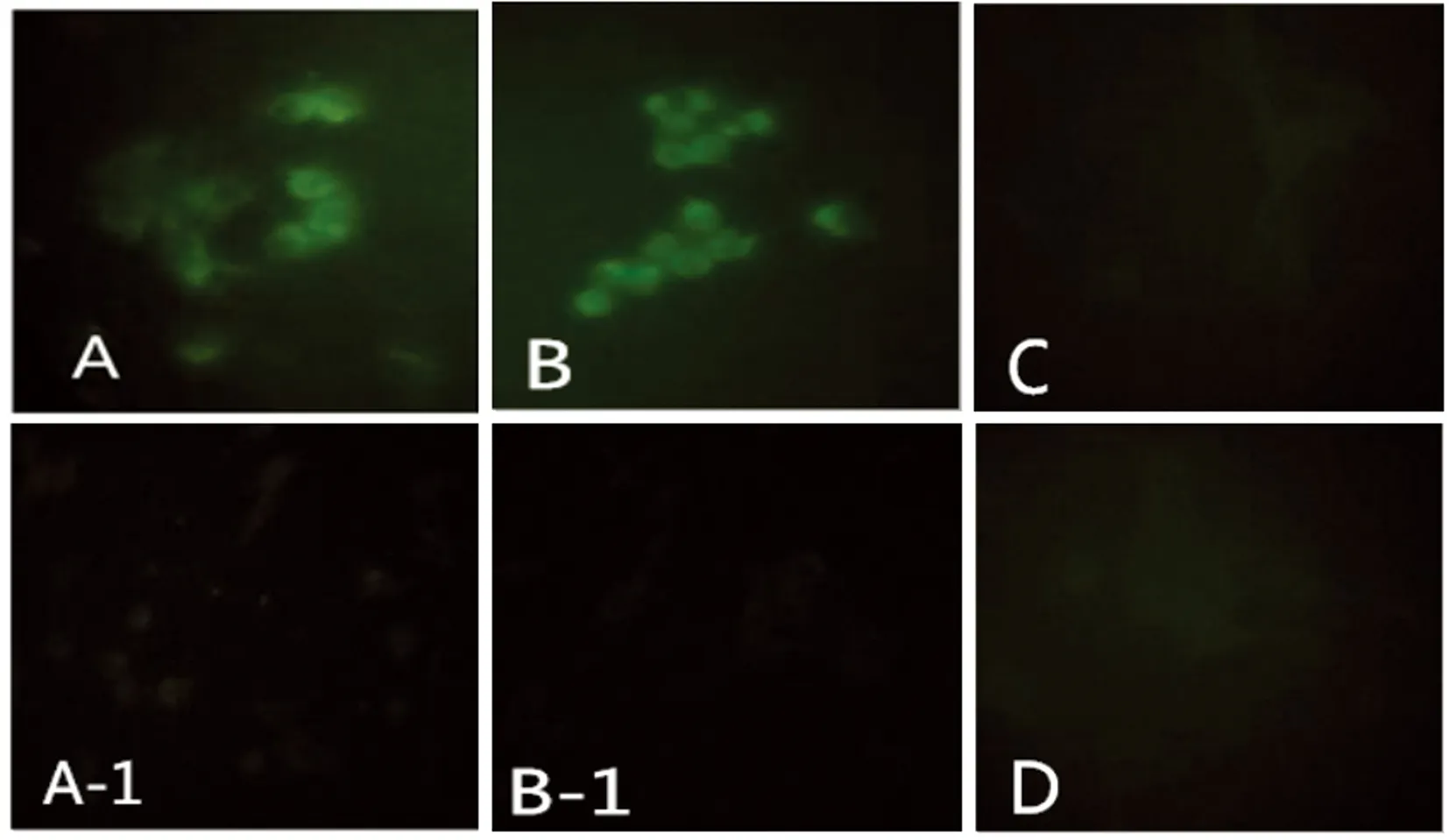
(A) Cells transfected by pVAX1-F1L, green fluorescence was observed; (A-1) Isotype Control of pVAX1-F1L group, no specific green fluorescence; (B) Cells transfected by pVAX1-B2L, green fluorescence was observed; (B-1) Isotype Control of pVAX1-B2L group, no specific green fluorescence; (C)The normal MDBK cells, no specific green fluorescence; (D) Cells transfected by non-carrier of pVAX1 vector, no specific green fluorescence.
图4 重组质粒转染MDBK细胞后IFA检测结果(400×)
Fig.4 Detection of transient expression products from recombinant plasmids in MDBK cells by IFA(400×)
新型疫苗研究中,核酸疫苗的研究较为广泛。核酸疫苗的本质是含有某种抗原基因的重组真核表达载体[14],重组表达载体依靠载体本身特有的病毒启动子和宿主的表达系统,从而使外源基因在细胞内的高效表达。用于构建核酸疫苗的真核表达载体有多种,如pHMG、pJA、pJW、pCMV、pCDNA3.1(+)、pVAX1等,带有CMV启动子的载体调节功能,它带有细菌复制子(Oric),能在大肠杆菌中高效复制。其中,pVAX1载体是用于核酸疫苗的研究中较多的载体之一,是美国FDA认可的可用于人的核酸疫苗研究的载体,其特征是携带强启动子pCMV和BGH ploy A信号,允许在大肠杆菌中进行高拷贝复制和在哺乳动物细胞中高水平瞬时表达的蛋白,已在多种传染病或寄生虫的疫苗研究中应用。pVAX1载体是在pcDNA3.1载体的基础上改造而成,该载体使用卡那霉素抗性基因替代pcDNA3.1载体的氨苄抗性基因,减少和人类基因重组的可能[15]。由于pVAX1载体是一种非融合载体,要求插入序列中5′端含一个Kozak序列、起始密码子ATG和终止密码子TGA/TAG/TAA,以增强目的基因表达效率[16]。杜宇[17]等的研究已证实以pVAX1载体构建的核酸疫苗不会引起小鼠机体产生自身免疫性疾病的抗DNA抗体,不会导致自身免疫疾病,从而证实了pVAX1载体的安全性。本研究采用pVAX1真核表达载体构建真核表达质粒pVAX1-B2L和pVAX1-F1L,同时B2L和F1L基因序列本身自带起始密码子和终止密码子,引物设计时5′端采用Kozak序列为ACCACC,以利于B2L和F1L基因的表达。此外,由于pVAX1载体在pCDNA3.1载体基础上去掉多余的序列,故在细胞中只能瞬时表达不能筛选稳定表达的细胞系[6]。
本试验成功构建OrfV 真核表达质粒pVAX-F1L和pVAX1-B2L,从mRNA水平上检测到重组质粒pVAX1-F1L和pVAX1-B2L能在MDBK细胞中转录,IFA结果也从蛋白水平证实了二者的表达,本试验研究结果为羊口疮病毒基因核酸疫苗及双基因核酸疫苗的研究奠定基础。
[1]Wen XT, Yu ES, Xu JG, et al. Zoonoses of Contemporary world[M]. Chengdu: Sichuan Publishing house of Science and Technology, 2011: 449-459.(in Chinese) 文心田,于恩庶,徐建国,等.当代世界人兽共患病学[M].成都:四川科学技术出版社, 2011: 449-459.
[2]Yan FC, Shao J, Dou YX. Progress in molecular biology of orf virus[J]. Chin Vete Sci, 2013, 43(01):103-109.(in Chinese) 闫丰超,卲佳,窦永喜.羊口疮病毒分子生物学的研究进展[J].中国兽医科学,2013, 43(01):103-109.
[3]Yu YZ, Wu ZJ, Zhu ZB, et al. Molecular characteristics and immune evasion strategies of ORFV: A review[J]. Chin J Virol, 2012, 28(3): 278-284.(in Chinese) 于永忠,吴志军,朱战波,等.羊口疮病毒分子特征与免疫逃避策略[J].病毒学报, 2012, 28(3): 278-284.
[4]Li HX, Zhu XL, Zheng YD, et al. Phylogentic analysis of two Chinese orf virus isolates based on sequence of B2L and VIR genes[J]. Arch Virol, 2013, 158: 1477-1485. DOI: 10.1007/s00705-013-1641-7.
[5]Zhao K. Study on the Construction and Experimental Immunity of Recombinant DNA Vaccine against Orf virus[D]. Chang Chun:Depertment of basic veterinary, Jilin University, 2010.(in Chinese) 赵魁.羊传染性脓疱病毒重组DNA疫苗的构建与实验免疫研究[D].长春:吉林大学基础兽医学, 2010.
[6]Zhang KS, Liu YJ, Kong HJ, et al. Construction of DNA Vaccine carrier for ORFV B2L gene and its expression in BHK-21 cells[J]. Chin J Zoonoses, 2013, 29(10): 951-954.DOI:10.3969/j.issn.1002-2694.2013.0.003(in Chinese) 张克山,刘永杰,孔汉金,等. 羊口疮病毒B2L基因DNA疫苗载体的构建及其在BHK-21细胞中的表达[J]. 中国人兽共患病学报, 2013, 29(10): 951-954.DOI:10.3969/j.issn.1002-2694.2013.0.003
[7]Gronovich Y, Golan J, Andron A, et al. ORF-An Uncommon Human Presentation of a Rare Virus[J]. Anaplastology, 2013, 2(103): 2161-1173. DOI: 10.4172/2161-1173.1000103 .
[8]Turk BG, Senturk B, Dereli T, et al. A rare human-to-human transmission of orf[J]. Int J Dermatol, 2014,53(1):e63-e65.DOI:10.1111/j.1365-4632.2012.05669.x.
[9]Yang HZ, Yang D. Prevention and Control of Orf[J]. J Traditional Chin Vet Med, 2014, 33(6): 69-70.(in Chinese) 杨宏卓,杨迪.羊口疮的防制[J].中兽医医药杂志,2014, 33(6): 69-70.
[10]Scagliarini A, McInnes CJ, Gallina L, et al. Antiviral activity of HPMPC (cidofovir) against orf virus infected lambs[J]. Antiviral Res, 2007, 73(3): 169-174. DOI: 10.1016/j.antiviral.2006.09.008.
[11]Sonvico F, Colombo G, Gallina L, et al. Therapeutic paint of cidofovir/sucralfate gel combination topically administered by spraying for treatment of orf virus infections[J]. AAPS, 2009, 11(2): 242-249. DOI: 10.1208/s12248-009-9101-8.
[12]Guo LX. The epidemiological investigation of Contagious ecthyma in Jilin province and Development of Its inactivated vaccine[D]. Changchun:Veterinary technology Services,Jilin University, 2012.(in Chinese) 郭良兴.吉林省羊传染性脓疱病流行病学调査及其灭活疫苗的研制[D].长春:吉林大学兽医技术服务, 2012.
[13]Tian TT, Li J, Yao YL, et al. Preparation of Orf virus inactivated vaccine and assessment of immune Effect[J]. Progr Vet Med, 2013, 34(6):17-20.(in Chinese) 田婷婷,李杰,姚运亮,等.羊口疮病毒灭活疫苗的制备及免疫效果观察[J].动物医学进展, 2013, 34(6): 17-20.
[14]Zhang L, Wang J, Fang XN, et al. Effec and current research on nucleic acid vaccine in our country[J]. J Radioimmunol, 2013, 26(4): 432-436.(in Chinese) 张蕾,汪嘉,方小楠,等.核酸疫苗的作用及我国目前的研究现状[J].放射免疫学杂志,2013, 26(4): 432-436.
[15]Sun CJ, Pan SP, Xie QX, et al. Preparation of chitosan-plasmid DNA nanoparticles encoding zona pellucida glycoprotein-3alpha and its expression in mouse[J]. Mol Reprod Dev, 2004, 68(2):182-188. DOI: 10.1002/mrd.20058.
[16]Huntley JF, Stabel JR, Paustian ML, et al. Expression library immunization confers protection againstMycobacteriumaviumsubsp. paratuberculosis infection[J]. Infect Immun, 2005, 73(10):6877-6884. DOI:10.1128/IAI.73.10.6877-6884.2005
[17]Du Y, Fan MW, Li YH, et al. Detection of anti-dsDNA antibodies and anti-ssDNA antibodies in mice after immunized with pGJA-P/VAX[J]. J Oral Sci Res, 2006, 22(5): 465-467.(in Chinese) 杜宇,樊明文,李宇红,等.防龋 DNA 疫苗 pGJA-P/VAX 免疫小鼠后的抗 DNA 抗体检测[J].口腔医学研究, 2006, 22(5): 465-467.
Construction and expression of recombinant plasmids of OrfV F1L and B2L genes in MDBK cells
LIU Ai1,2,FENG Jiang1,2,XIAN Si-mei1, 2,LIU Zong-sheng3,LI Peng-fei1,2,LUO Dai-bing1, 2
(1.CollegeofAnimalScience,GuizhouUniversity,Guiyang550025,China; 2.KeyLaboratoryofAnimalDiseaseandVeterinaryPublicHealthofGuizhouProvince,Guiyang550025,China; 3.InstituteofSupervisionandInspectionforAnimalProductsQualityandSafety,Bijie551700,China)
In this study, we constructed eukaryotic recombinant expression plasmids of F1L and B2L genes of Orf Virus, and identified their expression in MDBK cells. The recombinant plasmids pVAX1-B2L and pVAX1-F1L were constructed based on the pMD18-T-F1L and pMD18-T-B2L which were constructed before. Then, they were identified by digestion with restriction enzymes and sequencing. The MDBK cells were transfected with pVAX1-B2L and pVAX1-F1L plasmids coated by liposome, and the RT-PCR and indirect immunofluoresence assay (IFA) were adopted to detect the expressions of pVAX1-B2L and pVAX1-F1L. Results indicated that the recombinant plasmids pVAX1-B2L and pVAX1-F1L were constructed and confirmed successfully by sequencing and digestion, and their instantaneous expressions were verified in the cytoplasm of MDBK cells by RT-PCR and IFA. The eukaryotic recombinant expression plasmids constructed in this study would lay the foundation for the further study on nucleic acid vaccine of OrfV.
Orf viurs; F1L gene; B2L gene; eukaryotic recombinant expression
Xian Si-mei, Email: xiansimei2005@163.com.
10.3969/j.issn.1002-2694.2015.12.008
贵州省科学技术基金项目[黔科合LH字(2014)7667],贵州省动物疫病防控与兽医公共卫生保障科技创新人才团队(黔科合人才团队[2015]4016)和毕节市科技局项目[毕科合字(2012)24号]。
鲜思美,Email:xiansimei2005@163.com.
1.贵州大学动物科学学院,贵阳 550025; 2.贵州省动物疫病与兽医公共卫生重点实验室,贵阳 550025; 3.毕节市动物产品质量安全监督检验所,毕节 551700
S852.65
A
1002-2694(2015)12-1124-05
2015-07-17;
2015-10-16
Supported by grants from the Science and Technology Department of Guizhou Province [Qiankehe LH (2014)7667], the Science and Technology Innovation Talents Team of Animal Disease Prevention and Control, and the Veterinary Public Health Security of Guizhou Province [Qiankehe talents team (2015)4016],and the Science and Technology Department of Bijie[Bikehe (2012)24].

