刚地弓形虫Peroxiredoxin多克隆抗体的制备及鉴定
苏丹华,沈超群,吴 亮,刘 原,付 涛,周家豪,姜旭淦,陈盛霞,曹建平
刚地弓形虫Peroxiredoxin多克隆抗体的制备及鉴定
苏丹华1,沈超群1,吴 亮1,刘 原1,付 涛1,周家豪1,姜旭淦1,陈盛霞1,曹建平2
目的 原核表达刚地弓形虫过氧化物氧化还原酶(peroxiredoxin,Prx)并制备多克隆抗体。方法 PCR技术扩增弓形虫cDNA中的prx基因,克隆至pET-28a(+)载体,构建prx/pET-28a(+)重组表达载体,转化至大肠埃希菌(E.coli)Rosetta中诱导表达。亲和层析纯化重组Prx蛋白,并制备兔多克隆抗体,蛋白印迹技术对多克隆抗体进行鉴定。结果 成功从弓形虫cDNA中扩增出prx目的基因,构建了prx/pET-28a(+)重组质粒,获得抗Prx重组蛋白的多克隆抗体。蛋白印迹技术检测出弓形虫Prx的特异性条带。结论 重组弓形虫Prx制备的多克隆抗体能检测Prx在弓形虫速殖子表达。
刚地弓形虫;过氧化物氧化还原酶;原核表达;多克隆抗体
刚地弓形虫是一种专性细胞内寄生的寄生虫。免疫功能正常的人感染弓形虫后,一般表现为轻微的流感样症状,无明显的临床特征。免疫功能降低、先天性免疫功能缺陷者或者胎儿感染弓形虫后会引起严重的弓形虫病,从而导致人体各器官出现严重病变,新生儿脑炎、智力障碍,甚至流产,畸胎等[1-2]。
过氧化物氧化还原酶(peroxiredoxin,Prx)是抗氧化家族的成员,可作为抗氧化酶清除过氧化氢和羟自由基[1,3]。分布在速殖子细胞质中的弓形虫Prx不仅能清除虫体自身代谢产生的活性氧族,而且能拮抗宿主免疫细胞产生的活性氧族[4-5]。蛋白组学分析显示,Prx为弓形虫速殖子可溶性抗原的组成成分[6-7]。本研究旨在构建Prx的原核表达载体以获得重组Prx,经纯化后免疫家兔获得抗Prx多克隆抗体,为研究弓形虫的抗氧化机制奠定基础。
1 材料和方法
1.1 材料
1.1.1 细胞和虫株 Hela细胞购自中国科学院细胞库,弓形虫RH株由本实验室液氮冷冻保存。
1.1.2 实验动物 新西兰大白兔,2.0 kg左右,雄性,由江苏省江陵动物实验中心提供,在江苏大学动物中心清洁级环境下饲养。
1.1.3 质粒和菌株 pET-28a(+)原核表达质粒、pTG19-T质粒、大肠埃希菌DH5α和Rossetta菌株均由本实验室保存。
1.1.4 试剂和仪器 2×Taq Mater Mix PCR预混液和增强型ECL化学发光检测试剂盒购自南京诺唯赞生物科技有限公司,牛血清白蛋白、琼脂糖胶回收试剂盒、质粒小量制备试剂盒、DNA标准参照物、异丙基-β-D-硫代半乳糖苷(IPTG)均购自上海捷瑞生物技术有限公司,限制性核酸内切酶BamH I、XhoI购自上海ThermoFisher科技有限责任公司,T4连接酶购自宝生物大连有限责任公司。全温空气摇床QYC-200购自上海福玛实验设备有限公司,辣根过氧化物酶标记羊抗兔IgG(HRP-IgG)、硝酸纤维素NC膜购自武汉博士德公司,福氏不完全佐剂和福氏完全佐剂购自美国Sigma公司。脱色摇床购自金坛市医疗仪器厂,核酸蛋白分析仪购自英国WPA公司,超声波细胞粉碎仪购自宁波新芝生物科技公司,全自动凝胶成像仪及垂直电泳仪购自美国Bio-Rad公司。
1.2 方法
1.2.1 弓形虫cDNA的制备 根据吴亮等[8]报道的方法在Hela细胞中传代培养弓形虫RH株速殖子。从液氮中取出冻存的弓形虫RH株速殖子,按照慢冻快融的原则,37 ℃水浴快速复苏,3 000 r/min离心5 min,用1 mL 15%小牛血清RPMI 1640重悬后接种于Hela细胞。培养环境为37 ℃ 5% CO2饱和湿度的细胞培养箱,用倒置显微镜每天观察细胞和虫体的生长状态,当观察到大量虫体游离在细胞外时,以灭菌PBS缓冲液(pH7.4)洗3次后,收集虫体标本。按照RNA提取试剂盒的说明书,提取弓形虫速殖子总RNA,反转录合成cDNA,-20 ℃冻存备用。
1.2.2Prx基因扩增与克隆 根据ToxoDB基因库提供的弓形虫RH株基因组prx的基因序列,利用DNASTAR软件设计1对特异性引物如下:上游引物Prx-BamH I:5′-GGCGGATCCATGCCGGCCCCGATGGTGTCT-3′,下游引物Prx-XhoI: 5′-GGCCTCGAGCTTGCTTCCGAGATACTC-3′,由上海捷瑞生物工程有限公司合成。以弓形虫RH株速殖子cDNA为模板进行PCR扩增,反应条件:95 ℃预变性1 min,95 ℃变性10 s,56.1 ℃退火20 s,72 ℃ 30 s,30个循环,72 ℃延伸10 min。PCR产物通过琼脂糖凝胶电泳分析鉴定后,用琼脂糖胶回收试剂盒回收PCR产物,与克隆载体pTG19-T于16 ℃连接12 h后转化至大肠埃希菌感受态DH5α,涂布于含50 μL AMP、20 μL X-gal和10 μL IPTG的LB平板上,37 ℃温箱里培养12 h,通过蓝白斑筛选,挑取白色菌落接种于液体LB培养基中增菌过夜,次日按碱裂解法提取重组质粒。
1.2.3 重组质粒prx/pTG19-T的鉴定 提取的重组质粒通过PCR和BamH I酶切鉴定,阳性质粒送上海桑尼生物科技有限公司测序。用Blast比对分析基因测序结果,筛选与弓形虫prx编码基因完全一致的质粒用于后续实验。
1.2.4 重组表达质粒prx/pET-28a(+)的构建与鉴定 重组质粒prx/pTG19-T和pET-28a(+)载体经BamH I和XhoI双酶切后,用琼脂糖胶回收试剂盒分别回收目的片段和表达载体片段,T4连接酶16 ℃连接过夜后转化至感受态DH5α。碱裂解法提取重组质粒,通过PCR和双酶切鉴定,阳性质粒转化至感受态细胞Rossetta中。
1.2.5 重组蛋白的表达与可溶性分析 挑取阳性菌落接种于3 mL含卡那霉素的LB液体培养基中,37 ℃培养过夜,次日以1∶100接种于含同种抗生素的20 mL LB培养基中,37 ℃振摇培养1.5~2 h,当至对数期A600为0.4~0.6时,无菌分装到6个玻璃试管中,每管3 mL,第1管不加IPTG,其余5管加入IPTG使其终浓度为0.4 mmol/L,25 ℃分别诱导表达2 h、4 h、6 h、8 h、10 h,经SDS-PAGE分析重组蛋白的表达情况。另取1.5 mL菌液,离心收集菌体沉淀,用500 μL的PBS重悬菌体沉淀,超声裂解后离心,吸取上清至新EP管中,沉淀继续用500 μL PBS重悬。分别吸取30 μL的上清和沉淀,进行蛋白可溶性分析。
1.2.6 重组蛋白Prx的纯化 在最佳表达条件下,用200 mL含卡那霉素的LB液体培养基增菌。收集菌体,超声破碎后,4 ℃、10 000 r/min离心30 min,收集上清,和氯化镍4 ℃结合4 h,用洗涤缓冲液(20 mmol/L咪唑,50 mmol/L NaH2PO4,300 mmol/L NaCl)洗脱杂蛋白,然后用洗脱缓冲液(250 mmol/L咪唑,50 mmol/L NaH2PO4,300 mmol/L NaCl)洗脱目的蛋白。
1.2.7 兔抗重组蛋白Prx多克隆抗体的制备 按姜旭淦等[9]报道方法进行。先制备充足的乳化抗原,在兔背部通过皮内多点注射的方法免疫,初次免疫前取兔耳缘静脉血,分离血清后做阴性对照。第1次免疫乳化抗原的制备是由重组纯化蛋白加入等体积的弗氏完全佐剂,第2和3次乳化抗原的制备采用重组纯化蛋白加入等体积的弗氏不完全佐剂。第1次免疫3周后,进行第2次免疫,间隔1周后进行第3次免疫,共免疫3次,免疫方法和剂量同首次免疫。第3次免疫1周后耳缘静脉采集兔血,分离血清,ELISA检测抗体效价。当抗体效价>1∶640 000时,终止免疫,心脏采血法收集兔血,分离血清,于-70 ℃保存。
1.2.8 蛋白质印迹技术检测Prx在弓形虫速殖子内的表达 弓形虫RH株速殖子在Hela细胞中传代培养,收集1×107虫体于无菌EP管中,加20 μL 2×SDS-PAGE上样缓冲液充分混匀,煮沸5~10 min,4 ℃ 12 000 r/min离心5 min,取上清液SDS-PAGE分析。电泳完成后,将目的蛋白转印至NC膜上,5%脱脂奶粉封闭30 min,加入1∶1 000的兔抗Prx血清,室温孵育2 h,TBST缓冲液洗涤3次,每次10 min,再与1∶5 000 HPR标记羊抗兔IgG室温孵育1 h,进行ECL显影反应,化学发光仪检测结果。
2 结 果
2.1 弓形虫prxPCR扩增结果 以弓形虫RH株cDNA为模板,PCR扩增弓形虫prx基因,经1%琼脂糖凝胶电泳检测,获得588 bp目的条带,与弓形虫prx基因理论扩增大小相符(图1A)。
2.2 重组表达质粒prx/pET-28a(+)的鉴定 重组表达质粒prx/pET-28a(+)通过BamH I和XhoI双酶切后得到约588 bp和5 369 bp的片段,与预期结果一致,证明弓形虫prx基因被完整插入到表达载体pET-28a(+)中(图1B)。
2.3 重组Prx蛋白的最佳表达条件和纯化 重组质粒转入Rossetta后,经过对表达条件的优化,发现菌液在A600接近0.6,诱导剂IPTG终浓度为1.0 mmol/L,30 ℃诱导8 h时,可得到大量的可溶性蛋白。表达产物经镍亲和层析技术纯化后进行SDS-PAGE分析,在25 kDa处有一条清晰的目的蛋白回收带,即纯化后的目的蛋白(图2A)。
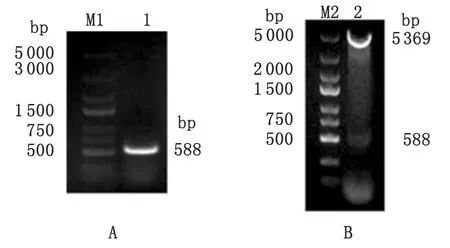
M1,M2: DNA marker; 1: prx;2: prx/pET-28a(+)
图1 PCR扩增弓形虫prx基因和prx/pET-28a(+)重组质粒双酶切鉴定
Fig.1 PCR amplification ofprxgene inT.gondiiand identification ofprx/pET-28a(+) by restriction enzyme digestion
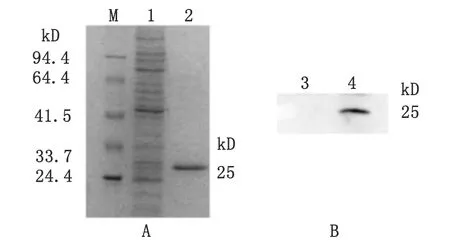
M: Protein molecular weight marker; 1: unpurified recombinant protein;2: purified recombinant protein; 3: Hela cell; 4: tachyzoites ofT.gondii
图2 重组Prx蛋白纯化SDS-PAGE分析和蛋白印迹技术检测弓形虫速殖子Prx的表达
Fig.2 Purification of recombinant Prx by SDS-PAGE analysis and Western blotting analysis of Prx expression inT.gondii
2.4 蛋白印迹技术鉴定多克隆抗体 蛋白印迹结果显示,弓形虫RH株在25 kDa处有反应条带,阴性标本无此条带(图2B),表明制备的多克隆抗体有较好的特异性。
3 讨 论
Peroxiredoxin是一类具有显著抗氧化作用的酶[10],主要包括硫氧还蛋白过氧化物酶(TPx)和烷基过氧化氢酶C(AhpC)等。Prx抗氧化酶系广泛分布于酵母、真菌、寄生虫、哺乳动物和人类等多种生物体内[11]。所有生物的Prx都包含一个“过氧化反应”半胱氨酸,它在与氢过氧化物的反应中被氧化为半胱氨酸次磺酸(Cys-SOH)[12]。Prx不需要与金属离子结合就可以发挥抗氧化作用,它的抗氧化活性体现在通过分解过氧化氢和烷基过氧化物来阻止强氧化剂羟自由基的产生[13]。Prx在刚地弓形虫的抗氧化系统里发挥着重要作用,除了过氧化氢酶,Prx也可能参与过氧化氢的降解过程[14]。此外,Prx还可以通过介导信号转导,与细胞因子协同作用控制过氧化物的平衡,由此在细胞增殖[15]、分化和凋亡中起到重要作用[16-18]。
根据参与催化功能的半胱氨酸残基的数量,可将Prx分为1-Cys Prx和2-Cys Prx两类[12],弓形虫Prx(TgPrx)有3种,TgPrx-1和TgPrx-3属于2-Cys Prx,TgPrx-2属于1-Cys Prx,它们各自或协同地在氧化应激中发挥抗氧化作用[19]。本研究成功构建了TgPrx-1原核表达载体,获得了融合表达蛋白,并纯化重组蛋白Prx,免疫新西兰兔后获得多克隆抗体。蛋白印迹技术鉴定抗体有良好的特异性。
刘转转等[4]已报道弓形虫prx基因的克隆表达和抗血清制备,但其设计的引物、原核表达载体、感受态细胞以及免疫动物与本研究不同,且未对制备的抗体进行鉴定。另外,已有的Prx相关研究是从研制弓形虫疫苗候选抗原和免疫学诊断的角度出发,本研究制备的Prx兔多克隆抗体,可为后续弓形虫速殖子Prx在宿主细胞中的表达及其生物学功能研究提供基础。
[1]Son ES, Song KJ, Shin JC, et al. Molecular cloning and characterization of peroxiredoxin fromToxoplasmagondii[J]. Korean J Parasitol, 2001, 39(2): 133-141.
[2]Ju AP,Wu L,Shen J,et al.Prokaryotic expression and identification of rhoptry protein 18 fromToxoplasmagondii[J].J Jiangsu Univ(Med Edit), 2013, 23(3): 207-211. (in Chinese) 鞠爱萍,吴亮,沈进,等.弓形虫棒状体蛋白18的原核表达及鉴定[J].江苏大学学报:医学版,2013, 23(3): 207-211.
[3]Salinas G, Fernandez V, Fernandez C, et al.Echinococcusgranulosus: cloning of a thioredoxin peroxidase[J]. Exp Parasitol, 1998, 90(3): 298-301.
[4]Liu ZZ,Wang HL,Meng XL,et al. Purification of recombinant peroxiredoxin protein ofToxoplasmagondiiand preparation of antisera[J].J Path Biol, 2011,6(3): 201-203. (in Chinese) 刘转转,王海龙,孟晓丽,等.重组刚地弓形虫Peroxiredoxin蛋白的纯化及抗血清制备[J].中国病原生物学杂志, 2011,6(3): 201-203.
[5]Peskin AV, Low FM, Paton LN, et al. The high reactivity of peroxiredoxin 2 with H2O2is not reflected in its reaction with other oxidants and thiol reagents[J]. J Biol Chem, 2007, 282(16): 11885-11892.
[6]Ma GY, Zhang JZ, Yin GR, et al.Toxoplasmagondii: proteomic analysis of antigenicity of solubletachyzoite antigen[J]. Exp Parasitol, 2009, 122(1): 41-46.
[7]Wang F,Yin GR,Meng XL,et al. Bioinformatics analysis of the structure and epitopes of the geneencoding peroxiredoxin protein fromToxoplasmagondii[J].J Path Biol, 2010, 5(7):517-519,533.(in Chinese) 王芬,殷国荣,孟晓丽,等.刚地弓形虫Peroxiredoxin基因编码蛋白结构与抗原表位的生物信息学分析[J].中国病原生物学杂志, 2010, 5(7): 517-519,533.
[8]Wu L,Chen SX,Li LJ,et al.In vitroculture of tachyzoites ofToxoplasmagondiiRH strain in HeLa cells[J].Chin J Parasitol Parasit Dis, 2008, 26(6): 452-456. (in Chinese) 吴亮,陈盛霞,李琳婕,等.刚地弓形虫RH株速殖子在HeLa细胞系体外培养的实验观察[J].中国寄生虫学与寄生虫病杂志, 2008, 26(6): 452-456.
[9]Jiang XG, Zhu MJ, Ge YW, et al.Preparation and detection of antisera for collagen proteintypeⅡ[J].J Jiangsu Univ(Med Edit), 2008, 18(1): 34-36,39.(in Chinese) 姜旭淦,朱敏娟,葛彦文,等.Ⅱ型胶原蛋白抗血清的制备和检测[J].江苏大学学报:医学版,2008, 18(1): 34-36,39.
[10]McGonigle S, Dalton JP, James ER. Peroxidoxins: a new antioxidant family[J]. Parasitol Today,1998, 14(4): 139-145.
[11]Liu ZZ,Wang HL,Yin GR, et al.Cloning and prokaryotic expression of peroxiredoxin gene ofToxoplasmagondiiand immunogenicity analysis of the recombinant protein[J].Chin J Zoonoses, 2009, 25(4): 334-337.(in Chinese) 刘转转,王海龙,殷国荣,等.刚地弓形虫peroxiredoxin基因的克隆表达与免疫原性分析[J].中国人兽共患病学报, 2009, 25(4): 334-337.
[12]Deponte M, Becker K. Biochemical characterization ofToxoplasmagondii1-Cys peroxiredoxin 2 with mechanistic similarities to typical 2-Cys Prx[J].Mol Biochem Parasit, 2005(140): 87-96.
[13]Shu Q.Peroxiredoxin and parasite[J].Chin J Parasitol Parasit Dis,2002, 20(2): 115-118. (in Chinese) 舒勍. Peroxiredoxin与寄生虫[J].中国寄生虫学与寄生虫病杂志, 2002, 20(2): 115-118.
[14]Ding M, Kwok LY, Schluter D, et al. The antioxidant systems inToxoplasmagondiiand the roleof cytosolic catalase in defence against oxidative injury[J]. Mol Microbiol, 2004, 51(1): 47-61.
[15]Marshall ES, Elshekiha HM, Hakimi MA, et al.Toxoplasmagondiiperoxiredoxin promotes altered macrophage function, caspase-1-dependent IL-1β secretion enhance parasite replication[J].Vet Res, 2011, 42: 80.
[16]Wood ZA, Poole LB, Karplus PA. Peroxiredoxin evolution and the regulation of hydrogenperoxide signaling[J]. Science, 2003, 300(5619): 650-653.
[17]Kang SW, Rhee SG, Chang TS, et al. 2-Cys peroxiredoxin function in intracellular signaltransduction: therapeutic implications[J]. Trends Mol Med, 2005, 11(12): 571-578.
[18]Kim JA, Park S, Kim K, et al. Activity assay of mammalian 2-cys peroxiredoxins using yeastthioredoxin reductase system[J]. Anal Biochem, 2005, 338(2): 216-223.
[19]Santed CF, Ortet P, Saksouk N, et al. The histone methylase KMTox interacts the redox-sensor peroxiredoxin-1 and targets genes involvedToxoplasmagondiiantioxidant defences[J].Mol Microbiol, 2009, 71(1): 212-226.
Preparation and identification of polyclonal antibody of peroxiredoxin fromToxoplasmagondii
SU Dan-hua1,SHEN Chao-qun1,WU Liang1,LIU Yuan1,FU Tao1,ZHOU Jia-hao1,JIANG Xu-gan1,CHEN Sheng-xia1,CAO Jian-ping2
(1.SchoolofMedicine,JiangsuUniversity,Zhenjiang212013,China; 2.NationalInstituteofParasiticDiseases,ChineseCenterforDiseaseControlandPrevention,Shanghai200025,China)
To clone and express the peroxiredoxin(Prx) ofToxoplasmagondiiRH strain and produce the polyclonal antibody,prxgene fragments amplified by PCR were cloned into the pET-28a(+) vector to construct the prokaryotic expression vectorprx/pET-28a(+), which was efficiently expressed inE.coliRosetta. Recombinant Prx proteins were purified by Ni-NTA affinity chromatography. The anti-Prx polyclonal antibody was produced in rabbit. Western blotting could detect Prx expression by anti-Prx polyclonal antibody. The recombinant Prx polyclonal antibody will facilitate the study of the biological functions of Prx.
Toxoplasmagondii; peroxiredoxin (Prx); prokaryotic expression; polyclonal antibody
Chen Sheng-xia, Email: chensxia@ujs.edu.cn
10.3969/j.issn.1002-2694.2015.12.001
国家自然科学基金(No.81301453),卫生部寄生虫病原与媒介生物学重点实验室开放课题(No.WSBKTKT201302),中国博士后科学基金特别资助(No.2015T80518),中国博士后科学基金(No.2014M561598),江苏省博士后科研计划(No.1402171C)和江苏大学高级人才启动基金(No.13JDG023,No.13JDG127)联合资助
陈盛霞,Email:chensxia@ujs.edu.cn
1.江苏大学医学院,镇江 212013; 2.中国疾病预防控制中心寄生虫病预防控制所,上海 200025
R382.5
A
1002-2694(2015)12-1089-04
2015-04-01;
2015-07-24
Supported by the National Natural Science Foundation of China (No. 81301453), the Laboratory of Parasite and Vector Biology of China, MOPH (No.WSBKTKT201302), the China Postdoctoral Science Special Foundation(No.2015T80518),the China Postdoctoral Science Foundation (No.2014M561598), the Jiangsu Postdoctoral Science Foundation (No. 1402171C), and the Senior Talent Studying Initial Funding of Jiangsu University (No. 13JDG023, 13JDG127)

