共表达分子伴侣PDI和Ero1对灰盖鬼伞过氧化物酶在毕赤酵母中表达的影响
陈飞,胡美荣,江贤章,陶勇,黄建忠
共表达分子伴侣PDI和Ero1对灰盖鬼伞过氧化物酶在毕赤酵母中表达的影响
陈飞1,胡美荣2,江贤章1,陶勇2,黄建忠1
1 福建师范大学生命科学院,福建福州 350108 2 中国科学院微生物研究所,北京 100101

陈飞, 胡美荣, 江贤章, 等. 共表达分子伴侣PDI和Ero1对灰盖鬼伞过氧化物酶在毕赤酵母中表达的影响. 生物工程学报, 2015, 31(12): 1682–1689.Chen F, Hu MR, Jiang XZ, et al. Enhancement of Coprinus cinereus peroxidase in Pichia pastoris by co-expression chaperone PDI and Ero1. Chin J Biotech, 2015, 31(12): 1682–1689.
来源于灰盖鬼伞长度为1 092 bp的CiP目的基因与AOX1启动子一起整合进酵母染色体基因组中。重组蛋白CiP在酿酒酵母信号肽的引导下成功分泌到胞外,质谱鉴定为目的蛋白,成功在毕赤酵母中表达灰盖鬼伞过氧化物酶(CiP)。将伴侣蛋白内质网氧化还原酶1 (Ero1)、二硫键异构酶(PDI) 分别单独及同时转入CiP酵母受体菌中,研究它们对CiP在毕赤酵母中表达的影响。结果表明:在摇瓶中,相对于无分子伴侣的菌株,单独整合PDI及同时整合Ero1、PDI菌株的CiP酶活分别提高了2.43 和2.62倍,活力达到316 U/mL和340 U/mL。挑选同时整合Ero1、PDI伴侣蛋白的CiP菌株,5 L发酵罐进行高密度发酵,酶活最高达到 3 379 U/mL,比摇瓶提高约10倍。本实验结果较目前已报道的1 200 U/mL已是最高水平。
毕赤酵母,灰盖鬼伞过氧化物酶,内质网氧化还原酶,二硫键异构酶
过氧化物酶是一系列能够氧化芳香胺类、酚类等化合物的氧化剂。大多数的过氧化物酶活性中心常含有伴随三价铁的原卟啉,且广泛存在于生物有机体中。过氧化物酶分为哺乳类和植物类两个超家族,根据序列比对,植物类超家族成员又被分为3种类型:一类是胞内过氧化物酶,如酵母细胞色素C过氧化物酶;二类和三类分别为真菌胞内过氧化物酶和植物胞内过氧化物酶。二类过氧化物酶是二聚体糖蛋白,含有2个钙离子和4个保守的二硫键,且二硫键形成的位置不同于三类酶[1-2]。
过氧化物酶在临床检验和废水处理方面的作用已经引起工业化生产的注意[3-5]。已经有来自于不同物种的过氧化物酶用于处理酚类聚合物[6-9]。辣根过氧化物酶属于第三类过氧化物,由于其高效的催化活力和专一性电子供体而被人们广泛熟知。然而,近些年被人们广泛关注的灰盖鬼伞过氧化物酶 (CiP) 是一种由担子菌类分泌的二类过氧化物酶,具有与辣根过氧化物酶 (HRP) 相似的功能[10-11]。另外,CiP由单一的酶组成,而HRP由至少12种不同催化活性的酶组成,且酶的比例随不同的生长周期进行改变。对于工业化大规模生产过氧化物酶来说,一个高效且经济的生产系统是迫切需要的。已知的酿酒酵母[12]、米曲霉[13]等已被工业化用来外源表达CiP。2009年Kim等在毕赤酵母中功能表达了CiP,以ABTS为底物,其m和m分别为22.4 μmol/L、1.82 μmol/(L·s),在5 L发酵罐中表达活力达到1 200 U/mL,蛋白浓度 1.7 g/L,是目前报道的最高水平[14]。
毕赤酵母表达系统已经发展成为一个成熟的外源蛋白表达系统,工业上常用来大规模表达外源蛋白。毕赤酵母表达系统具有以下优点:遗传改造方便,外源蛋白表达水平高,真核蛋白翻译后修饰,便于大规模发酵,分泌的重组蛋白易于纯化[15-17]。毕赤酵母表达系统已经被成功地用来表达多种重组外源蛋白[18-19]。二硫键异构酶 (PDI) 和内质网氧化还原酶 (Ero1) 广泛存在于真菌、植物、动物和人内质网中,能够帮助蛋白分泌。PDI是内质网中含量最丰富的蛋白之一,可以催化3种反应:氧化 (催化蛋白形成新的二硫键);还原 (除去二硫键);异构化 (通过巯基-二硫键交换改变已存在的Cys配对)[20]。在酵母内质网中大部分以氧化状态存在,意味着PDI主要显示氧化活性帮助蛋白形成正确的折叠结构而分泌到胞外。Ero1在内质网中氧化还原态的PDI成氧化态,间接帮助蛋白分泌[21]。缺失Ero1的细胞内质网不能氧化新合成的蛋白,而缺少PDI的细胞不能存活。Zhang等[22]在毕赤酵母中通过共表达PDI使葡萄糖苷酶比活提高1.5倍;Wu等[23]在毕赤酵母中通过共表达PDI和Ero1使人血清白蛋白和人生长激素的融合蛋白在5 L发酵罐上表达量提高到3−4 g/L。
本实验中,我们首先在毕赤酵母中成功表达并分泌CiP,然后通过整合分子伴侣蛋白PDI和Ero1,进一步提高CiP的表达。
1 材料与方法
1.1 菌株和质粒
大肠克隆菌株 T1购自全式金公司;酵母表达菌株X33、穿梭质粒pPIC9k、pPICZαA购自Invitrogen公司;目的基因CiP由南京金斯瑞合成。GenBank登录号为XM_001834316,去掉信号肽 (前20个氨基酸)。
1.2 主要试剂和仪器
Q5 DNA聚合酶和限制性内切酶BⅠ、RⅠ、Ⅰ、Ⅰ、Ⅰ、HⅠ购自NEB公司;核酸marker购自奥赛博公司;蛋白marker和T4 DNA连接酶购自Fermentas公司;ABTS[2,2’-azinobis-(3-ethylbenzthiaoline-6-sulp-honate)]购自Sigma公司;博来霉素 (Zeocin)、G418购自Invitorgen公司;其他试剂均为国产分析纯;质粒提取试剂盒、胶回收试剂盒均购自Omega公司;PCR仪购自东胜创新生物科技有限公司;核酸电泳仪购自Bio-Rad公司;蛋白电泳仪购自君意公司;凝胶成像仪购自天能公司;引物由北京生工合成;DNA测序由北京博尚公司完成。
1.3 方法
常规分子生物学操作参照《分子克隆手册》[24]进行。
1.3.1 融合表达载体的构建
CiP全基因合成序列,两端分别是RⅠ和Ⅰ酶切位点,双酶切纯化后与同样双酶切的pPIC9k载体连接,构建克隆载体pPIC9k-CIP,转化大肠杆菌T1感受态细胞,挑取单克隆进行PCR鉴定和酶切鉴定,基因测序正确后获得构建成功的融合表达载体。
根据伴侣蛋白Ero1和PDI基因序列设计寡核苷酸链,合成引物 (表1),通过PCR技术利用引物P1和P2、P3和P4分别以毕赤酵母的基因组为模板扩增出Ero1和PDI基因序列,两端均分别含有BⅠ和Ⅰ酶切位点。双酶切纯化后将Ero1和PDI的成熟片段与分别同样双酶切的pPICZ载体连接,构建克隆载体pPICZ-ERO1和pPICZ-PDI。转化T1感受态细胞,挑取单克隆进行PCR、酶切鉴定和基因测序,获得正确的融合载体。将基因测序正确的重组质粒pPICZ-PDI利用引物P5和P6扩增出含有AOX启动子、PDI基因以及终止子区域的目的片段,与测序正确且HⅠ线性化的重组质粒pPICZ-ERO1进行同源重组,采用NOVO protein同源重组方法,构建克隆载体pPICZ-ERO1-PDI。转化T1感受态细胞,挑取单克隆进行PCR鉴定、酶切鉴定、基因测序,获得构建成功的载体。

表1 分子伴侣基因PCR扩增引物列表
1.3.2 阳性转化子的获得
将测序正确的重组质粒pPIC9k-CIP进行Ⅰ线性化后电转表达宿主毕赤酵母,构建重组菌X33/pPIC9k-CIP,涂布在终浓度为250 μg/mL G418的YPD平板上,3 d后获得阳性转化子。
将3个测序正确的重组质粒pPICZ-ERO1、pPICZ-PDI、pPICZ-ERO1-PDI进行Ⅰ线性化后分别电转同一株含有CiP的表达宿主,构建分别含有分子伴侣Ero1、PDI、Ero1-PDI的CiP菌株X33/pPICZ- ERO1、X33/pPICZ-PDI、X33/pPICZ-ERO1-PDI,涂布在终浓度250 μg/mL G418和50 μg/mL博莱霉素的YPD双抗平板上,3 d后获得阳性转 化子。
1.3.3 重组蛋白的诱导表达和SDS-PAGE检测
将重组菌株X33/pPIC9k-CIP和分别整合分子伴侣Ero1、PDI、Ero1-PDI的X33/pPIC9k-CIP菌株进行YPD (1%酵母膏,2%蛋白胨,2%葡萄糖,1.5%琼脂粉) 平板划线培养,挑取单菌落接种于3 mL YPCS (1%酵母浸出物,2%蛋白胨,0.5%酪蛋白水解物,0.5%山梨醇) 试管种子培养基中,24 h后1%接种量转接到250 mL 装液量50 mL的YPCS摇瓶中,24 h后加1% (/) 甲醇和终浓度为50 μmol/L的血红素,48 h和72 h后均各加1% (/) 甲醇诱导,96 h收菌, 8 000 r/min离心5 min收集上清,上清进行SDS-PAGE检测。
1.3.4 CiP酶活测定
用ABTS和双氧水进行酶活测定[14]:取 1 μL稀释的上清酶液至0.3 mL ABTS-H2O2(2 mmol/L ABTS,2.9 mmol/L H2O2,pH 4.4) 中,利用UV1800测定420 nm (被氧化的ABTS摩尔消光系数为3.6×104L/(mol·cm)) 下1 min内活度值的变化△G,温度控制在25 ℃,酶活(U/mL)=△G×0.3×稀释倍数/0.036。
1.3.5 5 L发酵罐放大表达CiP
将同时含有分子伴侣Ero1和PDI的X33/pPIC9k-CIP菌株按3%接种量接种到3 mL YPD的一级试管种子液中,30 ℃,250 r/min,12 h后3%接种量转接到500 mL装液量100 mL BMGY (1%酵母浸出物,2%蛋白胨,1.34% YNB,400 μg/L生物素,1%甘油,100 mmol/L pH 6.0的磷酸钾缓冲液) 二级种子液摇瓶中,30 ℃,250 r/min,12 h后600到10,10%的接种量接种到5 L的发酵罐中,发酵罐初始装1.8 L BSM培养基,每升BSM含:26.7 mL 85% H3PO4,0.93 g CaSO4,18.2 g K2SO4,14.9 g MgSO4·7H2O,4.13 g KOH,40 g甘油和4.35 mL PTM1 (过滤除菌);每升PTM1含6.0 g CuSO4·5H2O,0.08 g NaI,3.0 g MnSO4·H2O, 0.2 g NaMoO4·2H2O,0.02 g H3BO3,0.5 g CoCl2,20.0 g ZnCl2,65.0 g FeSO4·7H2O,0.2 g生物素,5 mL H2SO4。初始发酵控制温度30 ℃,用浓氨水(28%) 控制pH为5.0,通过调节搅拌转速和通气量控制罐上溶氧在20%以上。等BSM中甘油耗尽溶氧上升后,以18.15 mL/(h·L) 的速率流加含有1.2% (/) PTM1的50% (/) 甘油,待600到150–200时停止流加甘油,饥饿培养 30 min–2 h,以6 g/(h·L) 的速率流加含有 1.2% (/) PTM1的100%甲醇,调节搅拌转速和通气量控制溶解氧在20%以上。
2 结果
2.1 重组蛋白表达载体的构建和表达
将重组质粒pPIC9k-CIP用RⅠ和Ⅰ双酶切鉴定,得到1 000 bp的目的条带,与预期结果一致(图1)。DNA测序结果证明融合目的片段序列正确。重组菌X33/pPIC9k-CIP进行甲醇诱导表达,胞外上清进行SDS-PAGE分析,结果表明在约40 kDa处有一条明显的条带,发酵罐放大培养时,50 kDa和60 kDa处也均有条带 (图2)。
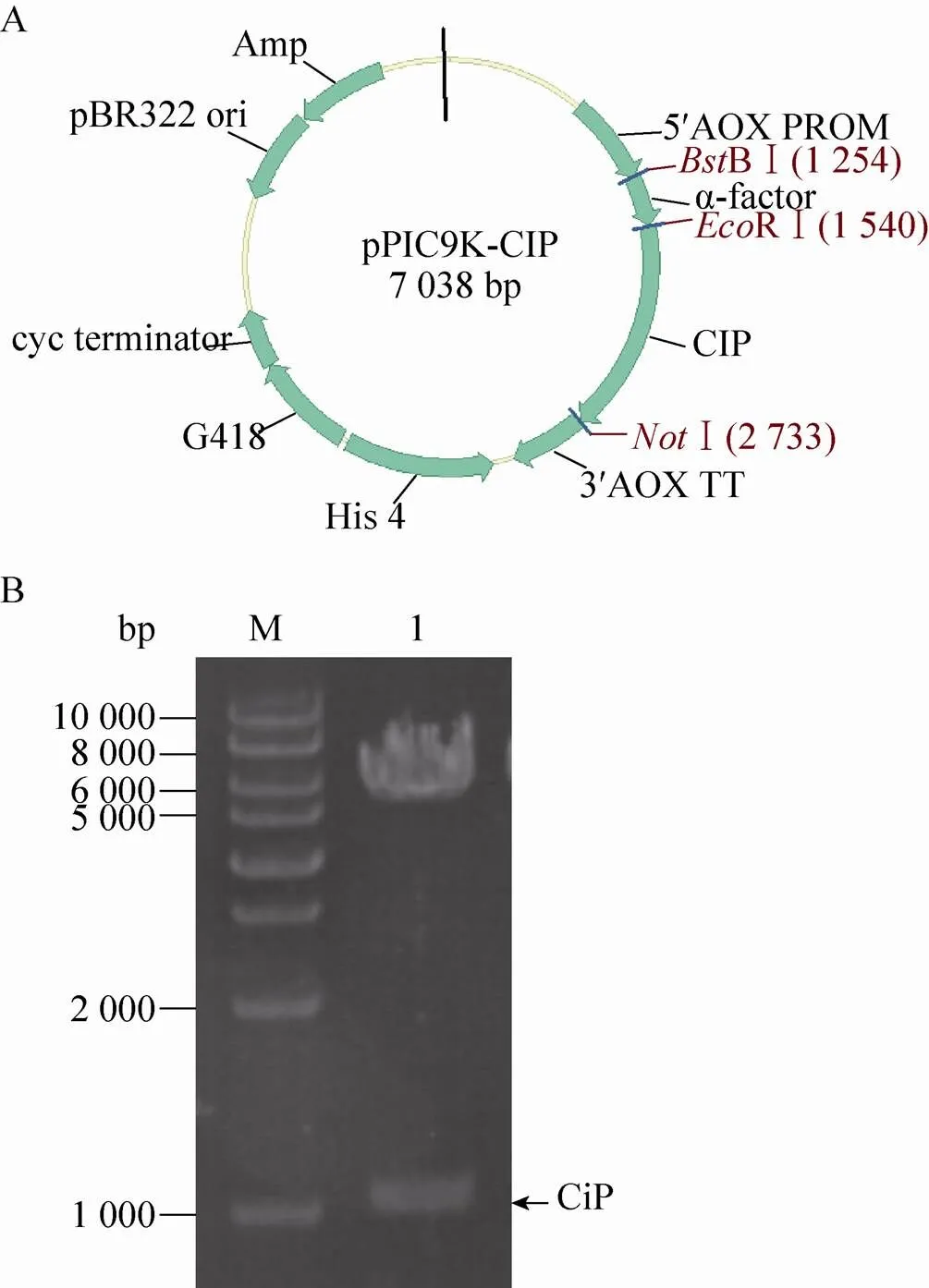
图1 pPIC9k-CIP质粒图示(A)及酶切电泳鉴定(B)
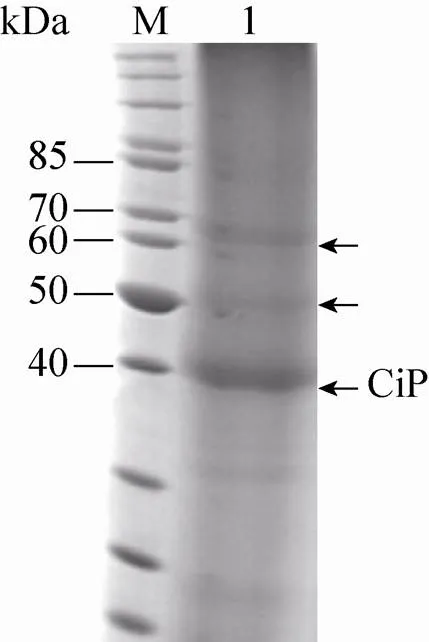
图2 重组蛋白CiP表达产物的SDS-PAGE分析
2.2 重组蛋白CiP的鉴定
将图2中的3条片段采用中国科学院微生物研究所的LC-MALDI串联飞行时间质谱仪进行鉴定,LC-MS的数据表明,40、50和60 kDa处蛋白和XM_001834316编码的蛋白的同源性分别为41%、40%和14%,因此断定40、50 kDa处蛋白一定为CiP,因为具有较高的同源性;60 kDa处蛋白尚需进一步的验证。50 kDa处蛋白推测主要是因为糖基化所致,根据糖基化软件分析 (CBS Prediction Servers),推测162−165位为糖基化位点NSSQ。
2.3 摇瓶水平检测分子伴侣对CiP表达影响
将X33/pPIC9k-CIP菌株作为空白菌株,与分别整合分子伴侣Ero1、PDI、Ero1-PDI的X33/pPIC9k-CIP菌株按照上述条件进行摇瓶发酵。空白菌株酶活130 U/mL,整合Ero1的CiP菌株酶活为90 U/mL,整合PDI的CiP菌株酶活为316 U/mL,同时整合Ero1、PDI的CiP菌株酶活达到340 U/mL (图3)。由图4可知,整合Ero1菌株蛋白表达较空白少,整合PDI、Ero1-PDI菌株蛋白表达均较空白多。
2.4 5 L发酵罐表达CiP
将空白菌株X33/pPIC9k-CIP和整合伴侣蛋白Ero1-PDI的X33/pPIC9k-CIP菌株按上述条件进行5 L发酵罐放大培养。发酵液上清进行SDS-PAGE分析(图5),整合分子伴侣的菌株蛋白表达明显好于空白菌株,酶活和比活也均有较大提高,空白菌株发酵结束酶活867 U/mL,蛋白浓度2.1 g/L,比酶活413 U/mg。整合伴侣蛋白CiP菌株发酵结束酶活达到3 379 U/mL,蛋白浓度4.4 g/L,比活768 U/mg (图6)。

图3 共表达分子伴侣对CiP酶活的影响

图4 SDS-PAGE分析分子伴侣对CiP表达的影响

图5 SDS-PAGE分析5 L发酵罐空白菌株(A) 和添加Ero1-PDI菌株CiP表达情况(B)
3 讨论
毕赤酵母表达系统已经是一种成熟的外源蛋白表达系统,由于外源蛋白翻译速度快来不及修饰导致很多蛋白留在胞内。本文通过整合伴侣蛋白希望能够提高目的蛋白的表达:Ero1和CiP共表达时,Ero1对CiP形成二硫键以及正确折叠没有帮助,因此不能够提高CiP的表达水平,当Ero1和CiP同时表达时Ero1会占用一定的营养源,从而降低了CiP的表达水平。CiP的三级结构中含有4个二硫键,PDI直接有助于二硫键的形成,因此有助于其表达。当Ero1、PDI以及CiP共表达时,PDI在帮助CiP形成二硫键时,本身被还原,Ero1可以将PDI氧化,使其重新恢复功能,从而促进CiP的表达,因此单独共表达PDI及同时共表达Ero1和PDI时有利于CiP的表达。本实验单独整合PDI和Ero1-PDI使目的蛋白酶活分别提高2.43和2.62倍,说明PDI成功帮助CiP进行正确的折叠分泌提高蛋白表达,另外,同时整合两个分子伴侣Ero1-PDI的菌株表现出最高的酶活。5 L发酵罐放大实验整合Ero1-PDI菌株酶活与表达量均有明显提高,比活768 U/mg比空白527 U/mg提高1.46倍,酶活3 379 U/mL已是目前查阅国内外文献中最高酶活。
本文通过整合分子伴侣促进蛋白正确折叠从而提高蛋白表达为以后蛋白纯化及酶学性质的研究奠定了良好的基础,对促进其他外源蛋白在毕赤酵母中的正确折叠和表达提供了新的思路和借鉴。
[1] Welinder KG. Superfamily of plant, fungal and bacterial peroxidases. Curr Opin Struct Biol, 1992, 2(3): 388–392.
[2] Conesa A, Punt PJ, van den Hondel CAMJJ. Fungal peroxidases: molecular aspects and applications. J Biotechnol, 2002, 93(2): 143–158.
[3] Masuda M, Sakurai A, Sakakibara M. Effect of reaction conditions on phenol removal by polymerization and precipitation usingperoxidase. Enzyme Microb Technol, 2001, 28(4/5): 295–300.
[4] Kim SJ, Joo JC, Kim HS, et al. Development of the radical-stableperoxidase by blocking the radical attack. J Biotechnol, 2014, 189: 78–85.
[5] Kauffmann C, Petersen BR, Bjerrum MJ. Enzymatic removal of phenols from aqueous solutions byperoxidase and hydrogen peroxide. J Biotechnol, 1999, 73(1): 71–74.
[6] Morawski B, Lin ZL, Cirino P, et al. Functional expression of horseradish peroxidase inand. Protein Eng Des Sel, 2000, 13(5): 377–384.
[7] Kim YH, Won K, Won JM, et al. Synthesis of polycardanol from renewable source using a fungal peroxidase. J Mol Catal B Enzymatic, 2005, 34(1/6): 33–38.
[8] Park SY, Kim YH, Won K, et al. Enzymatic synthesis and curing of polycardol from renewable resources. J Mol Catal B Enzymatic, 2009, 57(1/4): 312–316.
[9] Hawkins CL, Davies MJ. Generation and propagation of radical reactions on proteins. Biochim Biophys Acta, 2001, 1504(2/3): 196–219.
[10] Cohen YV, Dosoretz CG. Fate of horseradish peroxidase during oxidation of monobrominated phenols. J Chen Technol Biotechnol, 2009, 84(10): 1559–1566.
[11] Kim SJ, Lee JA, Joo JC, et al. The development of a thermostableperoxidase through in silico design. Biotechnol Prog, 2010, 26(4): 1038–1046.
[12] Sawai HH, Ashikari T, Tanaka Y, et al. Cloning, sequencing, and heterologous expression of a gene coding forperoxidase. Biosci Biotech Biochem, 1995, 59(7): 1221–1228.
[13] Petersen JFW, Tams JW, Vind J, et al. Crystallization and X-ray diffraction analysis of recombinantperoxidase. J Mol Biol, 1993, 232(3): 1221–1228.
[14] Kim SJ, Lee JA, Won K, et al. Functional expression ofperoxidase in. Process Biochem, 2009, 44(7): 731–735.
[15] Spadiut O, Rossetti L, Dietzsch C, et al. Purification of a recombinant plant peroxidase produced inby a simple 2-step strategy. Protein Expres Purif, 2012, 86(2): 89–97.
[16] Kopera E, Dwornyk A, Kosson P, et al. Expressin, purification and characterization of glycosylated influenza H5N1 hemagglutinin produced in. Acta Biochim Pol, 2014, 61(3): 597–602.
[17] Fan K, Jiang J, Wang Z, et al. Expression and purification of souble porcine cystatin 11 in. Appl Biochem Biotechnol, 2014, 174(5): 1959–1968.
[18] Zarei N, Vaziri B, Shokrgozar MA, et al. High efficient expression of a functional humanized single-chain variable fragment(scFv) antibody against CD22 in. Appl Microbiol Biotechnol, 2014, 98(24): 10023–10039.
[19] Wu Q, Li B, Wu F, et al. High level expression, efficient purification, and bioactivity of recombinant human metallothionein 3(rhMT3) from methylotrophic yeast. Protein Expres Purif, 2014, 101: 121–126.
[20] Onda Y, Kobori Y. Differential activity of rice protein disulfide isomerase family members for disulfide bond formation and reduction. Febs Open Bio, 2014, 4: 730–734.
[21] Qiang L, Wang H, Farmer SR. Adiponectin secretion is regulated by SIRT1 and the endoplasmicreticulumoxidoreductase Ero1-Lα. Mol Cell Biol, 2007, 27(13): 4698–4707.
[22] Zhang JH, Wu D, Chen J, et al. Enhancing functional expression of β-glucosidase inby co-expressing protein disulfide isomerase. Biotechnol Bioproc E, 2011, 16(6): 1196–1200.
[23] Wu M, Liu W, Yang GH et al. Engineering of aexpression system for high-Level secretion of HSA/GH fusion protein. Appl Biochem Biotechnol, 2014, 172(5): 2400–2411.
[24] Sambrook J, Russell DW. Molecular Cloning: A Laboratory Manual. 3rd ed. Beijing: Cold Spring Harbor Laboratory Press, 2001.
(本文责编 陈宏宇)
Enhancement ofperoxidase inby co-expression chaperone PDI and Ero1
Fei Chen1, Meirong Hu2, Xianzhang Jiang1, Yong Tao2, and Jianzhong Huang1
1 College of Life Sciences, Fujian Normal University, Fuzhou 350108, Fujian, China 2 Institute of Microbiology, Chinese Academy of Sciences, Beijing 100101, China
The 1 095 bp gene encoding peroxidase fromwas synthesized and integrated into the genome ofwith a highly inducible alcohol oxidase. The recombinant CiP (rCiP) fused with the α-mating factor per-pro leader sequence derived fromwas secreted into the culture medium and identified as the target protein by mass spectrometry, confirming that aperoxidase (CiP) was successfully expressed in. The endoplasmic reticulum oxidoreductase 1 (Ero1) and protein disulfide isomerase (PDI) were co-expressed with rCiP separately and simultaneously. Compared with the wild type, overexpression of PDI and Ero1-PDI increaseed Cip activity in 2.43 and 2.6 fold and their activity reached 316 U/mL and 340 U/mL respectively. The strains co-expressed with Ero1-PDI was used to high density fermentation, and their activity reached 3 379 U/mL, which was higher than previously reported of 1 200 U/mL.
,peroxidase, endoplasmic reticulum oxidoreductase 1, protein disulfide isomerase
January 26, 2015; Accepted: July 13, 2015
Jianzhong Huang. Tel: +86-591-22868212; E-mail: hjz@fjnu.edu.cn
10.13345/j.cjb.150051
Supported by:Key Technologies of Industrialization Project in Fujian Province (No. [2010]358).
福建省产业化关键技术项目 (No. 闽财指[2010]358号) 资助。

