高浓度底物下青霉素扩环酶的活性评价与底物抑制现象
伍林军,范可强,季俊杰,杨克迁
高浓度底物下青霉素扩环酶的活性评价与底物抑制现象
伍林军1,2,范可强1,季俊杰1,杨克迁1
1 中国科学院微生物研究所微生物资源前期开发国家重点实验室,北京 100101 2 中国科学院大学,北京 100049

伍林军, 范可强, 季俊杰, 等. 高浓度底物下青霉素扩环酶的活性评价与底物抑制现象. 生物工程学报, 2015, 31(12): 1690–1699.Wu LJ, Fan KQ, Ji JJ, et al. Evaluation of penicillin expandase mutants and complex substrate inhibition characteristics at high concentrations of penicillin G. Chin J Biotech, 2015, 31(12): 1690–1699.
本文对青霉素扩环酶(Penicillin expandase,也称Deacetoxycephalosporin C synthase,DAOCS) 在高浓度青霉素G下的底物抑制现象进行初步评价与表征,筛选适合工业应用条件的高活力突变体。我们通过HPLC对已报道的几个DAOCS高活力突变体在青霉素G浓度5.6至500 mmol/L间的比活力进行定量测定,并与不同催化反应动力学模型的理论推测变化趋势比较,发现DAOCS野生型酶及高活力突变体H4、H5、H6与H7在高浓度青霉素G条件下均表现出明显的底物抑制现象,但是变化趋势不同。野生型酶与突变体H4的比活力先上升后下降,与竞争性抑制模型预测不符。突变体H5、H6与H7的比活力变化呈现更复杂的变化趋势。在所有测试的突变体中,H6的活性显著高于其他突变体酶。青霉素G对野生型DAOCS的底物抑制现象符合非竞争性抑制模型的预测。而部分突变体表现出复杂的底物抑制行为,表明其具有更复杂的作用机制。在高底物浓度下筛选具有较强催化活性的青霉素扩环酶突变体对于推动其在工业生产中的应用具有重要指导作用。
去乙酰氧头孢菌素C合成酶,底物抑制,高浓度青霉素G
青霉素扩环酶 (Penicillin expandase,也称Deacetoxycephalosporin C synthase,DAOCS) 是非血红素Fe2+和α-酮戊二酸依赖的氧化酶,它催化青霉素的五元噻唑环扩环生成六元噻嗪环,这是由青霉素及其类似物合成具有重要医疗价值的头孢类化合物中间体的关键步骤[1-2](图1)。棒状链霉菌中编码该酶 (scDAOCS) 的基因为[3-4]。由于DAOCS具有重要的工业应用前景,对其已有多年的研究基础,特别是在通过蛋白质工程改造拓宽其底物范围、提高其活力等方面已取得许多进展。
DAOCS的天然底物是青霉素N,而对其他青霉素类化合物的活性非常低。直到1998年,Cho等提高了反应体系中Fe2+和α-酮戊二酸的浓度,才探索出了DAOCS对其他青霉素类似物 (包括青霉素G) 成功进行扩环反应的体系[5]。在他们的体系下,棒状链霉菌NP1静息态细胞可成功催化青霉素N以及其他14种青霉素类似物发生扩环反应。之后Chin等对体外反应体系进行改进,进一步扩大了scDAOCS催化扩环反应的底物范围[6]。
然而DAOCS对其非天然底物青霉素G的活性较低,为了利用青霉素G来合成头孢菌素类抗生素的前体化合物7-苯乙酰胺基-3-脱乙酰氧头孢烷酸 (G-7-ADCA),需要对DAOCS进行改造。对DAOCS进行活性改造的依据主要是基于定向进化、多重序列比对以及由晶体结构[7]推测出来的活性中心的分析。通过易错PCR[8-9]、DNA shuffling[9-10]、定点突变[6,8,11-13]、饱和突 变[14-15]、双突变[16]及组合突变[17]等,目前已经获得大量scDAOCS突变体,对青霉素G的催化活力有明显提高[18]。最近,本实验室季俊杰等通过组合已知的有利突变,获得一系列对青霉素G活力提高的scDAOCS突变体,其中H5、H6与H7的catm分别提高至野生型的48、53与81倍[17]。
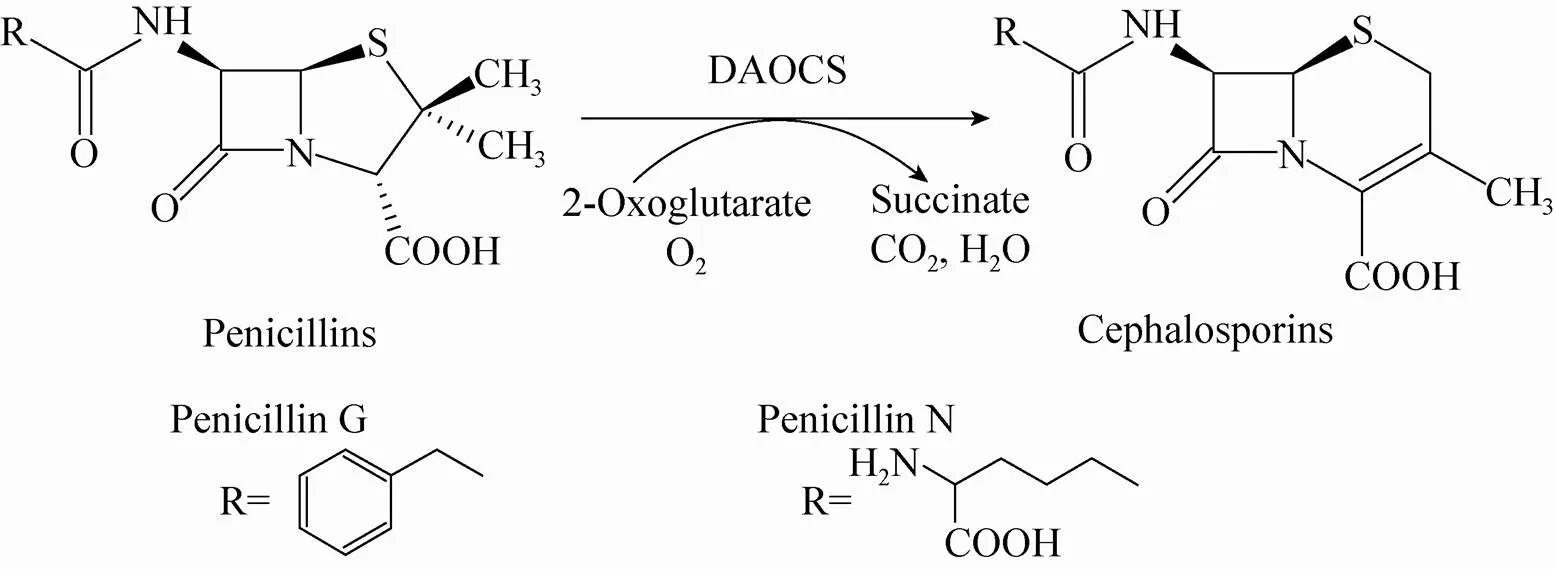
图1 DAOCS催化的扩环反应[17]
在对scDAOCS催化扩环反应的机理探索和活性改造过程中,人们已经注意到青霉素G对scDAOCS的催化活性有抑制作用。Valegård等在对scDAOCS反应机理的探索过程中曾经考察过青霉素G以及α-酮戊二酸浓度对于反应稳态速率的影响,他们通过固定青霉素G和α-酮戊二酸中一个的浓度,变化另一个的浓度,发现青霉素G或者α-酮戊二酸浓度的升高均会对稳态反应速率产生抑制作用[7]。Wei等在对scDAOCS进行活性改造的过程中发现,大部分多位点突变体在青霉素浓度为10 mmol/L时表现出明显的底物抑制现象[8]。Hsu等利用DNA shuffling对scDAOCS进行改造的过程中,发现大多数进化得到的高活性突变体都表现出显著的底物抑制现象[10],但是他们也发现有一些活性很好的突变体在青霉素G浓度为10 mmol/L时并不存在底物抑制,活性的高低似乎与底物抑制的产生之间并没有必然联系。
在对scDAOCS与Fe2+、α-酮戊二酸和/或青霉素G的复合物晶体结构进行分析的基础上,Valegård等推断DAOCS催化扩环反应的机理可能为“乒乓机制”[7]。晶体结构显示青霉素G与scDAOCS存在两种结合方式,其中一种为非生产构象,不能发生扩环反应。另外青霉素G与α-酮戊二酸的结合位点有部分重叠,因此作者推测二者不能同时结合,进而提出一种两阶段的反应机理[7]。在scDAOCS的活性中心,Fe2+与His183、Asp185、His243及三分子H2O形成八面体配位结构;α-酮戊二酸和O2先后与scDAOCS结合,取代活性中心的H2O并与Fe(II) 结合,发生脱羧与氧化反应,再经重排形成活泼的高氧化态Fe(IV) 形式;待生成的琥珀酸解离之后,青霉素底物再与scDAOCS结合并被Fe(IV) 氧化发生扩环反应。按照这一反应机理,青霉素G如果以非生产构象结合,将阻碍α-酮戊二酸与scDAOCS结合,从而表现为典型的竞争性抑制机制。然而Tarhonskaya等最近对scDAOCS的前稳态动力学与底物结合实验研究[19]却对这一机制提出了质疑。根据他们的研究,scDAOCS更有可能采取的是非血红素Fe2+和α-酮戊二酸依赖的氧化酶家族保守的双底物有序结合催化机制:α-酮戊二酸与青霉素按顺序与scDAOCS结合,形成DAOCS·Fe2+·α-酮戊二酸·青霉素四元复合物,随后O2与该复合物结合,导致α-酮戊二酸氧化脱羧,产生Fe(IV)-O过渡态,使得青霉素甲基去氢并发生重排,完成扩环反应。按照这一反应机制,青霉素G的底物抑制效应可能存在其他作用机理。
到目前为止,对DAOCS反应特性的研究及蛋白质工程改造的评价都极少涉及到高浓度底物,一般是在10 mmol/L或更低底物浓度下进行研究和评价,而高浓度底物下DAOCS的催化活性表现,对于工业应用具有极其重要的参考价值。本文通过对scDAOCS野生型和本实验室季俊杰等构建的几个高活性组合突变体H4、H5、H6、H7[17]在5.6–500 mmol/L青霉素G浓度区间内的催化活性进行研究,发现其中突变体H6在此范围内催化活性最高,并发现青霉素G对野生型scDAOCS的抑制作用与非竞争性抑制模型预测一致,这一结果对DAOCS高活力突变体在工业生产中的应用有借鉴意义。
1 材料与方法
1.1 材料
1.1.1 试剂
青霉素G、维生素C、MOPS等购自Sigma-Aldrich公司,α-酮戊二酸、二硫代苏糖醇 (DTT) 购自Merck公司,FeSO4购自天津市天河化学试剂厂,KH2PO4购自国药集团化学试剂有限公司,色谱纯乙腈购自Duksan Pure Chemicals公司,G-7-ADCA由中国科学院微生物研究所徐冠珠提供,其他试剂均为国产分析纯。
1.1.2 主要仪器设备
HPLC仪:岛津Prominence色谱系统,配备SPD-20A双波长紫外检测器、LC-20AT低压四元泵及混合器、Agilent ZORBAX Eclipse XDB-C18色谱柱 (3.5mm,4.6 mm´150 mm)。
LC-MS仪:安捷伦1200型HPLC系统,6460型三重四极杆质谱系统。
1.1.3 菌株与质粒
质粒pET-SC (pET30a(+)::,卡那霉素抗性,scDAOCS的表达载体) 由本实验室的伍晓斌博士构建[12]、大肠杆菌JM109和BL21 (DE3)由本实验室保存,scDAOCS突变体H4、H5、H6和H7由本实验室季俊杰等构建[17]。
1.1.4 培养基
LB培养基 (g/L):胰蛋白胨10,酵母提取物5,NaCl 10,pH 7.0。121 ℃灭菌30 min,加入15 g/L琼脂即为固体培养基。培养基中使用抗生素时,加入卡那霉素终浓度为50 mg/L。
1.1.5 缓冲液
含有5%甘油的缓冲液 M (g/L):MOPS 11.626 1,DTT 0.171 4,pH 7.5。注意要现配现用,防止DTT氧化。
1.2 方法
1.2.1 培养方法与活性测定
将含有野生型和H4、H5、H6和H7突变体scDAOCS基因的BL21 (DE3) 转化子接种到含有50 mg/L卡那霉素的10 mL LB液体培养基中,于37 ℃、220 r/min过夜培养。取出0.5 mL按照1%接种量接种到50 mL的相同培养基中培养至600=0.4,随后加入终浓度为0.1 mmol/L的IPTG,在25 ℃、220 r/min培养过夜。发酵完成后三角瓶取出冰浴, 9 000 r/min、4 ℃条件下离心3 min收集菌体。然后用含有5%甘油的缓冲液 M (pH 7.5) 冲洗菌体3遍,再将冲洗后的菌体重悬于10 mL的上述缓冲液中,超声破碎细胞,4 ℃、12 000 r/min离心15 min取上清,即为粗酶液。由于scDAOCS在空气中很快失活,因此活性测定实验使用粗酶液进行。粗酶液总蛋白测定采用Bradford 法[20]。粗酶液中scDAOCS的含量通过对粗酶液SDS-PAGE图像利用ImageJ软件[21]进行灰度值统计与计算得到。scDAOCS的1个酶活性单位定义为每分钟形成1 µg G-7-ADCA所需要的DAOCS的质量,DAOCS野生型酶及各突变体的比活力定义为每1 mg scDAOCS中含有的酶活性单位数[17]。
1.2.2 建立G-7-ADCA与青霉素G的HPLC定量检测方法
所用HPLC分析条件为:
流动相:A:10 mmol/L KH2PO4,用浓磷酸调至pH 3.0。B:含有0.1%三氟乙酸的乙腈。
洗脱条件:流速0.5 mL/min,70%A/30%B等度洗脱,洗脱时间25 min。采用220和260 nm进行HPLC分析检测[21]。
青霉素G定量标准曲线的建立:分别配制0.5、1、2、4、6及8 mmol/L的青霉素G水溶液,各取10 µL上样进行HPLC分析。以青霉素G浓度为横轴,220 nm下吸收峰面积为纵轴,绘出标准曲线。
G-7-ADCA标准曲线的建立:分别配制0.016、0.032、0.040、0.064、0.080及0.128 mmol/L的G-7-ADCA水溶液,各取10 µL上样进行HPLC分析。以G-7-ADCA浓度为横轴,260 nm下吸收峰面积为纵轴,绘出标准曲线。
1.2.3 蛋白反应活性测定
取220 μL粗酶液,按顺序加入FeSO4、α-酮戊二酸、维生素C储液各10mL (终浓度分别为FeSO41.8 mmol/L,α-酮戊二酸4.0 mmol/L,维生素C 0.4 mmol/L),250 μL不同浓度青霉素G储液 (终浓度分别为:5.6、10、20、40、80、100、200、300、500 mmol/L),30℃、220 r/min反应30 min[5]。100℃金属浴终止反应, 13 000 r/min离心5 min,取上清10 µL进行HPLC分析,测定260 nm下G-7-ADCA吸收峰面积,计算G-7-ADCA产量。
2 结果与分析
2.1 scDAOCS各突变体的活性
在Wei等[9]报道的scDAOCS高活力突变体H4 (C155Y/Y184H/V275I/C281Y) 基础上,本实验室季俊杰等采用迭代组合突变策略,引入已知的有利突变,构建了高活力突变体H5 (H4+I305M)、H6 (H5+T213V) 及H7 (H6+M73T),并在低青霉素G浓度下 (0.2–10.0 mmol/L) 对其活性进行了评 价[17]。为了在更接近工业应用条件下评价这些高活力scDAOCS,我们在5.6–500 mmol/L青霉素G浓度下对其催化活性进行了评价。
HPLC分析scDAOCS催化反应混合物的结果如图2所示,G-7-ADCA在220与260 nm下均有较强吸收,保留时间约为14 min;青霉素G仅在220 nm下具有较强吸收,保留时间约为18.5 min。
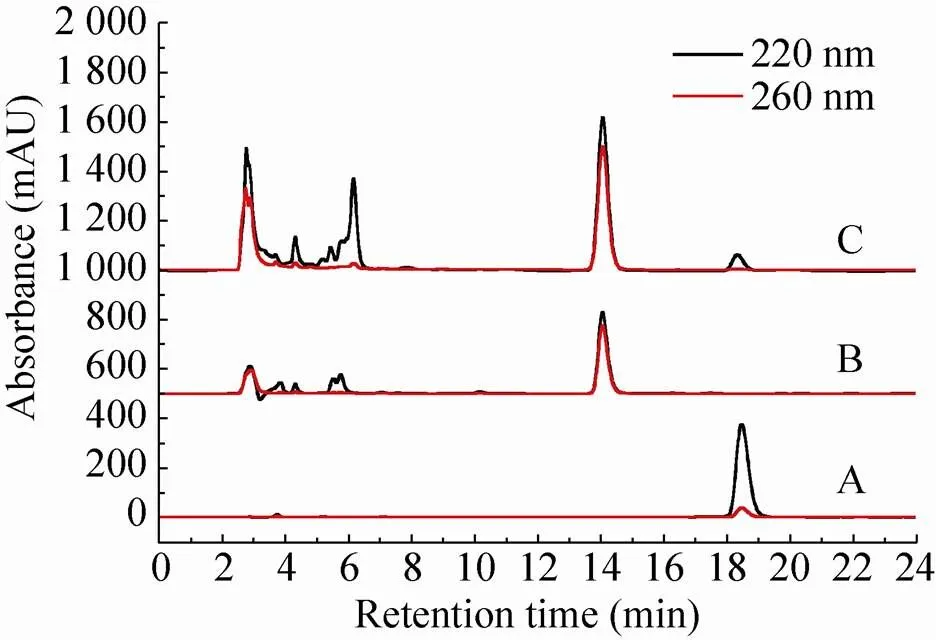
图2 青霉素G (A)、G-7-ADCA标准样 (B)及反应混合物的HPLC谱图 (C)
为进一步验证反应产物,我们收集对应于G-7-ADCA标准样的HPLC峰并进行LC-MS检验 (负离子模式)。结果如图3所示,可见预期的分子离子峰及相关信号:/331.1 ([M-H]–),663.2 ([2M-H]–),287.1 ([M-COOH]–)。这一结果表明该产物的确是预期产物G-7-ADCA。
野生型scDAOCS以及突变体H4、H5、H6和H7在5.6–500 mmol/L青霉素G范围内的比活力结果如图4所示,结果表明野生型scDAOCS以及这些突变体随青霉素G浓度的增加均出现底物抑制现象,但其表现形式却有明显差别。
对于野生型scDAOCS和突变体H4来说,其催化活性在青霉素G浓度约200 mmol/L时最强,青霉素G浓度继续增加时,其活性明显下降。这种先升后降的趋势与经典的竞争性抑制模型并不吻合。经典的竞争性抑制剂不改变表观max,只是使表观m增大,因此在底物浓度增加时催化反应速率仍能不断增加,并趋近于无抑制剂存在时的max。因此这一结果表明,Valegård等推断的竞争性抑制模型并不正确。另外,在青霉素G浓度大于40 mmol/L时野生型酶与H4的活性基本一致,说明H4在高青霉素G浓度下的表现并不好。
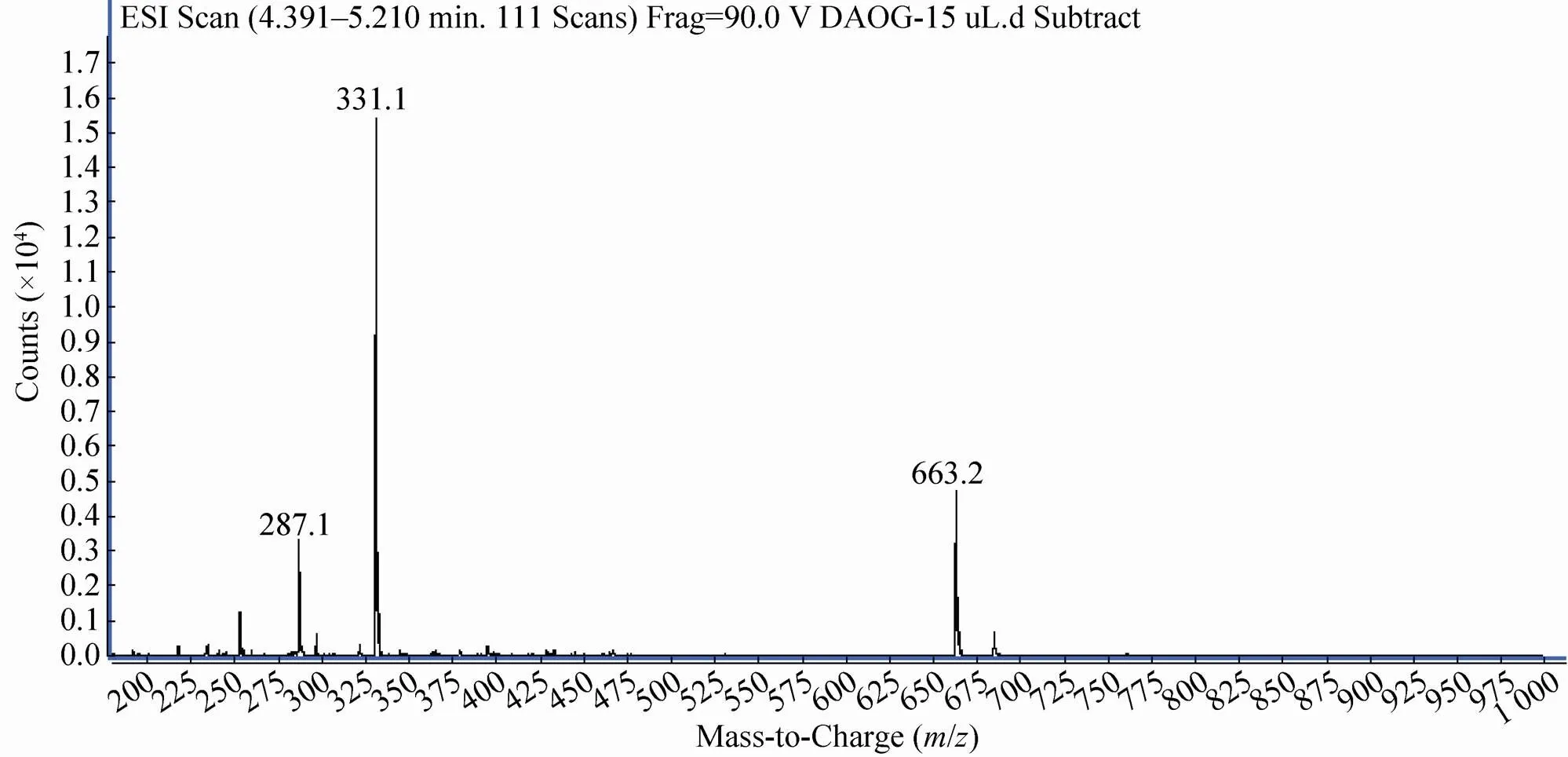
图3 产物G-7-ADCA的MS谱图(负离子模式)

图4 不同青霉素G浓度下scDAOCS各突变体的比活力
对于突变体H5、H6与H7来说,它们的活性随青霉素G浓度变化都表现出了奇异的先降后升再降的变化趋势,且活性的极小值均出现在青霉素G浓度为80 mmol/L时;H6和H7活性的极大值出现在青霉素G浓度为300 mmol/L时,H5活性极大值出现在青霉素G浓度为200 mmol/L时。这种复杂的变化趋势,表明在高浓度下青霉素G与scDAOCS突变体可能具有多种不同的结合方式,因而表现为多层次的抑制效应。
总体看来,H6、H7两个突变体具有更高的底物耐受性,并且H6在此浓度范围内的比活力远远高于其他突变体,尽管在低浓度下评价其活性略低于H7[17]。这一结果表明,H6更适合用于高青霉素G浓度条件下的工业应用中,其可以容忍底物青霉素G浓度增加到 300 mmol/L,同时仍然保持较高活性。这也提示我们,对于筛选适合工业应用的高活力突变体来说,在高浓度底物条件下进行筛选是必不可少的,仅依靠低浓度底物条件下的筛选结果进行评价可能还不够充分。
最近,付金衡等利用突变体H7成功构建了大肠杆菌全细胞催化青霉素G生产G-7-ADCA的工艺[22]。在对其进行条件优化时,他们发现在青霉素G浓度达到50 mmol/L时,增加底物的促进作用与抑制作用达到平衡,继续增加青霉素G其产量不升反降[22]。这说明青霉素G对scDAOCS的抑制作用已经限制了其在工业生产中的应用,换用在高浓度底物条件下仍有较强活力的突变体,如H6等,可能有助于进一步提高其转化能力。
2.2 青霉素G对DAOCS抑制反应动力学模型的理论预测与检验
Tarhonskaya等最近对scDAOCS的前稳态动力学与底物结合实验研究[19]表明scDAOCS的反应机制符合双底物有序反应模型,晶体结构显示青霉素G与scDAOCS存在两种结合方式,其中一种结合方式与产物取向一致,被认为是生产构象,另一种取向与α-酮戊二酸一致,可能起抑制作用,称为非生产构象[7]。在此基础上,我们提出几种青霉素G对scDAOCS的抑制作用机理模型,并利用我们的实验结果进行初步的检验。
我们假设scDAOCS·Fe2+·α-酮戊二酸·青霉素G四元复合物催化扩环反应为限速步骤,而在此之前的各个底物的结合反应均已达到平衡,即符合稳态平衡假设。由于在我们的实验条件下,G-7-ADCA的产量较低,实际转化率均小于5%,因此我们可以假设α-酮戊二酸与青霉素G的浓度变化不大,并以其初始浓度来近似。
模型1:假设青霉素G可以非生产构象与scDAOCS结合,同时抑制了a-酮戊二酸的结合以及青霉素G以生产构象结合,即Valegård等[7]推测的竞争性抑制模型。其中E表示scDAOCS,OG表示a-酮戊二酸,PG表示以生产构象结合的青霉素G,PGi表示以非生产构象结合的青霉素G。
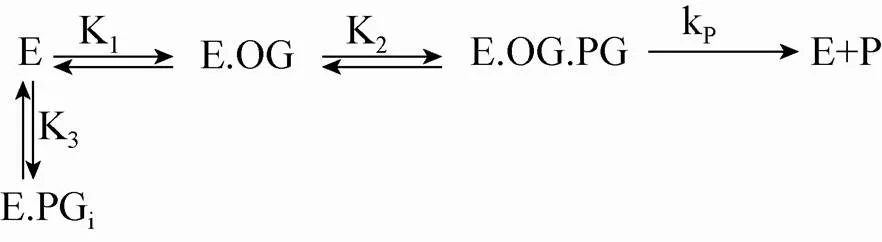
可推出反应速率为
其中=p12EOG,=1+1OG,=3+12OG,E为酶浓度,OG为a-酮戊二酸浓度,PG为青霉素G浓度,p为复合物催化开环反应的反应速率常数,其他参数为各步结合反应的平衡常数 (模型1)。按此速率方程,反应速率随青霉素G浓度增加而增加,但增加幅度逐渐放缓,呈双曲线形。这与我们实验结果均不一致,表明青霉素G对scDAOCS的抑制不符合竞争性抑制模型。
模型2:假设青霉素G可以非生产构象与scDAOCS结合,抑制了a-酮戊二酸的结合,同时不影响青霉素G以生产构象结合,但无反应活性,即对a-酮戊二酸为竞争性抑制,对青霉素G为非竞争性抑制。

可推出反应速率为
其中=p12EOG,=1+1OG,=3+12OG,=36,其他参数含义同上。对其求一阶导数可知在PG逐渐增加至时,反应速率达到最大值,然后又随PG增加而逐渐下降,呈现先升后降的趋势,这与我们实验得到的scDAOCS野生型酶及突变体H4的结果一致。
模型3:假设青霉素G可以非生产构象与scDAOCS结合,同时不影响a-酮戊二酸结合以及青霉素G以生产构象结合,但无反应活性,即对a-酮戊二酸和青霉素G均为非竞争性抑制。
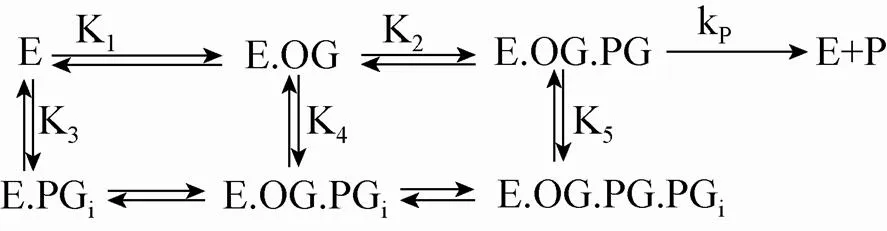
可推出反应速率为
其中=p12EOG,=1+1OG,=3+12OG+14OG,=125OG,其他参数含义同上。因为反应速率的形式与模型2一致,因此其表现也应相同。
综上所述,根据理论模型与我们实验结果的比较,可以推论:青霉素G在scDAOCS上至少有两个结合位点,并且可以同时结合,即青霉素G对其自身为非竞争性抑制。但是从我们的实验结果不能判断青霉素G对a-酮戊二酸为竞争性或非竞争性抑制作用。
尽管理论模型对反应速率变化趋势的推论与scDAOCS野生型酶及突变体H4的实验结果一致,但是仍不能解释H5、H6及H7的复杂变化趋势。相对于H4,这3个突变体都多出一个共同的突变位点I305M[17]。Wei等的研究结果表明I305位点的突变对scDAOCS活性有重要影响,对于青霉素G,I305M是I305突变体中cat增加最大的[8]。晶体结构 (PDB:1UOB[7]) 显示I305位于活性中心,侧链末端距离Fe(II) 约4 Å。I305可直接参与底物青霉素的结合,其侧链末端与青霉素的四元内酰胺环接近,与1位硫原子及5、6位碳原子距离在5 Å以内,形成疏水作用;与α-酮戊二酸距离也在4−6 Å,但未形成有利的相互作用。将此位点突变为Met,尽管突变后Met仍以疏水作用为主,但是其侧链更长,同时引入一个硫原子,因此该突变可能改变了底物结合口袋的形状及化学性质,进而使底物青霉素G及α-酮戊二酸的结合方式与结合能力发生变化,从而引起复杂的底物抑制现象。对突变体I305M及其与青霉素G和α-酮戊二酸的复合物进行晶体结构研究,可能有助于我们了解其可能的作用机制。
3 结论
青霉素扩环酶是酶法催化青霉素类化合物合成头孢类化合物的关键酶,具有潜在的工业应用价值。我们研究了scDAOCS野生型酶以及高活力突变体H4、H5、H6、H7在青霉素G浓度5.6–500 mmol/L区间内的活性变化趋势,发现在高青霉素G浓度下它们均存在明显的底物抑制现象,其中H6在青霉素G浓度大于 100 mmol/L时仍能保持较高的催化活力,适合在高浓度底物下的工业应用。
野生型scDAOCS及各个突变体在高青霉素G浓度 (大于80 mmol/L) 均表现出复杂的底物抑制现象,其中野生型酶及突变体H4的表现与非竞争性抑制模型预测相符,而突变体H5、H6和H7可能有更复杂的抑制作用机制。
[1] Baldwin JE, Abraham E. The biosynthesis of penicillins and cephalosporins. Nat Prod Rep, 1988, 5(2): 129–145.
[2] Valegård K, van Scheltinga AC, Lloyd MD, et al. Structure of a cephalosporin synthase. Nature, 1998, 394(6695): 805–809.
[3] Kovacevic S, Weigel BJ, Tobin MB, et al. Cloning, characterization, and expression inof thegene encoding deacetoxycephalosporin C synthetase. J Bacteriol, 1989, 171(2): 754–760.
[4] Diez B, Mellado E, Rodriguez M, et al. Recombinant microorganisms for industrial production of antibiotics. Biotechnol Bioeng, 1997, 55(1): 216–226.
[5] Cho H, Adrio JL, Luengo JM, et al. Elucidation of conditions allowing conversion of penicillin G and other penicillins to deacetoxycephalosporins by resting cells and extracts ofNP1. Proc Natl Acad Sci USA, 1998, 95(20): 11544–11548.
[6] Chin HS, Sim TS. C-terminus modification ofdeacetoxycephalosporin C synthase improves catalysis with an expanded substrate specificity. Biochem Biophys Res Comm, 2002, 295(1): 55–61.
[7] Valegård K, van Scheltinga AC, Dubus A, et al. The structural basis of cephalosporin formation in a mononuclear ferrous enzyme. Nat Struct Mol Biol, 2004, 11(1): 95–101.
[8] Wei CL, Yang YB, Wang WC, et al. Engineeringdeacetoxycephalosporin C synthase for optimal ring expansion activity toward penicillin G. Appl Environ Microbiol, 2003, 69(4): 2306–2312.
[9] Wei C, Yang Y, Deng C, et al. Directed evolution ofdeacetoxycephalosporin C synthase for enhancement of penicillin G expansion. Appl Environ Microbiol, 2005, 71(12): 8873–8880.
[10] Hsu J, Yang Y, Deng C, et al. Family shuffling of expandase genes to enhance substrate specificity for penicillin G. Appl Environ Microbiol, 2004, 70(10): 6257–6263.
[11] Lee HJ, Dai YF, Shiau CY, et al. The kinetic properties of various R258 mutants of deacetoxycephalosporin C synthase. Eur J Biochem, 2003, 270(6): 1301–1307.
[12] Ji J, Tian X, Fan K, et al. New strategy of site-directed mutagenesis identifies new sites to improvedeacetoxycephalosporin C synthase activity toward penicillin G. Appl Microbiol Biotechnol, 2012, 93(6): 2395–2401.
[13] Chin HS, Sim J, Sim TS. Mutation of N304 to leucine indeacetoxycephalosporin C synthase creates an enzyme with increased penicillin analogue conversion. Biochem Biophys Res Comm, 2001, 287(2): 507–513.
[14] Goo KS, Chua CS, Sim TS. A complete library of amino acid alterations at R306 indeacetoxycephalosporin C synthase demonstrates its structural role in the ring-expansion activity. Proteins, 2008, 70(3): 739–47.
[15] Chin HS, Goo KS, Sim TS. A complete library of amino acid alterations at N304 indeacetoxycephalosporin C synthase elucidates the basis for enhanced penicillin analogue conversion. Appl Environ Microbiol, 2004, 70(1): 607–609.
[16] Goo KS, Chua CS, Sim TS. Relevant double mutations in bioengineereddeacetoxycephalosporin C synthase result in higher binding specificities which improve penicillin bioconversion. Appl Environ Microbiol, 2008, 74(4): 1167–1175.
[17] Ji J, Fan K, Tian X, et al. Iterative combinatorial mutagenesis as an effective strategy for generation of deacetoxycephalosporin C synthase with improved activity toward penicillin G. Appl Environ Microbiol, 2012, 78(21): 7809–7812.
[18] Goo KS, Chua CS, Sim TS. Directed evolution and rational approaches to improvingdeacetoxycephalosporin C synthase for cephalosporin production. J Ind Microbiol Biotechnol, 2009, 36(5): 619–633.
[19] Tarhonskaya H, Szöllössi A, Leung IKH, et al. Studies on deacetoxycephalosporin C synthase support a consensus mechanism for 2-oxoglutarate dependent oxygenases. Biochemistry, 2014, 53(15): 2483–2493.
[20] Bradford MM. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal Chem, 1976, 72(1/2): 248–254.
[21] Girish V, Vijayalakshmi A. Affordable image analysis using NIH Image/ImageJ. Indian J Cancer, 2004, 41(1): 47–47.
[22] Fu JH, Zhao J, Lin BX, et al. Optimization of whole-cell biocatalysis for phenylacetyl-7- aminodeacetoxycephalosporanic acid production. Chin J Biotech, 2014, 30(11): 1782–1786(in Chinese).付金衡, 赵健, 林白雪, 等. 全细胞催化生产苯乙酰-7-氨基-3-脱乙酰氧基头孢烷酸的条件优化. 生物工程学报, 2014, 30(11): 1782–1786.
(本文责编 陈宏宇)
Evaluation of penicillin expandase mutants and complex substrate inhibition characteristics at high concentrations of penicillin G
Linjun Wu1,2, Keqiang Fan1, Junjie Ji1, and Keqian Yang1
1 State Key Laboratory of Microbial Resources, Institute of Microbiology, Chinese Academy of Sciences, Beijing 100101, China2 University of Chinese Academy of Sciences, Beijing 100049, China
Penicillin expandase, also known as deacetoxycephalosporin C synthase (DAOCS), is an essential enzyme involved in cephalosporin C biosynthesis. To evaluate the catalytic behaviors of penicillin expandase under high penicillin G concentration and to identify mutants suitable for industrial applications, the specific activities of wild-type DAOCS and several mutants with increased activities toward penicillin G were determined by HPLC under high penicillin G concentrations. Their specific activity profiles were compared with theoretical predictions by different catalytic dynamics models. We evaluated the specific activities of wild-type DAOCS and previous reported high-activity mutants H4, H5, H6 and H7 at concentrations ranging from 5.6 to 500 mmol/L penicillin G. The specific activities of wild-type DAOCS and mutant H4 increased as penicillin G concentration increased, but decreased when concentrations of substrate go above 200 mmol/L. Other mutants H5, H6 and H7 showed more complex behaviors under high concentration of penicillin G. Among all tested enzymes, mutant H6 showed the highest activity when concentration of penicillin G is above 100 mmol/L. Our results revealed that the substrate inhibition to wild-type DAOCS by penicillin G is noncompetitive. Other DAOCS mutants showed more complex trends in their specific activities at high concentration of penicillin G (>100 mmol/L), indicating more complex substrate inhibition mechanism might exist. The substrate inhibition and activity of DAOCS mutants at high penicillin G concentration provide important insight to help select proper mutants for industrial application.
deacetoxycephalosporin C synthase, substrate inhibition, high penicillin G concentration
January 29, 2015; Accepted:March 13, 2015
Keqian Yang. Tel/Fax: +86-10-64807459; E-mail: yangkq@im.ac.cn
10.13345/j.cjb.150057
Supported by:National Basic Research Program of China (973 Program) (No. 2013CB734001).
2015-05-14
http://www.cnki.net/kcms/detail/11.1998.Q.20150514.1403.002.html
国家重点基础研究发展计划 (973计划) (No. 2013CB734001) 资助。

