改造大肠杆菌合成海藻糖途径以高效合成海藻糖
高超,张山,何永志,黄健忠,董志扬
改造大肠杆菌合成海藻糖途径以高效合成海藻糖
高超1,张山2,何永志2,黄健忠1,董志扬2
1 福建师范大学生命科学学院福建师范大学工业微生物教育部工程研究中心福建省现代发酵技术工程研究中心,福建福州 350108 2 中国科学院微生物研究所,北京 100101

高超, 张山, 何永志, 等. 改造大肠杆菌合成海藻糖途径以高效合成海藻糖. 生物工程学报, 2015, 31(12): 1784−1788.Gao C, Zhang S, He YZ, et al. Construction of a recombinant Escherichia coli for high trehalose production. Chin J Biotech, 2015, 31(12): 1784−1788.
海藻糖是相容性溶质的一种,因其具有多种生物学功能,在食品、化妆品、药品以及器官移植等方面均有很广泛应用。然而近几年生产海藻糖主要集中在使用酶催化的方法,虽然这种方法的转化效率高,但是却存在着副产物的问题,难以得到高纯度的海藻糖产品,严重制约了海藻糖的应用。本文通过基因工程技术在大肠杆菌中构建了海藻糖高效合成新途径,通过全细胞催化合成海藻糖。利用PCR技术在哈氏噬纤维菌中克隆获得海藻糖双功能合成酶基因 (),采用pTac-HisA高效表达载体,实现海藻糖双功能合成酶基因 () 高效表达,利用高效表达菌株进行全细胞催化,将葡萄糖高效转化为海藻糖。结果表明海藻糖合成酶基因 () 在中成功实现表达,该酶能够在胞内将葡萄糖高效转化为海藻糖,并将其转运到胞外,实现海藻糖的高效率合成,海藻糖的产量提高到1.2 g/L,相对转化率为21%。当将此高产菌株在发酵罐中进行转化时,海藻糖的产量达到13.3 g/L,葡萄糖的相对转化率达到48.6%。采用海藻糖合成酶基因高效表达并且应用于海藻糖全细胞合成催化在国内外尚属首次报道,海藻糖的转化率及产率都已达到文献报道最高水平,本研究为开拓海藻糖生产新技术奠定了基础。
海藻糖,双功能酶,海藻糖合成酶,全细胞催化,大肠杆菌,条件优化
海藻糖是一种非还原型二糖,在自然界中分布非常广泛,比如植物、真菌、细菌等[1]。作为一种生物活性物质,海藻糖具有很强的保水性以及对生物大分子如蛋白、核酸和细胞膜等的保护作用[2]。正是由于其上述特性,使得海藻糖具有很好的商业前景[2-3]。
海藻糖生产的目的是希望获得高纯度的产品,目前生产海藻糖的方法主要包括3个:一是从生物细胞中直接提取。酿酒酵母作为传统的生产海藻糖的菌株,具有在特定的生理条件下海藻糖的含量能达到细胞干重的10%–15%[4]的优势,但是这种方法的效率偏低,如安宁[5]将酵母诱变后通过一系列的优化,最终海藻糖的产量达到了5.4 g/L。二是采用微生物发酵提取相关的海藻糖合成酶,使用酶催化法合成海藻糖,如黄英等[6]在中克隆表达了玫瑰链霉菌海藻糖合成酶基因,使用这种海藻糖合成酶可以实现85%的转化率,但是产物中仍有5%的副产物葡萄糖,导致产品不纯,此外这种方法的缺点还包括酶容易失活。三是采用微生物发酵法生产,这种方法由于微生物生长旺、繁殖快,易于培养,具有先天的优越性,结合全细胞催化的方法,可以有效降低杂质的含量,同时利用微生物细胞的代谢可以几乎完全去除底物,有利于提高海藻糖的纯度,因此是一个潜在的可以获得高纯度海藻糖的方法。
目前构建工程菌株合成海藻糖,主要是利用OtsBA途径[7-8]。研究表明,酶之间的物理距离影响着通路的活力,Seo等[9]通过人工方法将OtsA和OtsB融合在一起,发现海藻糖合成酶的催化活力提高了3.5–4倍。实际上,Avonce等[10]发现哈氏嗜纤维菌中存在着天然状态下用于合成海藻糖的双功能酶TPSP。本实验首次将双功能酶TPSP在大肠杆菌中进行过表达,使用全细胞催化的方法,对转化条件进行优化,获得用于海藻糖合成的高产菌株。
1 材料与方法
1.1 材料
1.1.1 菌株和质粒
菌种有DH5α和BW25113,前者购自北京全式金生物技术有限公司,后者为实验室保藏的菌株。表达质粒为实验室保藏的pTac-HisA,为IPTG诱导。
1.1.2 酶和试剂
高保真DNA扩增酶购自北京全式金生物技术有限公司。限制性内切酶和碱性磷酸酶购自NEB公司。T4 DNA连接酶购自Themo公司。DNA纯化试剂盒、DNA回收试剂盒以及质粒提取试剂盒均购自天根生化科技(北京) 有限公司。井冈霉素购自北京华迈科生物科技有限公司。氨苄青霉素和诱导剂异丙基硫代半乳糖苷 (IPTG) 购自Sigma公司。其他化学试剂均为国药试剂。
1.1.3 培养基、转化液和抗生素浓度
摇瓶实验;菌体活化、培养和诱导表达时使用LB培养基,发酵罐实验所用的培养基参考文献[11],所有转化实验均在加有底物葡萄糖的50 mmol/L磷酸盐缓冲液(pH 7.0) 中进行,且培养和转化过程中添加终浓度为100 ng/mL的氨苄青霉素,转化时还需要添加1 mmol/L海藻糖酶抑制剂井冈霉素。
1.2 方法
1.2.1 引物设计
根据NCBI中ATCC 33406的全基因组序列(gb| CP 000383.1),设计合成tpsp的PCR引物。序列如下:
F1: 5ʹ-ACAGGAAACAGCTAGCATGAATGACG AAAAAAGATT-3ʹ;
F2: 5ʹ-GCTGCAGCTCGAGTTATAAAAACGTAT TCAGAATG-3ʹ。
1.2.2表达载体的构建及tpsp基因的诱导表达
转化参照文献[12]进行,质粒的提取、酶切与 DNA 片段的回收和连接参照产品说明书进行;诱导表达参考分子克隆:实验室手册[13]。使用的基因组为模板构建表达载体时,使用引物F1和F2扩增,将PCR产物和pTac-HisA载体均使用Ⅰ和Ⅰ进行双酶切,胶回收tpsp片段和载体部分片段,经T4 DNA连接酶连接成完整质粒,命名为v-pTac-tpsp。构建好载体后,将其转化BW25113,命名为pTac-tpsp。
1.2.3 工程菌pTac-tpsp转化条件优化
从超低温冰箱取出的菌种,在LB中活化后,然后按照1∶100接种至100 mL LB中,37 ℃下培养至600达到0.6–0.8时,添加0.5 mmol/L诱导剂IPTG,30 ℃诱导8 h。1) 转化体系中菌体浓度和转化时间:细菌经诱导离心后收集菌体,用转化液 (初始底物葡萄糖浓度为20 g/L) 重悬菌体,使得转化体系中最终600分别为5、10、15、20、25及30。2) 转化液中底物浓度:根据1) 最佳结果而定,分别使用含有5、10、15、20、25 g/L葡萄糖的转化液。3) 优化转化温度:使用前两步优化条件,使用不同的转化温度 (25 ℃、30 ℃、35 ℃、37 ℃、40 ℃、45 ℃)。以上实验转化时间均为12 h,转化完成后检测上清中海藻糖的含量。
1.2.4 工程菌发酵罐发酵
从超低温冰箱拿出来的菌种,在LB中活化后,以1∶100接种至发酵罐种子培养基中,过夜。第2天按照1∶100转接到发酵罐中,待葡萄糖消耗完全以后,开始补糖。待菌体密度达到600为20时,添加0.5 mmol/L的IPTG,30 ℃开始诱导,大约8 h后,发酵液用5 000 r/min (Eppendorf 5804R,转子半径15 cm) 离心20 min,去除上清,收集菌体,使用优化后的反应条件进行转化。
1.2.5 海藻糖样品的制备和含量分析
转化液12 000 r/min离心10 min后,分为全菌和上清两个部分,直接取150 μL上清加150 μL ddH2O和700 μL乙腈,混匀后过滤,即为上清样品。全菌使用1 mL的超纯水重悬后,沸水浴30 min, 12 000 r/min离心10 min,取150 μL上清加150 μL ddH2O和700 μL乙腈,混匀后过滤,即为全菌样品。HPLC检测时使用70%乙腈为流动相,流速1 mL/min,上样10 μL,采用RID检测器,柱温和检测器温度均为35 ℃,色谱柱为安捷伦ZORBX NH2。
2 结果
2.1基因的克隆与功能性表达
以基因组DNA为模板,经PCR扩增后,电泳分析,得到一条约2 200 bp的条带,结果如图1A所示,其大小与理论的大小相吻合。然后将其与表达载体连接,转化DH5α,经鉴定无误后,转化BW25113,再经过诱导表达分析,结果如图1B所示。箭头指向为目的蛋白条带,其大小为84.45 kDa,与预期相吻合。

图1 C. hutchinsoniitpsp基因的克隆(A) 和在BW25113 (B)中的表达
为检验表述的TPSP是否有功能,我们将诱导后的菌体使用转化液重悬,添加2%葡萄糖和1 mmol/L的井冈霉素,30 ℃转化后,分别取胞内和胞外的样品进行检测,发现工程菌株pTac-tpsp的海藻糖产量,胞外为对照菌的6.3倍,胞内为对照菌的2.3倍,因此双功能酶TPSP可在中功能性表达,且海藻糖主要分泌在胞外。
2.2 转化体系中生长密度对糖转化的影响
转化中并非菌体量越大对生物转化就越有利。图2A为转化体系中菌体600对转化效率的影响。从图中可以看出600为20,转化时间为12 h时,海藻糖的产量最高,达0.6 g/L。为了验证转化能否将葡萄糖彻底消耗,我们取不同时间点的样品检测葡萄糖的残留量,如图2B所示,使用600为20的菌体密度时,当底物浓度为20 g/L时,转化24 h时葡萄糖已经消耗殆尽,发酵液中的糖分只剩下海藻糖。
2.3 转化体系中底物浓度对海藻糖转化的影响
转化体系中,葡萄糖浓度也是一个至关重要的因素,因为浓度太低会使得菌体没有足够的底物合成海藻糖,而浓度太高,过多的海藻糖会影响的生理代谢。图3A为底物浓度对转化效率的影响,从结果中可以看出,当葡萄糖浓度在10 g/L的时候,海藻糖积累量最高,达到0.92 g/L。
2.4 转化温度对海藻糖积累的影响
酶催化反应对温度比较敏感,温度过高或者偏低都不利于酶促反应的进行。由图3B可以看出,当温度为37 ℃时,海藻糖的积累量最高,达到1.20 g/L。
2.5 发酵罐转化实验
通过预实验发现在发酵罐中当菌体密度达到600值为40的时候,单位时间的转化效率较高,可能是因为发酵罐中可以实时监控并且调节溶氧和pH,因此我们使用的菌体密度为600=40。转化以后每隔一段时间取样,检测海藻糖的产量发现,维持葡萄糖浓度在10–15 g/L的情况下,在前30 h的海藻糖的合成量在升高,最终产量达到13.3 g/L。
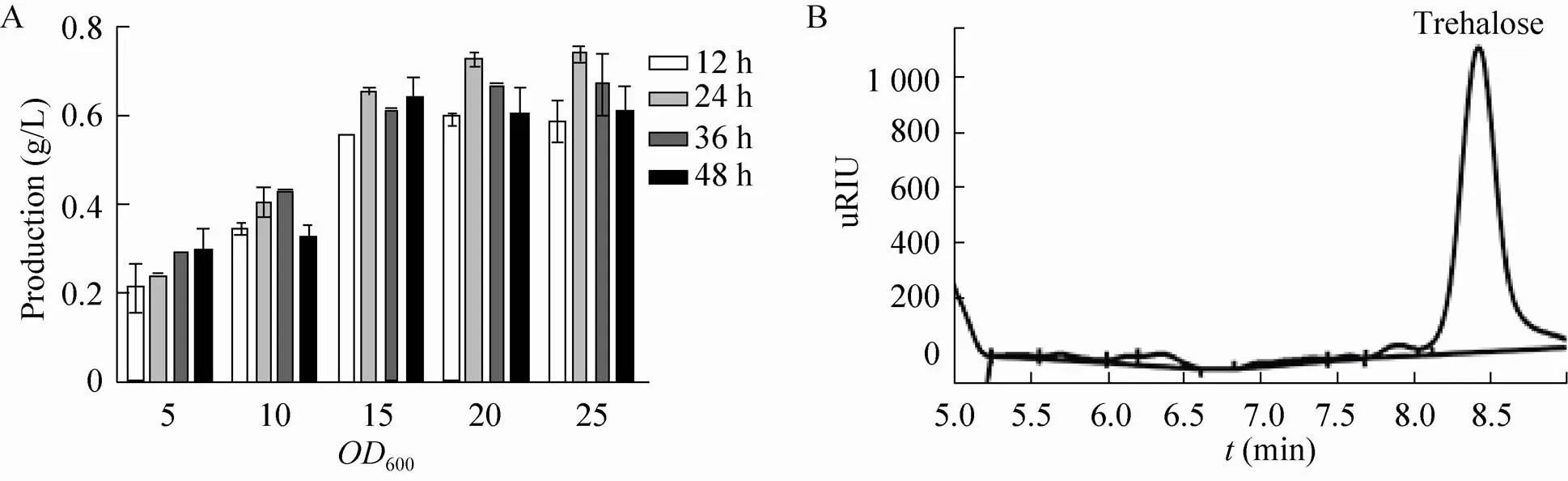
图2 E. coli菌体生长密度 (A) 和转化时间(B)对海藻糖产量的影响
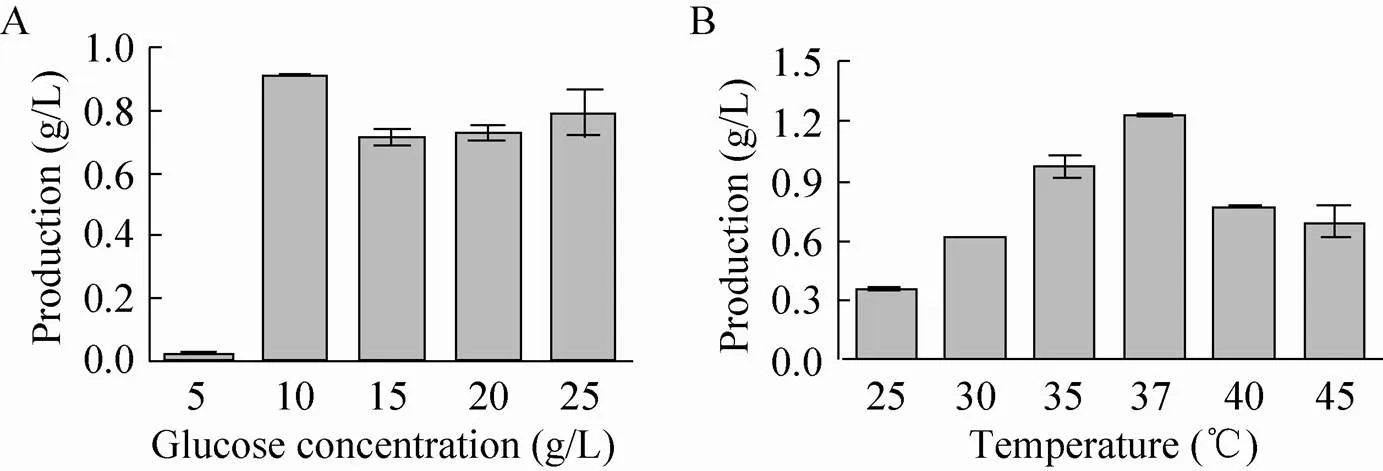
图3 TPSP转化E. coli体系中葡萄糖浓度 (A) 和发酵培养温度(B)对海藻糖生产的影响
3 讨论
目前的研究表明具有5条海藻糖合成途径,分别为OtsBA[14]、TreP[15]、TreS[16]、TreT[17]和TreYZ[18]途径。其中使用otsBA途径合成海藻糖还停留在过表达OtsA和OtsB两个酶,比如,Li等[7]在DH5α中过表达MG1665的基因,通过优化,海藻糖的产量达到了1.7 g/L,Kong等[19]对基因进行定向进化,使该途径的酶活提高了12.3倍,达到12.77 mg/g细胞。但是研究表明酶之间的物理距离影响着代谢途径的效率,因此本实验首次将来源于的双功能酶TPSP在中实现功能性表达。结果表明,经过优化以后,在摇瓶水平上,海藻糖的产量已经达到1.2 g/L,相对转化率为21% (相对转化率为实际转化率占理论转化率的比重,理论转化率为57%),在发酵罐中,产量为13.3 g/L,相对转化率为48.6%。
[1] Paul MJ, Primavesi LF, Jhurreea D, et al. Trehalose metabolism and signaling. Annu Rev Plant Biol, 2008, 59: 417–441.
[2] Luyckx J, Baudouin C. Trehalose: an intriguing disaccharide with potential for medical application in ophthalmology. Clin Ophthalmol, 2011, 5: 577–581.
[3] Richards AB, Krakowka S, Dexter LB, et al. Trehalose: a review of properties, history of use and human tolerance, and results of multiple safety studies. Food Chem Toxicol, 2002, 40(7): 871–898.
[4] Grba S, Oura E, Suomalainen H. On the formation of glycogen and trehalose in baker's yeast. Eur J Appl Microbiol Biotechnol, 1975, 2(1): 29–37.
[5] An N. Study on the production of trehalose by yeast[D]. Wuxi: Jiangnan University, 2012 (in Chinese).安宁. 酵母菌生产海藻糖的研究[D]. 无锡: 江南大学, 2012.
[6] Huang Y, Lin F, Lei PX, et al. Cloning, expression and characterization of a novel gene encoding trehalose synthase from. Biotechnology, 2013, 23(1): 11–16 (in Chinese)黄英, 林芳, 雷攀先, 等. 玫瑰链霉菌海藻糖合成酶基因克隆、表达及功能鉴定. 生物技术, 2013, 23(1): 11–16.
[7] Li H, Su H, Kim SB, et al. Enhanced production of trehalose inby homologous expression ofin the presence of the trehalase inhibitor, validamycin A, at high osmolarity. J Biosci Bioeng, 2012, 113(2): 224–232.
[8] Padilla L, Krämer R, Stephanopoulos G, et al. Overproduction of trehalose: heterologous expression oftrehalose-6-phosphate synthase and trehalose-6-phosphate phosphatase in. Appl Environ Microbiol, 2004, 70(1): 370–376.
[9] Seo HS, Koo YJ, Lim JY, et al. Characterization of a bifunctional enzyme fusion of trehalose-6-phosphate synthetase and trehalose-6-phosphate phosphatase of. Appl Environ Microbiol, 2000, 66(6): 2484–2490.
[10] Avonce N, Wuyts J, Verschooten K, et al. TheChTPSP: first characterized bifunctional TPS-TPP protein as putative ancestor of all eukaryotic trehalose biosynthesis proteins. Mol Biol Evol, 2010, 27(2): 359–369.
[11] Li Y, Chen J, Mao YY, et al. Fermentation conditions for production of glutathione by recombinant. Acta Microbiol Sin, 1999, 39(4): 355–361李寅, 陈坚, 毛英鹰, 等. 重组大肠杆菌生产谷胱甘肽发酵条件的研究. 微生物学报, 1999, 39(4): 355–361.
[12] Sambrook J, Fritsch EF, Maniatis T. Molecular Cloning: A Laboratory Manual. 2nd Ed. New York: Cold Spring Harbor Laboratory Press, 1989.
[13] Sambrook J, Russell DW. Molecular Cloning: A Laboratory Manual. 3rd Ed. Huang PT, trans. Beijing: Science Press, 2002 (in Chinese). Sambrook J, Russell DW. 分子克隆实验指南. 3版. 黄培堂, 译. 北京: 科学出版社, 2002.
[14] Boos W, Ehmann U, Bremer E, et al. Trehalase of: mapping and cloning of its structural gene and identification of the enzyme as a periplasmic protein induced under high osmolarity growth conditions. J Biol Chem, 1987, 262(27): 13212–13218.
[15] Goedl C, Schwarz A, Minani A, et al. Recombinant sucrose phosphorylase from: characterization, kinetic studies of transglucosylation, and application of immobilised enzyme for production of alpha-D-glucose 1-phosphate. J Biotechnol, 2007, 129(1): 77–86.
[16] Zdzieblo A, Synowiecki J. Production of trehalose by intramolecular transglucosylation of maltose catalysed by a new enzyme fromHB-8. Food Chem, 2006, 96(1): 8–13.
[17] Tzvetkov M, Klopprogge C, Zelder O, et al. Genetic dissection of trehalose biosynthesis in: inactivation of trehalose production leads to impaired growth and an altered cell wall lipid composition. Microbiology, 2003, 149(7): 1659–1673.
[18] Fang TY, Hung XG, Shih TY, et al. Characterization of the trehalosyl dextrin-forming enzyme from the thermophilic archaeonATCC 35092. Extremophiles, 2004, 8(4): 335–343.
[19] Kong XD, Liu Y, Gou XJ, et al. Directed evolution of operon of trehalose-6-phosphate synthase/phosphatase from. Biochem Biophys Res Commun, 2001, 280(1): 396–400.
(本文责编 郝丽芳)
Construction of a recombinantfor high trehalose production
Chao Gao1, Shan Zhang2, Yongzhi He2, Jianzhong Huang1, and Zhiyang Dong2
1 Engineering Research Center of Fujian Modern Fermentation Technology, Engineering Research Center of Industrial Microbiology, Ministry of Education, College of Life Sciences, Fujian Normal University, Fuzhou 350108, Fujian, China2 Institute of Microbiology, Chinese Academy of Sciences, Beijing 100101, China
Trehalose, a compatible solute, is widely used in food, cosmetics, pharmaceutical products and organ transplantation. Nowadays, trehalose is mostly produced by enzymatic synthesis with many secondary products and low purity. In this study, high amount of trehalose was produced by recombinantfermentation. First, a bifunctional trehalose gene TPSP was amplified from genome of. Second, an expression vector pTac-HisA containing TPSP was constructed and transformed into the host. Expression of this bifunctional enzyme-TPSP converted glucose to trehalose. The result suggested that TPSP fromhas been successfully expressed in. High amount of extracellular trehalose generated from glucose by whole-cell catalysis and After optimization, the production of trehalose in shake flasks was improved to 1.2 g/L and the relative conversion rate reached 21%. The production in bioreactor reached 13.3 g/L and the relative conversion rate reached 48.6%. It is the first time to realize the functional expression of the bifunctional enzyme-TPSP ofinand achieved the conversion form glucose to trehalose. This study laid a foundation for industrial large-scale production of trehalose.
trehalose, bifunctional enzyme, trehalose synthase, whole-cell biocatalysis,, conditions optimization
February 3, 2015; Accepted:March 26, 2015
Zhiyang Dong. Tel: +86-10-64807337; E-mail: dongzy@im.ac.cnJianzhong Huang. Tel: +86-591-22868212; E-mail: hjz@fjnu.edu.cn
10.13345/j.cjb.150070
Supported by:National Natural Science Foundation of China (No. 31100066), National High Technology Research and Development Program (863 Program) (No. 2012AA02A703).
国家自然科学基金(No. 31100066),国家高技术研究发展计划(863计划) (No. 2012AA02A703) 资助。
2015-05-13
http://www.cnki.net/kcms/detail/11.1998.Q.20150513.1534.004.html

