一种低温表达型T载体及其应用
何燕斌,齐亚坤,黄霖霆,周蓉,邵蔚蓝
一种低温表达型T载体及其应用
何燕斌1,齐亚坤1,黄霖霆1,周蓉1,邵蔚蓝2
1 南京师范大学生命科学学院,江苏南京 210046 2 江苏大学环境与安全工程学院,江苏镇江 212000

何燕斌, 齐亚坤, 黄霖霆, 等. 一种低温表达型T载体及其应用. 生物工程学报, 2015, 31(12): 1773–1783.He YB, Qi YK, Huang LT, et al. An expression T-vector and its application at low temperatures. Chin J Biotech, 2015, 31(12): 1773–1783.
在现代生物学和生物技术研究中,通过基因重组表达获得目标蛋白已成为常规技术。因其培养简单、操作方便、遗传背景清楚、克隆表达技术成熟,大肠杆菌表达系统通常是人们表达重组蛋白的首选。但是在常规温度下进行基因的重组表达,动、植物和常温微生物的基因产物多数在数小时内变性沉淀;还有一些重组蛋白对宿主具有细胞毒性,难以得到重组表达。因此,我们构建了1种新型T载体——pEXC-T;它结合TA克隆技术和低温诱导表达功能,具有表达水平高、操作方便、目标蛋白得到分子伴侣保护和低温保存等特点。采用构建和优化的pEXC载体,P1抗原蛋白、溶血素PLO两种不稳定性蛋白在pEXC中都实现了高效的可溶性表达。低温表达系统pEXC的建立和发展为蛋白质的结构与功能的研究,以及抗原和药用蛋白的制备提供了便利的途径。
大肠杆菌,表达系统,低温诱导,可溶性蛋白
大肠杆菌表达系统由表达载体和相应的宿主细胞两部分构成,是发展最早、应用最广、最容易操作的基因高效表达系统。在大肠杆菌表达系统中,表达载体通常运用可调控型启动子控制外源基因的表达;这些启动子的类型对降低被表达的目标蛋白对细胞生长的抑制、减少细胞蛋白酶对目标蛋白的降解,以及目标蛋白的产量和可溶性等起着至关重要的作用。研究和应用最多的启动子包括lac、trp、tac、gal、ara和T7启动子。T7系列载体因表达水平高而广为应用,但是很多基因在T7系列载体中表达时出现包涵体或细胞毒性等问题[1]。近年发展起来的启动子主要包括由Sigma 32 (σ32) 调控的热激诱导型启动子Hsh,以及通过冷激诱导表达的冷激蛋白基因的启动子。研究发现,快速降温 (如从37 ℃降至10 ℃) 可诱导一系列蛋白如CspA等蛋白的表达水平瞬时提高[2-3]。因此,基因的启动子被应用于表达载体 (如pCold等),在低温下控制基因的重组表达[4]。由于细胞中的分子伴侣的参与,冷激蛋白启动子调控的低温基因表达不同于其他启动子调控下的低温表达[5-6];很多T7系列载体不能表达的基因,能够在冷激系统中得到高水平表达或可溶性表达[7-8]。
TA克隆技术是一种快速方便的基因克隆方法,能够在不受酶切位点限制的条件下进行粘性末端连接:DNA聚合酶扩增产生的PCR产物的双链两端各带有1个3′端悬挂的A (腺苷酸),与末端带有T (胸腺核苷酸) 的载体进行直接连接[9]。但是,市售T载体只能作为中间载体,缺少基因表达元件,基因克隆成功后还得进行亚克隆,才能在表达载体中进行表达。最近报道的一种表达型的T载体[10],pETG,能够在目的基因的克隆表达时结合了TA克隆技术。但是由于它来源于T7系列载体pET,多数蛋白的高效活性表达同样会遇到诱导剂、细胞毒性、产生包涵体等方面的问题。同时,pET系列载体比较大,不利于对目标基因进行原位诱变改造和筛选。因此,我们结合大肠杆菌冷激蛋白启动子受低温诱导实现高效表达的优势和TA克隆技术的优势,首次设计并构建一种兼有TA克隆、冷激诱导表达和低温下目标基因活性筛选等多种功能的高效T载体,pEXC-T。外源基因通过TA克隆技术连接到线性载体pEXC-T上产生环状表达质粒,转化后可以使目标基因在新型冷激表达载体pEXC中得到高效表达。
1 材料与方法
1.1 菌株和质粒
大肠杆菌BL21、DH10B、JM109用作基因克隆和表达的宿主;培养在LB培养基中,转化子的选择用含有氯霉素 (25 μg/mL) 的LB培养基,重组酶最高产量测定用含有氯霉素 (25 μg/mL) 的TB培养基,配方见文献[11]。电转化用SOC培养基孵育。质粒pHsh由仙奕生物科技 (南京) 有限公司提供。
1.2 基因操作
大肠杆菌基因组DNA提取,DNA的内切酶水解和连接,DNA片段的分离,感受态细胞的制备以及基因的高效电转化均参考文献[11]。质粒的制备,从琼脂糖凝胶回收DNA等操作按照Qiagen试剂盒使用指南进行。限制性内切酶、T4 DNA连接酶和DNA聚合酶购自宝生物工程公司;质粒抽提试剂盒、割胶回收试剂盒购自Qiagen公司;ONPG购自Omega公司。文中载体构建及其应用所用的引物如表1所示。

表1 引物序列
1.3 pEXC-T载体的构建
质粒pEXC-T载体的构建以表达载体pHsh-Cm为基础[12-13]。首先我们设计了新型T载体的前体质粒。前体质粒中保留了pHsh-Cm中的氯霉素抗性基因和来源于pUC18/19的拷贝数>200的复制元件,消除了质粒复制元件中的1个限制性内切酶Ⅰ识别位点,删除Hsh启动子和多克隆位点,插入了1个大肠杆菌启动子及其表达元件,并且在启动子和终止子之间插入两个Ⅰ识别位点。前体质粒为环状,转化大肠杆菌后在细胞中可以得到大量复制;用Ⅰ酶对前体质粒进行切割后,即可获得本发明的T载体,pEXC-T。
1.3.1 消除目标载体上的Ⅰ酶切位点
对pHsh-Cm进行定点诱变的位点为GTATCCGGTAAG;反向PCR所用引物为ori1和ori2 (表1)。以pHsh-Cm为模板进行反向PCR,然后用T4 DNA连接酶对所扩增的线性DNA进行环化。
1.3.2 引入启动子
环状质粒扩增方法是本研究组发明的“变性-退火-延伸-连接”四步PCR循环,用于从环状质粒扩增出环状质粒 (PPCP) 的新方法[14]。本实验通过PPCP方法将pHsh-Cm载体中Hsh启动子部分替换成基因的冷激启动子。操作步骤如下:1) 设计一对引物 (引物1、2,序列见表1),以pHsh-Cm为模板,反向PCR将Hsh启动子部分丢失得到线性化的载体。2) 设计另一对引物 (引物3、4序列见表1),以大肠杆菌基因组为模板扩增得到两端带有载体同源片段的冷激启动子片段。3) 用T4多聚核苷酸激酶对步骤1)、2) 中获得的PCR产物进行5′端磷酸化,将它们以1︰1混合,再进行“变性-退火-延伸-连接”四步PCR循环,用本课题组特有的耐热性DNA连接酶进行扩增连接。4) 将步骤3) 中的产物直接电转化入宿主中扩增,得到含有冷激启动子而去掉Hsh启动子的质粒。
1.3.3 引入Ⅰ酶切位点
设计引物5、6 (序列见表1),同样通过定向克隆技术在启动子后面引入2个Ⅰ酶切位点,从而形成序列promoter-NF-Ⅰ- gene-Ⅰ-His-Tag,分析和验证多个转化子中质粒的序列,选择序列正确的质粒用作pEXC-T的前体质粒。
1.3.4 制备pEXC-T载体
将上述前体质粒导入大肠杆菌细胞,培养细胞后从中提取纯化前体质粒;用Ⅰ切割前体质粒,通过琼脂糖凝胶电泳分离和回收的 2 422 bp线性化DNA片段,即为具有低温冷激诱导表达元件、3′末端带T的pEXC-T载体。用TE缓冲液溶解T载体,于–20 ℃保存。
1.4 以为报告基因测定冷激诱导表达条件
1.4.1 重组质粒pEXC-的构建
pEXC-T载体是本身携带有起始密码子ATG的成熟T载体;所以,用具有3′末端转移酶活性的DNA聚合酶扩增目标基因,拟克隆表达的目标基因可以是去除翻译起始密码子的开放阅读框,即始于5′端的起始密码子ATG之后的第2个密码子,直至终止密码子TAA、TAG或TGA。如果要在3′端融合组氨酸标签 (His-Tag) 以便后期纯化,有必要去除终止密码子,但需要考虑3′端克隆时引入的3′端悬挂的A所带来的移码突变。扩增得到的片段与pEXC-T进行连接后,转化感受态细胞,将转化菌液涂布于带有氯霉素抗性的LB平板上,37 ℃培养15–20 h,挑选平板上的转化子,进行质粒分离纯化和序列测定分析。
根据大肠杆菌的β-D-半乳糖苷酶 (EC3.2.1.23) 的编码基因(GenBank登录号为945006) 序列设计引物-fw、-rv。以大肠杆菌基因组为模板扩增得到的3′端带有A的基因片段,PCR参数:95 ℃5 min,加DNA聚合酶 (TaKaRa公司);98 ℃ 30 s,56 ℃ 30 s,72 ℃ 3 min,循环30次;72 ℃保温10 min。PCR扩增结束后,电泳检测并将PCR目标条带割胶回收纯化,以适量比例与pEXC-T载体直接连接。连接液转化大肠杆菌DH10B (基因缺陷型菌株) 感受态细胞后,经抗生素筛选、酶切鉴定、PCR鉴定筛选出含有基因的阳性克隆。
1.4.2 酶活性测定
β-D-半乳糖苷酶活性测定采用分光光度法,以邻硝基苯β-D-半乳吡喃糖苷 (ONPG) 作为β-半乳糖苷酶的底物,测定反应体系中黄色产物邻硝基酚 (ONP) 的生成量。反应体系为1 mL,内含0.1 mol/L PBS (pH 7.0),1 mmol/L MgSO4,5 mmol/L DTT,4 mg/mL ONPG (底物过量),37 ℃恒温水浴预热10 min后,加入100 µL酶液,空白对照中不加酶,补加等体积的缓冲液,37 ℃恒温反应10 min后,立即加入0.5 mL 1 mol/L Na2CO3终止反应,用分光光度计在420 nm处测定其吸收值,计算相对于空白对照的差异值。
β-D-半乳糖苷酶酶活单位定义:每分钟催化邻硝基苯β-D-半乳糖苷 (ONPG) 水解生成1 µmol邻硝基酚所需要的酶量定义为一个活性单位。用ONP作标准曲线,蛋白质浓度用Brandford法测定。
1.5 pEXC表达系统表达条件的优化
以β-D-半乳糖苷酶基因为报告基因,将克隆构建的质粒pEXC-电转化至大肠杆菌DH10B宿主菌中,并研究冷激系统诱导表达的温度、冷激诱导的时机以及诱导后的表达时间长短对外源蛋白表达的影响,通过检测β-D-半乳糖苷酶的活性来探索最佳的表达条件。
在pEXC中表达的最佳诱导温度的测定:当培养基为LB时,在重组细胞的细胞密度为600为1.8时开始,在10–25 ℃等不同的温度条件下瞬间降温冷激诱导24 h,记录细胞的密度并离心收获细胞,测定重组β-D-半乳糖苷酶的活性。最佳诱导时机的测定:当培养基为LB时,在重组细胞的细胞密度600值为0.4–2.4的范围内,分别选取不同菌龄的大肠杆菌在16 ℃下冷激诱导24 h,记录细胞的密度并离心收获细胞,测定重组β-D-半乳糖苷酶的活性。考察最佳诱导时间:当培养基为LB时,在重组细胞的细胞密度600值为1.8时开始诱导并计时,离心收获不同诱导时间的细胞并记录细胞的密度,测定重组β-D-半乳糖苷酶的活性。
1.6 pEXC表达系统的应用效果试验
1.6.1 抗原蛋白P1的高效表达与分离纯化
肺炎支原体是引起肺炎的主要致病菌[15-17],而P1蛋白是肺炎支原体决定黏附作用和毒力的关键蛋白[18-19]。根据基因 (GenBank登录号为CP002077) 序列设计引物pl-fw、pl-rv,扩增P1成熟肽的编码基因。以肺炎支原体基因组为模板扩增得到的3′端带有A的基因片段。PCR扩增结束后,电泳检测并将PCR目标条带割胶回收后,以适量比例与pEXC-T载体连接。连接液转化BL21感受态细胞后,经抗生素筛选、酶切鉴定、菌落PCR鉴定筛选出含有基因的阳性克隆。
质粒转化和诱导表达的方法:将构建好的重组质粒pEXC-转化到大肠杆菌BL21中,挑取单菌落接入含有氯霉素 (Cm) 的LB培养液;37 ℃培养至600为1.5–2.0时,迅速转入16 ℃水浴摇床,200 r/min继续培养16–24 h,离心收集菌体细胞。
重组蛋白的纯化:由于pEXC表达系统含有His-tag,所以可以采用Ni亲和层析纯化重组蛋白。将离心收集的细胞用50 mmol/L PBS缓冲液 (pH 7.4) 重悬,经高压细胞破碎仪破碎细胞,13 000 r/min离心15 min,离心上清液进行Ni柱亲和层析,经咪唑梯度洗脱,完成P1重组蛋白的纯化,重组蛋白达到电泳均一。
1.6.2 溶血素的高效表达试验
化脓隐秘杆菌属于革兰氏阳性短棒状杆菌,是牛、羊和猪等重要经济动物的条件性致病菌,寄生于上呼吸道和消化道的黏膜处,可引起多种器官和黏膜的化脓性感染,给养殖业造成严重的经济损失[20-21]。溶血素(Pyolysin,PLO) 是化脓隐秘杆菌的外毒素[22-23]。在常温的表达系统中,基因的表达伴随着包涵体的产生,难以进行可溶性表达[24-25]。根据基因(GenBank登录号为HQ637573) 序列设计引物-fw、-rv,以化脓隐秘杆菌基因组为模板,方法同上,筛选获得含有基因片段的表达质粒pEXC-。同样将质粒pEXC-转化大肠杆菌JM109,按pEXC表达载体使用方法表达获得目标蛋白。
2 结果
2.1 pEXC-T载体的构建
经过基因序列定点诱变消除了pHsh-Cm中原有的Ⅰ酶切位点,并以冷激启动子替换了热激启动子、加入两个背向定位的Ⅰ酶切位点,我们成功地获得环状质粒Pre-pEXC-T。在大肠杆菌中大量制备的Pre-pEXC-T经Ⅰ酶切,得到2.4 kb大小的片段为成熟的pEXC-T载体。pEXC-T的性能具有以下特征:结合了TA克隆技术、低温诱导表达功能、小型和超高拷贝优势的表达载体。新型冷激表达型T载体pEXC-T的结构特征包括:含有冷激启动子Csp promoter及其上下游调控区、N端融合短肽NF、C端有His-Tag、不依赖于ρ因子的GAAA终止子,以及来源于pUC19的超高拷贝复制元件 (图1A)。
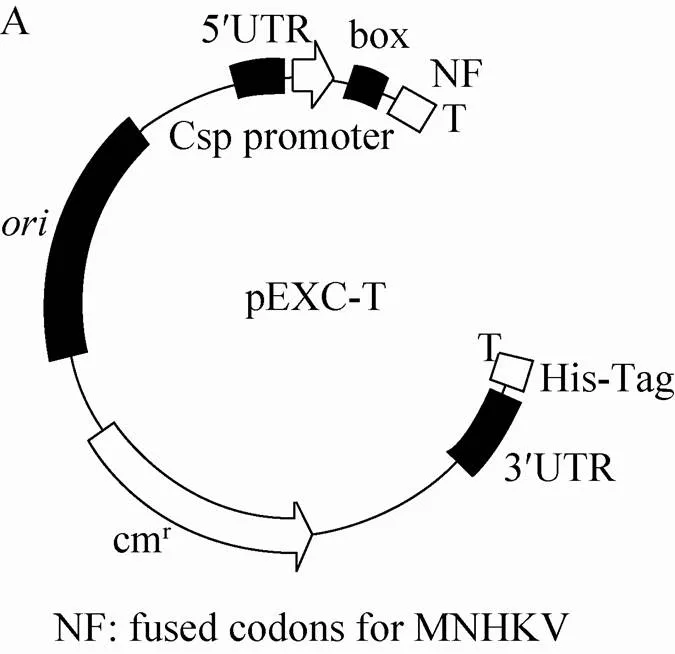
2.2 β-D-半乳糖苷酶表达质粒pEXC-的构建
以大肠杆菌的基因组DNA为模板进行β-D-半乳糖苷酶基因片段PCR扩增,获得约3 kb的单一电泳条带。将PCR产物与pEXC-T链接获得5.5 kb大小的重组质粒,序列测定验证后将其命名为pEXC-,其结构见图1B。
2.3 冷激诱导表达的条件优化
2.3.1 温度影响
以基因的表达水平考察最佳诱导温度。当培养基为LB时,在37 ℃重组细胞的细胞密度600值为1.8时开始,分别在16 ℃、20 ℃、25 ℃的水浴中快速降温,并在相应的温度下继续培养,其间定时取样测定重组β-D-半乳糖苷酶的活性。结果表明,在16 ℃时,β-D-半乳糖苷酶的比酶活 (每毫克总蛋白具有的活性单位) 达到最高;而20 ℃诱导表达时,虽然比酶活不如16 ℃,但是由于细胞生长较快,细胞密度较高,该酶的总活性Sum (每毫升菌液具有的活性单位) 更高。在温度达到25 ℃诱导表达时,比酶活和酶的产量均有明显下降 (图2)。
2.3.2 诱导时机影响
以pEXC表达基因为例来考察最佳诱导时机。当培养基为LB时,在37 ℃重组细胞的细胞密度600值为0.8–2.4的范围内,分别选取不同菌龄的大肠杆菌在16 ℃下冷激诱导24 h,收获细胞并测定β-D-半乳糖苷酶活性,结果表明不同时期的重组细胞在16 ℃下低温培养24 h后,重组细胞都已进入平台期且细胞密度大致相似,600值达到4.0左右。酶活性检测结果表明,β-D-半乳糖苷酶的比酶活随着诱导时细胞密度600从0.8增加至1.8,表达产生的β-D-半乳糖苷酶的比酶活显著增加;而600达到或超过2.2以后再进行诱导表达,β-D-半乳糖苷酶的活性开始下降 (图3)。因此最佳诱导时机在细胞密度600值为1.8左右。
2.3.3 冷激诱导时间影响
以pEXC表达基因为例来考察最佳诱导时间。当为LB培养基时,在重组细胞的细胞密度600值为1.8时开始诱导并计时,诱导不同时间后收获细胞并测定记录重组细胞密度和重组β-D-半乳糖苷酶的总酶活。结果表明:重组细胞在低温环境下,经过约4–5 h的调整期后进入对数生长期,而在低温培养28 h后进入平稳期,并维持继续培养至48 h,细胞密度变化不很明显;而冷激诱导后重组酶的总酶活也伴随着菌体细胞密度的不断增加而不断提高。在诱导后10 h内酶活性随着细胞密度快速上升,14 h后上升速度趋于缓慢,在24 h达到最高点,并维持至48 h基本不变 (图4)。因此,最适诱导时间在12–24 h范围内。但在具体运用时,诱导时间可以根据发酵规模、蛋白的稳定性等因素进行调整。
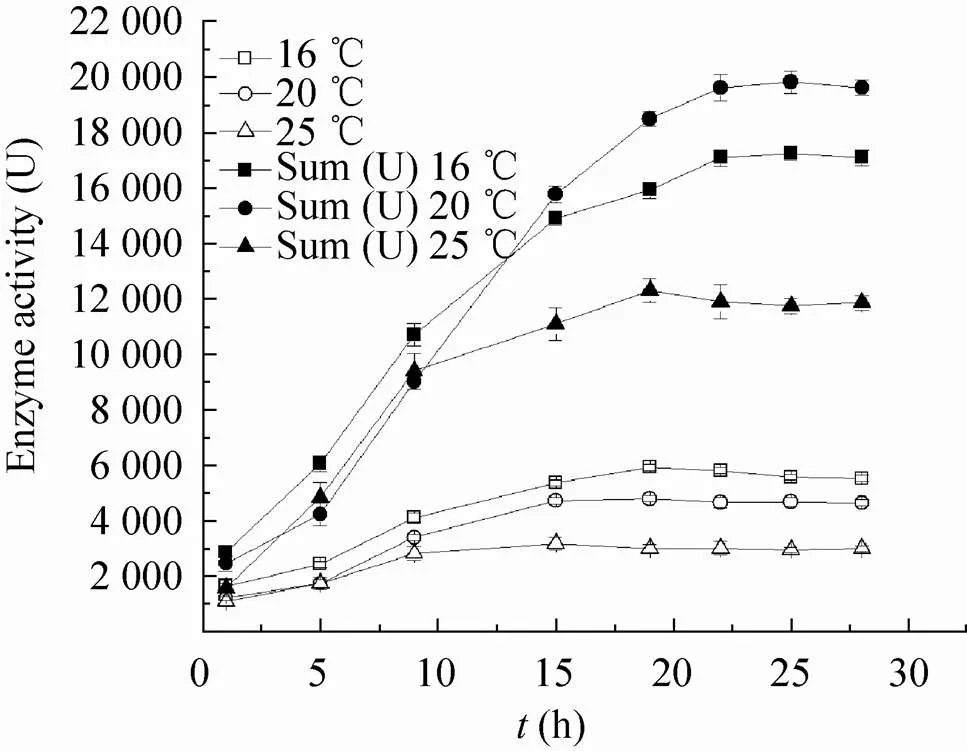
图2 不同温度诱导表达产生的β-D-半乳糖苷酶的活性

图3 诱导时机对lacZ基因表达的影响
综上所述,外源基因在pEXC载体中的最佳表达条件是 (LB培养基):菌体在37 ℃下生长,待长至细胞密度600值为1.5–1.8时迅速降温至16–20 ℃,并维持在低温继续培养12–24 h。
2.4 pEXC-T外源基因表达应用实例
分别以肺炎支原体基因组、化脓隐秘杆菌基因组DNA为模板进行和基因的扩增,将PCR产物连接至冷激表达型T载体pEXC-T,成功构建了表达质粒pEXC-和pEXC-。
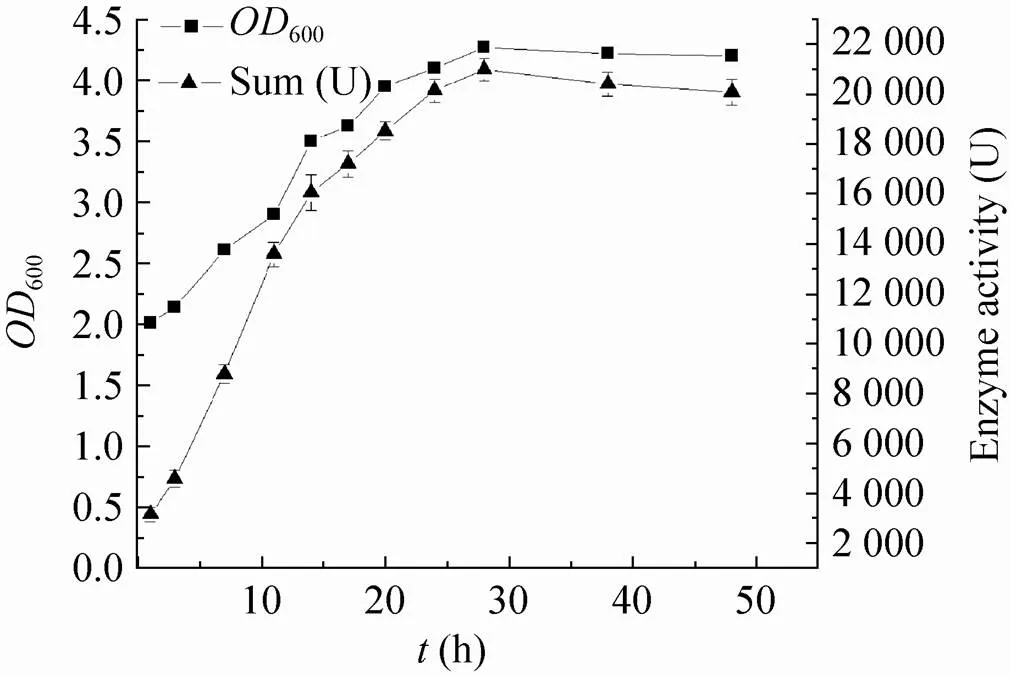
图4 诱导后培养时间对lacZ基因表达的影响
用质粒pEXC-转化BL21,pEXC-转化大肠杆菌JM109,以环化的载体Pre-pEXC-T作为对照,并按pEXC表达系统使用方法进行冷激诱导和低温表达,然后收集菌体细胞进行SDS-PAGE分析,从电泳图谱上可以看出,与对照相比较,含有重组质粒pEXC-的在分子质量26 kDa处有明显的蛋白表达条带;含有pEXC-的在分子质量66 kDa处有明显的蛋白表达条带 (图5)。由此可知,、基因通过冷激表达系统pEXC在中都实现了可溶性表达。通过高压破碎将冷激诱导表达的pEXC-菌体细胞裂解,离心后取上清液进行Ni柱亲和层析,SDS-PAGE检测结果表明,经纯化获得电泳均一的重组蛋白P1。
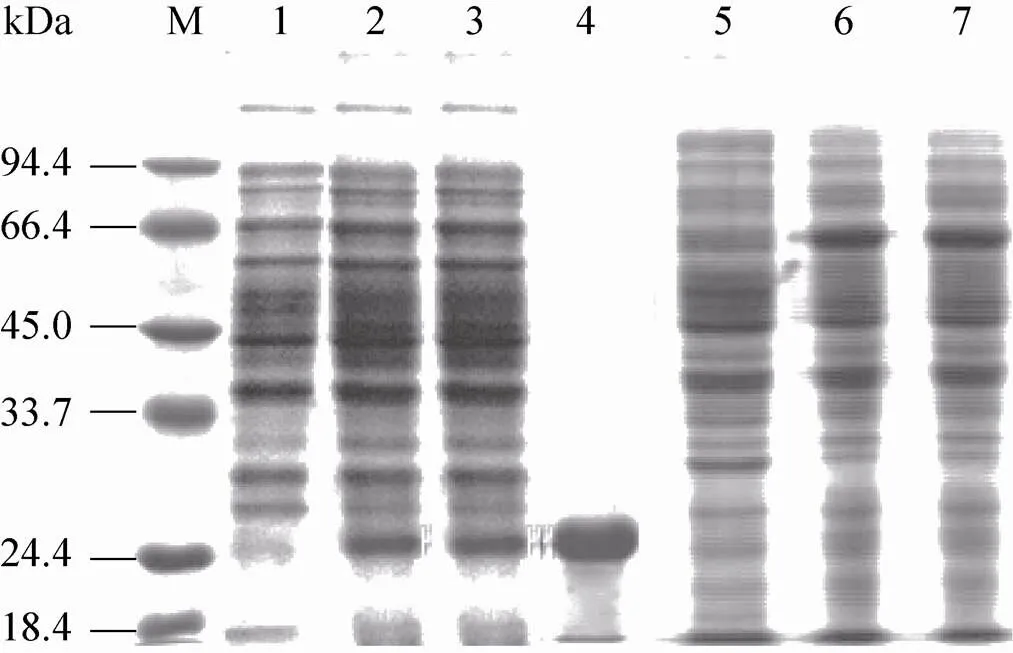
图5 蛋白质P1和PLO的基因表达及P1纯化的SDS-PAGE图谱
3 讨论
动植物和常温微生物的基因所编码的蛋白质不够稳定,多数蛋白在异源表达后的数小时内变性。同时,许多蛋白对重组细胞的生长具有抑制或毒害作用,因而难以得到重组表达。因此,构建低温的外源基因表达系统,高效率地表达一些不稳定性外源蛋白,一直是人们研究的热点。大肠杆菌的最适生长温度是37 ℃,低温环境 (10–20 ℃) 下大肠杆菌的生长速度缓慢,细胞内多数基因的表达水平下降[27]。但是细胞中有一组基因对冷激过程发生应答反应,它们受冷激诱导表达产生一类冷激蛋白 (Cold shock proteins) 包括CspA、CspB、CspG和CsdA等[2]。其中,基因表达水平最高:在温度从37 ℃降至10 ℃后的1.5 h内可达到细胞总蛋白的13%[3]。
基因的启动子是强启动子[26],我们利用该启动子以及上游调控序列替换pHsh载体的Hsh启动子,结合两个背向的Ⅰ酶切位点构建了低温表达型T载体,pEXC-T。与T7或lac启动子相比,pEXC-T具有以下特点:首先pEXC中的基因表达不需要化学品诱导,并且外源基因可在低温下持续表达,表达产物受到分子伴侣的保护,克服了T7启动子和其他强启动子带来的外源蛋白构象改变易产生包涵体的不足。与市场上现有的冷激表达载体pCold系统比较,pEXC-T具有以下优势:1) 提供了1种冷激诱导型T载体,能够简化操作、提高连接率、一步完成基因克隆和表达质粒的构建,并且能够通过基因产物活性进行基因文库的构建和筛选;2) 质粒小,有利于通过反向PCR技术对目标基因进行原位诱变和修饰;3) 利用了pUC19载体中的高拷贝数的复制元件,能够在冷激启动子介导的高效表达的基础上,通过基因剂量进一步提高表达水平[13]。
大肠杆菌的冷激蛋白是在冷激启动后的1–2 h内瞬时表达,产生RNA、DNA或者蛋白质等生物大分子的分子伴侣后就恢复正常的生命活动[26-29]。在pEXC表达系统中,报告基因的表达在低温诱导后的10 h内呈现递增的趋势,当达到14 h后增速趋缓。在重组蛋白稳定性较好的前提下,长时间的低温表达更有利于重组蛋白的积累,并有利于降低生物活性蛋白的细胞毒性。诱导表达的时机和诱导的温度对基因表达水平有较大的影响,但是表达系统pEXC对于温度的控制范围和诱导时间都较为宽泛,给实际应用带来了方便。
TA克隆技术利用DNA聚合酶在PCR扩增过程中会在DNA片段的两个3′端加上A,可以直接与两端带有T的载体DNA连接。这不仅缩减了限制性内切酶的选择和操作步骤,而且可以避免目标基因的相互连接和载体的自身环化,从而大大提高基因克隆的成功率。但是市场上销售的T载体只用于PCR克隆;基因经过克隆和序列测定后必须再次克隆到表达载体中才可能获得基因产物的表达。新型T载体pEXC-T将冷激诱导表达特性与TA克隆技术结合起来,为研究工作提供了很大方便。
肺炎支原体P1蛋白和化脓隐秘杆菌中溶血素PLO都是易于变性的抗原性蛋白,通常在大肠杆菌中表达后很快失活,然而,在低温环境下,一方面由于温度较低,对于常温蛋白的稳定性具有显著作用;另一方面,冷激诱导产生的一些冷休克蛋白,如CspA、CspB和CspG等对目标蛋白具有一定的保护作用。此外,低温环境也可以抑制宿主蛋白酶的活性,从而减少目标蛋白的降解。因此,低温环境下,重组蛋白可以得到有效表达和生物活性的保存。在用pEXC-T对基因进行TA克隆的同时,目标基因得到了有效的表达,可以通过基因产物的活性进行基因文库的构建,尤其是cDNA文库的构建和活性筛选。因此,pEXC-T的构建和基因表达诱导条件的优化为稳定性差的酶、抗原或生物活性蛋白的基因克隆和重组表达提供了一个有效途径,为低温酶的工业生产和科学研究打下基础。通过冷激调控蛋白的表达,无需添加化学类诱导剂,避免试剂对细胞的毒性作用,是适用于药蛋白的基因表达的技术路径。
[1] Makrides SC. Strategies for achieving high-level expression of genes in. Microbiol Mol Biol Rev, 1996, 60(3): 512–538.
[2] Graumann P, Marahiel MA. Some like it cold: response of microorganisms to cold shock. Arch Microbiol, 1996, 166(5): 293–300.
[3] Wouters JA, Rombouts FM, de Vos WM, el al. Cold shock proteins and low-temperature response ofCNRZ302. Appl Environ Microbiol, 1999, 65(10): 4436–4442.
[4] Qing GL, Ma LC, Khorchid A, et al. Cold-shock induced high-yield protein production in. Nat Biotechnol, 2004, 22(7): 877–882.
[5] Graumann P, Marahiel MA. Effects of heterologous expression of CspB, the major cold shock protein of, on protein synthesis in. Mol Gen Genet, 1997, 253(6): 745–752.
[6] Feller G, Zekhnini Z, Lamotte-Brasseur J, et al. Enzymes from cold-adapted microorganisms-the class C beta-lactamase from the antarctic psychrophileA5. Eur J Biochem, 1997, 244(1): 186–191.
[7] Gerday C, Aittaleb M, Bentahir M, et al. Cold-adapted enzymes: from fundamentals to biotechnology. Trends Biotechnol, 2000, 18(3): 103–107.
[8] Russell NJ. Molecular adaptations in psychrophilic bacteria: potential for biotechnological applications//Antranikian G. Biotechnology of Extremophiles. Heidelberg: Springer, 1998, 61: 1–21.
[9] Holton TA, Graham MW. A simple and efficient method for direct cloning of PCR products using ddT-tailed vectors. Nucl Acids Res, 1991, 19(5): 1156.
[10] Zhong X, Zhai C, Chen L, et al. Construction of directional T vector for gene cloning and expression. Chin J Biotech, 2013, 29(4): 510–519 (in Chinese).钟星, 翟超, 陈亮, 等. 构建定向T载体用于基因克隆和表达. 生物工程学报, 2013, 29(4): 510–519.
[11] Wrba A, Jaenicke R, Huber R, et al. Lactate dehydrogenase from the extreme thermophile. Eur J Biochem, 1990, 188(1): 195–201.
[12] Wu HW, Pei JJ, Jiang Y, et al. pHsh vectors, a novel expression system offor the large-scale production of recombinant enzymes. Biotechnol Lett, 2010, 32(6): 795–801.
[13] Jiang YY, He JR, Wang WW, et al. The approach to high production of recombinant protein via pHsh vectors forMicrobiol China, 2012, 39(3): 394–400 (in Chinese).蒋钰瑶, 何嘉荣, 王未未, 等. 新型大肠杆菌高效表达载体pHsh的构建与应用. 微生物学通报, 2012, 39(3): 394–400.
[14] Le YL, Chen HY, Zagursky R, et al. Thermostable DNA ligase-mediated PCR production of circular plasmid (PPCP) and its application in directed evolution viaerror-prone PCR. DNA Res, 2013, 20(4): 375–382.
[15] Klement E, Talkington DF, Wasserzug O, et al. Identification of risk factors for infection in an outbreak ofrespiratory tract disease. Clin Infect Dis, 2006, 43(10): 1239–1245.
[16] Waites KB, Talkington DF.and its role as a human pathogen. Clin Microbiol Rev, 2004, 17(4): 697–728.
[17] Waring AL, Halse TA, Csiza CK, et al. Development of a genomics-based PCR assay for detection ofin a large outbreak in New York State. J Clin Microbiol, 2001, 39(4): 1385–1390.
[18] Pauli BU, Knudson W. Tumor invasion: a consequence of destructive and compositional matrix alterations. Hum Pathol, 1988, 19(6): 628–639.
[19] Himmelreich R, Hilbert H, Plagens H, et al. Complete sequence analysis of the genome of the bacterium. Nucl Acids Res, 1996, 24(22): 4420–4449.
[20] Jost BH, Post KW, Songer JG, et al. Isolation offrom the porcine gastric mucosa. Vet Res Commun, 2002, 26(6): 419–425.
[21] He X, Yuan J, Wang H, et al.expression of pneumolysin and identification of its biological activity. Acta Acad Med Mil Tert, 2011, 33(3): 237–240 (in Chinese).贺潇, 袁军, 王虹, 等. 肺炎链球菌溶血素的体外表达及活性鉴定. 第三军医大学学报, 2011, 33(3): 237–240.
[22] Jost BH, Songer JG, Billington SJ. Identification of a secondneuraminidase and involvement of neuraminidase activity in host cell adhesion. Infect Immun, 2002, 70(3): 1106–1112.
[23] Guo WJ, Zhao JC, Liu YC, et al. The research progress of purulent secret coli virulence factors. Chin J Vet Med, 2010, 46(1): 52–53 (in Chinese).郭文洁, 赵敬翠, 刘耀川, 等. 化脓隐秘杆菌毒力因子的研究进展. 中国兽医杂志, 2010, 46(1): 52–53.
[24] Jost BH, Trinh HT, Songer JG, et al. Immunization with genetic toxoids of thecholesteroldependent cytolysin, pyolysin, protects mice against infection. Infect Immun, 2003, 71(5): 2966–2969.
[25] Meng XL, Mu XL, Liu XD, et al. Expression ofpyolysin inand the hemolytic activity identification. Chin J Prev Vet Med, 2013, 35(6): 477–480 (in Chinese).孟祥莉, 母晓宇, 刘晓丹, 等. 化脓隐秘杆菌溶血素蛋白的原核表达及其溶血活性鉴定. 中国预防兽医学报, 2013, 35(6): 477–480.
[26] Barria C, Malecki M, Arraiano CM, et al. Bacterial adaptation to cold. Microbiology, 2013, 159(12): 2437–2443.
[27] Giangrossi M, Exley RM, Le HF, et al. Differentlocalization of theproteins CspD and CspA. FEMS Microbiol Lett, 2001, 202(2): 171–176.
[28] Fang L, Jiang W, Bae W, et al. Promoter-independent cold-shock induction ofand its derepression at 37 ℃ by mRNA stabilization. Mol Microbiol, 1997, 23(2): 355–364.
[29] Diwa A, Bricker AL, Jain C, et al. An evolutionarily conserved RNA stem-loop functions as a sensor that directs feedback regulation of RNase E gene expression. Genes Dev, 2000, 14(10): 1249–1260.
(本文责编 郝丽芳)
An expression T-vector and its application at low temperatures
Yanbin He1, Yakun Qi1, Linting Huang1, Rong Zhou1, and Weilan Shao2
1 Department of Life Sciences, Nanjing Normal University, Nanjing 210046, Jiangsu, China2 School of Environment and Safety Engineering, Jiangsu University, Zhenjiang 212000, Jiangsu, China
In modern biology and biotechnology research, recombinant gene expression has been the most popular method to obtain the target protein. In recent years, many foreign genes have been efficiently expressed in. However, proteins encoded by animal, plant or mesophilic microbial genes often lose activities or become denatured within a few hours at regular growth temperatures for; some other target proteins are toxic to host cells and therefore difficult to be over-expressed. The new T-vector, pEXC-T, was constructed by combining TA cloning and cold-shock induction to obtain high expression levels with low costs. This paper reports the construction of pEXC-T and optimization of induction techniques for gene expression. Two instable proteins were tested and successfully expressed in soluble form by using pEXC vector. The development of pEXC-T offers a convenient technique for the preparations of recombinant proteins to be used in structure/function studies, or as diagnostic markers and medicinal proteins.
, expression system, cold-shock induction,soluble protein
January 20, 2015; Accepted:March 13, 2015
Weilan Shao. Tel: +86-25-85891836; E-mail: weilanshao@ujs.edu.cn
10.13345/j.cjb.150034
Supported by: National Natural Science Foundation of China (No. 31170027).
国家自然科学基金 (No. 31170027) 资助。
2015-10-29
http://www.cnki.net/kcms/detail/11.1998.Q.20151029.1606.001.html

