水母雪莲黄酮合成酶FNSII基因克隆及其在3种细胞系中的表达
王冰洁,李厚华,王亚杰,2,高艳,付婉艺,魏新翠
水母雪莲黄酮合成酶基因克隆及其在3种细胞系中的表达
王冰洁1,李厚华1,王亚杰1,2,高艳1,付婉艺3,魏新翠1
1 西北农林科技大学风景园林艺术学院,陕西杨凌 712100 2 宝鸡海升现代农业有限公司,陕西宝鸡 721100 3 浙江大学农业与生物技术学院,浙江杭州 310000

王冰洁, 李厚华, 王亚杰, 等. 水母雪莲黄酮合成酶FNSII基因克隆及其在3种细胞系中的表达. 生物工程学报, 2015, 31(12): 1720–1727.Wang BJ, Li HH, Wang YJ, et al. Cloning of flavone synthase(FNSII)gene and expression in three cell lines of Saussurea medusa. Chin J Biotech, 2015, 31(12): 1720–1727.
水母雪莲是中国传统珍稀药材,其主要活性成分之一木犀草素具有预防和治疗癌症的功效。以水母雪莲绿色细胞系为试材,采用RT-PCR和RACE-PCR方法获得1个水母雪莲基因cDNA全长,命名为(GenBank登录号为KF170286)。序列分析结果表明:全长1 710 bp,包含34 bp的5ʹ非编码区、125 bp的3ʹ非编码区和1个长度为1 551 bp编码516个氨基酸的开放阅读框。氨基酸序列分析表明SmFNSII属于细胞色素P450 CYP93B亚家族单氧化酶。序列比对和系统进化分析表明,SmFNSII氨基酸序列与同科植物毛山柳菊的亲缘关系最近,相似性达87%以上。实时荧光定量PCR分析表明,在白色、绿色和红色细胞系均有表达,红色系中的表达量最高,白色系中表达量最低,此结果与高效液相色谱分析3种颜色细胞系中木犀草素含量结果一致。构建pET-原核表达重组质粒,并在大肠杆菌中诱导表达,诱导蛋白大小与预期一致。通过筛选基因表达水平高、高产木犀草素的水母雪莲细胞系和植株,可培育抗炎抗癌活性较高、具有高保健功能的雪莲生药新品种。
水母雪莲,黄酮合成酶FNSII,基因克隆,表达分析,原核表达
水母雪莲是中国传统珍稀药材,有着悠久的药用历史,在藏医学文献《月王药诊》和《四部医典》上都有记载[1]。在传统医学中,水母雪莲被用来治疗雪盲、牙痛、风湿性关节炎、阳萎、月经不调、红崩、白带等症[2]。而现代医学对雪莲的生理活性有效成分的分析也表明其具有消炎镇痛、抗辐射、抗癌、抗疲劳、清除自由基、延缓衰老、增强机体免疫和降血压血脂等诸多重要功效[3-7]。雪莲中的主要活性成分为黄酮类及其苷类物质、雪莲多糖和生物碱,又以黄酮类为主[7-9]。现代医学表明,黄酮中的木犀草素具有预防和治疗癌症的功效[8-9],以及很好的体外体内抗氧化和抗炎活性[10],而雪莲中黄酮及其衍生物高车前素和金合欢素对治疗腹水型肝癌、消除自由基、抗疲劳有良好效果[11-12]。黄酮在生物体内的合成,主要由黄烷酮经黄酮合成酶作用生成。研究发现,在双子叶植物中存在两种不同的黄酮合成酶 (FNS):FNSI和FNSII。FNSI是一种可溶性的Fe2+/2-酮戊二酸依赖型双加氧酶 (DOX),仅在一些伞形科植物中存在,FNSI直接在黄烷酮的C2和C3之间引入双键,进而合成黄酮[13-14]。而FNSII 是氧和NADPH依赖型、与膜结合的单加氧酶(MOX),属于细胞色素P450家族,存在于其他大多数有黄酮积累的双子叶植物中[15]。克隆水母雪莲类黄酮代谢途径中的黄酮合成酶基因,对从分子生物水平探索水母雪莲类黄酮生物代谢,以及通过分子辅助育种方法培育高保健功能的新品种提供理论支持。
目前野生雪莲生存环境极度恶劣,生长极其缓慢,同时近年来遭到严重采挖,现有的野生雪莲资源已近枯竭[16-18]。因此,寻找野生雪莲的替代品,满足市场需求成了一个亟待解决的课题,近年来国内在雪莲次生代谢调控方面的研究取得了一定的成果,但仍不能满足工业化生产的要求。因此,从分子生物学水平研究黄酮生物合成,筛选高产黄酮细胞系和植株对雪莲生药替代品研究具有极大的推动作用,同时对于保护野生资源和生物多样性具有重要意义。
1 材料与方法
1.1 材料
水母雪莲白色、绿色细胞系由中国科学院植物研究所赵德修研究员惠赠,保存于M1培养基 (MS+2 mg/L NAA+0.5 mg/L 6-BA+琼脂7 g/L+蔗糖30 g/L,pH 5.8) 中,其培养条件为光强45–55 μmol/m2·s、光周期16/8 h、温度(22±1) ℃,每30 d 继代一次[18]。水母雪莲红色细胞系为本研究组在M2培养基 (MS+3.5 mg/L NAA+0.5 mg/L 6-BA+0.7%琼脂+5%蔗糖,pH 5.8) 和光强90−100 μmol/m2·s、光周期16/8 h、温度(10±1) ℃的条件下诱导得到部分红色愈伤组织基础上,通过多次挑选继代获得,保存于M1培养基中[4]。取培养12 d的3种颜色细胞系,液氮速冻后保存于–70 ℃超低温冰箱备用。
1.2 总RNA提取及反转录
取50 mg新鲜的水母雪莲绿色细胞系,按照E.Z.N.A. Total RNA Kit (OMEGA) 操作步骤提取水母雪莲总RNA。
以总RNA为模板,参照PrimeScript®RT reagent Kit (Perfect Real Time) (TaKaRa) 说明书进行反转录合成cDNA第一链,–20 ℃保存备用。
1.3全长基因克隆
根据NCBI中已登录的基因核苷酸序列及其蛋白质序列,设计引物FNSf和FNSr (表1)。凝胶回收与预期片段大小一致的泳带,进行序列测定。根据所得的中间序列设计特异性引物FNSf2,按照SMARTTMRACE cDNA Amplification Kit说明书进行5ʹ-和3ʹ-RACE PCR扩增。将中间序列以及两端序列进行拼接,通过NCBI 数据库ORF Finder工具找出该基因的ORF,设计引物FNSqf和FNSqr进行编码区验证扩增。扩增产物电泳检测后纯化回收,并连接至pMD-19T载体 (TaKaRa),转化大肠杆菌TOP10,筛选阳性克隆测序。
1.4 生物信息学分析
根据测序得到的水母雪莲基因全长cDNA序列,对核苷酸序列和氨基酸序列进行同源性比对、氨基酸多序列比对和系统进化树构建,分析编码蛋白的二级结构,预测蛋白的跨膜结构和功能域,分析编码蛋白的翻译后修饰位点。

表1 基因克隆、表达分析及原核表达引物
Note: the underlined words mean the restriction enzyme cutting sites of primers.
1.5 实时荧光定量表达分析
取培养12 d的水母雪莲3种颜色细胞系样品各0.1 g,使用E.Z.N.A Plant RNA Kit (OMEGA) 提取RNA。取1 μg RNA使用M-MLV Reverse transcriptase (TaKaRa) 进行反转录。实时定量PCR采用SYBR Green法在IQTM5多重实时荧光定量PCR仪 (Bio-Rad) 上进行,以基因为内参,采用2–ΔΔCT法进行数据分析,每个样品重复3次。所测相关基因引物见表1。
1.6 高效液相色谱分析
取培养12 d的水母雪莲3种颜色细胞系样品各0.25 g,加入1.5 mL甲醇,超声30 min提取总黄酮。4 ℃、12 000×离心10 min。取上清液,经0.22 μm有机滤膜过滤后,待用。使用日立L-2000色谱仪检测,程序设置如下:检测器为L-2455型二极管阵列检测器,检测波长为200−700 nm,C18柱 (Hitachi,Japan,250 mm× 4.6 mm,5 µm),柱温40 ℃,进样量为10 µL,流速0.50 mL/min。流动相参数:A:0.04%的甲酸水溶液,B:色谱级乙腈。采用梯度洗脱,洗脱程序为:0−40 min,A 95%−0,B 5%−100%;40−60 min,A 0,B 100%[19]。
1.7基因原核表达分析
使用分别被引入酶切位点RⅠ和Ⅰ的引物FNSqfE和FNSqrS扩增基因,退火温度为65 ℃。将PCR产物经RⅠ和Ⅰ酶切后插入经同样酶切的表达质粒载体pET-28a (+),构建成原核表达载体pET-,将重组质粒转化进入大肠杆菌BL21 (DE3) 感受态细胞,挑取阳性克隆子,并提取质粒进行酶切及测序鉴定。
基因的诱导表达参考刘长英等的原核表达方法,略有改动[20]。将阳性大肠杆菌BL21 (DE3) 克隆接种于5 mL LB液体培养基 (含50 g/L卡那霉素),37 ℃培养过夜;然后按体积比1∶100 接种于30 mL LB液体培养基 (含50 g/L卡那霉素),37 ℃培养至600值在0.6−0.8之间;加入IPTG至终浓度为1 mmol/L,在30 ℃下培养。分别于0、2、4、6、8 h收集2 mL菌液,将菌体处理后,进行SDS-PAGE分析。
2 结果与分析
2.1基因全长序列的获得
以水母雪莲绿色细胞系的cDNA为模板,利用引物FNSf和FNSr进行PCR扩增,得到471 bp的片段。Blast分析发现,该核苷酸序列与毛山柳菊基因的同源性高达87%,与非洲菊、翠菊的同源性为82%,初步推断其为水母雪莲基因的同源片段。
按照RACE试剂盒说明书,分别以特异性引物FNSf2和FNSr为引物,合成3ʹ-和5ʹ-RACE cDNA第一链,然后进行末端序列扩增。将产物进行凝胶电泳分析,测序结果表明,3ʹ端序列为508 bp,5ʹ端为689 bp。设计引物FNSqf和FNSqr进行ORF扩增验证,经测序表明其序列为1 551 bp。将RT-PCR及RACE-PCR扩增片段拼接,最终获得长度为1 710 bp的水母雪莲基因cDNA全长序列,命名为(GenBank登录号为KF170286)。利用NCBI提供的ORF Finder进行分析发现,该cDNA全长包含有1个1 551 bp的开放读码框和1个poly (A)尾巴,5ʹ非翻译区长34 bp,3ʹ非翻译区长125 bp,编码516个氨基酸。
2.2基因生物信息学分析
预测基因编码蛋白的相对分子量为58.89 kDa,等电点为6.67。利用SignalP 4.1在线软件预测发现水母雪莲SmFNSII蛋白无信号肽,为非分泌蛋白。二级结构预测表明,SmFNSII蛋白由α螺旋 (48.06%)、随机卷曲(42.64%) 和延伸链 (9.30%) 组成。经TMHMM2.0在线软件预测,SmFNSII在7−26位氨基酸中间有1个跨膜区。经NCBI CDD预测水母雪莲SmFNSII的功能域,结果发现SmFNSII含有PLN02738功能域,属于细胞色素P450 CYP93B亚家族中单氧化酶。经Kinase Phos预测发现SmFNSII可能含有5个丝氨酸磷酸化位点 (分别位于37、104、132、198、379位氨基酸) 和2个苏氨酸磷酸化位点 (分别位于83、211位氨基酸)。
水母雪莲SmFNSII氨基酸序列经NCBI Blast后,选择与其同源性较高的8个物种的FNSII氨基酸:毛山柳菊 (, ACB56919)、非洲菊 (, AAD39549)、翠菊 (, AAF04115.1)、大丽花 (, ADM67337)、金鱼草 (, BAA84071)、茶 (, ACH99109)、三花龙胆 (, BAD91809)、蒺藜苜蓿 (, XP_003622125)。使用DNAMAN软件将这些序列进行比对,发现其与菊科植物毛山柳菊、非洲菊、翠菊、大丽花的FNSII的同源性较高,分别为87%、82%、78%和75%,与金鱼草、茶、三花龙胆、蒺藜苜蓿的FNSII的同源性在54%−64%之间。
利用MEGA6软件,构建了水母雪莲SmFNSII与NCBI中已经登录的8种高等植物的FNSII系统进化树 (图1),结果为水母雪莲FNSII与菊科植物毛山柳菊、翠菊、非洲菊、大丽花的FNSII归为一大类,同源关系较近,表现出一定的种属特性,其次是蒺藜苜蓿、茶的FNSII,而与金鱼草和三花龙胆FNSII的同源关系较远。
2.3 相对荧光定量PCR表达分析
以水母雪莲基因为内参,使用特异性引物,通过实时荧光定量PCR对水母雪莲3种颜色细胞系中基因的表达量进行分析。结果显示,水母雪莲白色细胞系中基因表达量最低,而绿色系中表达量较高,为白色系中的2.15倍,红色系中的表达量最高,分别为白色系中的7.78倍和绿色系中的3.62倍 (图2A)。

图1 SmFNSII与其他物种FNSII氨基酸序列的系统进化树分析(茶Camellia sinensis;蒺藜苜蓿Madicago truncatula;毛山柳菊Hieracium pilosella;水母雪莲Saussurea medusa;翠菊Callistephus chinensis;非洲菊Gerbera hybrida;大丽花Dahlia pinnata;三花龙胆Gentiana triflora;金鱼草Antirrhinum majus)
2.4 木犀草素含量分析
水母雪莲3种颜色细胞系中的木犀草素含量的高效液相色谱法检测结果显示,水母雪莲白色细胞系中木犀草素含量最低,而绿色系中含量较高,为白色系中的2.42倍,红色系中的含量最高,分别为白色系的7.44倍和绿色系的3.07倍 (图2B)。
2.5 SmFNSII基因原核表达分析
将的全长CDS序列克隆到原核表达载体pET-28a (+)的酶切位点RⅠ和Ⅰ之间,构建出pET-重组质粒,将重组质粒进行酶切分析,结果表明表达载体构建成功。对重组质粒进行测序分析,编码区序列没有出现突变。
将重组质粒转入大肠杆菌BL21 (DE3),诱导表达,进行SDS-PAGE分析,得到接近62 kDa的目的条带,与预测结果相符合 (图3),表明在原核细胞中得以表达。SmFNSII的表达量在诱导约4 h时达到最大,之后诱导时间达到6 h和8 h时,SmFNSII在大肠杆菌中的含量降低。
3 讨论
本研究从水母雪莲愈伤组织中克隆出的基因编码的蛋白质含有PLN02738功能域,属于细胞色素P450 CYP93B亚家族中单氧化酶。基因序列同源性分析发现,与同科植物在氨基酸水平上的同源性为75%−87%。通过对包括SmFNSII在内的9个物种的FNSII蛋白质氨基酸序列进行系统进化树构建结果发现水母雪莲SmFNSII与菊科植物毛山柳菊、翠菊、非洲菊、大丽花的FNSII归为一类,同源关系相近。综上,表明本实验中克隆的为水母雪莲基因。
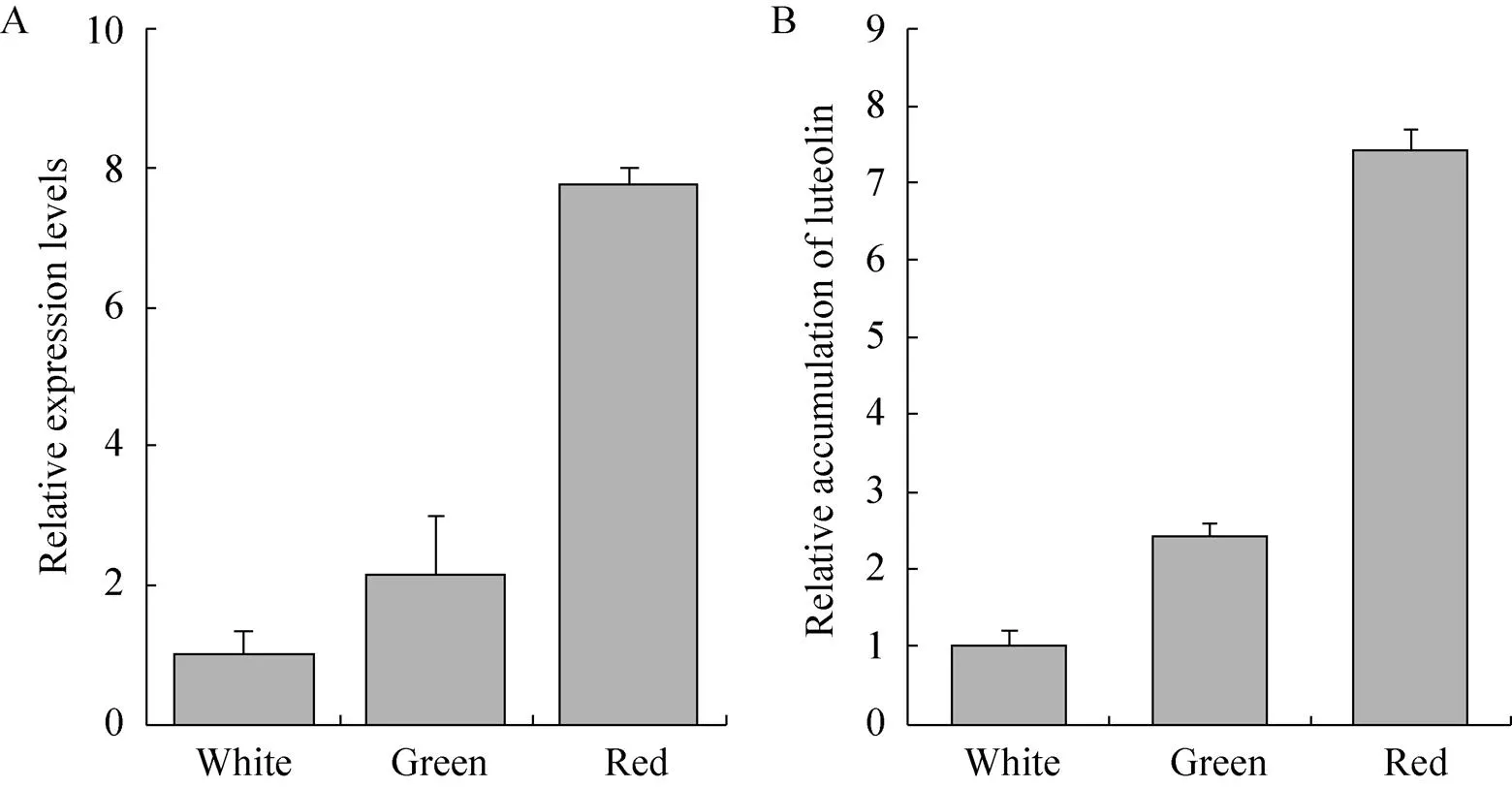
图2 水母雪莲3种颜色细胞系中SmFNSII基因的相对表达水平及对应产物木犀草素的相对含量
通过实时荧光定量PCR对水母雪莲白色、绿色和红色3种颜色细胞系中基因的表达进行分析,结果显示,水母雪莲红色细胞系中基因表达量最高,分别为白色系的7.78倍和绿色系的3.62倍。红色细胞系中的木犀草素含量分别为白色系中的7.44倍和绿色系中的3.07倍。3种颜色细胞系中基因的表达量的变化和所含木犀草素的含量成正相关,说明实验中克隆到的基因在水母雪莲中可以调控黄酮的合成。
经过低温、高糖和强光诱导得到的水母雪莲红色细胞系中结构基因、、、和的表达明显强于白色细胞系中的表达,红色细胞系中对应产物圣草酚、花青素的含量也明显高于白色细胞系中的含量,同时红色细胞系中总黄酮的含量也明显高于白色细胞系[4]。本实验分析发现,红色细胞系中黄酮合成酶FNS的产物木犀草素含量最高。木犀草素含量为雪莲生药材质量的重要鉴定标准之一[21],红色细胞系中总黄酮、儿茶素、芦丁、花青素[4]、木犀草素含量均明显高于白色细胞系,药用及保健功效高。
因此,在人工栽培过程中通过改变栽培条件对水母雪莲进行环境胁迫,促进基因在水母雪莲全植株中的表达,或者诱导培育红色植株,从而提高栽培品种的药用价值。通过筛选基因表达水平高、高产木犀草素的细胞系和植株,可培育抗炎抗癌活性较高、具有高保健功能的雪莲生药新品种,使其作为野生雪莲的替代品,为野生雪莲资源的保护和开发提供新途径。
[1] Huang JH, Tan DY. Advances in studies of snow lotuses (). J Xinjiang Agric Univ, 2002, 25(2): 8–13 (in Chinese).黄继红, 谭敦炎. 雪莲的研究进展. 新疆农业大学学报, 2002, 25(2): 8–13.
[2] Li GH, Liu F, Zhao RC. Function ofon experimental acute arthritis of mice. Acta Pharm Sin, 1980, 15: 368–370 (in Chinese).李观海, 刘发, 赵荣春. 雪莲对大鼠实验性关节急性炎症的作用. 药学学报, 1980, 15: 368–370.
[3] Fan CQ, Yue MJ. Biologically active phenols from. Bioorg Med Chem, 2003, 11(5): 703–708.
[4] Wang YJ, Li HH, Fu WY, et al. Flavonoids contents and expression analysis of related genes in red cell line ofChin J Biotech, 2014, 30(6): 1–10 (in Chinese).王亚杰, 李厚华, 付婉艺, 等. 水母雪莲红色细胞系类黄酮含量和相关基因表达分析. 生物工程学报, 2014, 30(6): 1–10.
[5] Li MY, Zhao DX, Xing JM, et al. Callus culture and flavonoids production of. Acta Bot Yunnanica, 2000, 1: 65–70 (in Chinese).李茂寅, 赵德修, 邢建民, 等. 水母雪莲愈伤组织培养和黄酮类化合物的形成. 云南植物研究, 2000, 1: 65–70.
[6] Chen FJ, Yang YG, Zhao DX, et al. Advances in studies of species, habitats distribution and chemical composition of snow lotuses () in China. Chin Bulletin Bot, 1999, 16: 561–566 (in Chinese).陈发菊, 杨映根, 赵德修, 等. 我国雪莲植物的种类、生境分布及化学成分的研究进展. 植物学通报, 1999, 16: 561–566.
[7] Dawa Z, Bai Y, Zhou Y, et al. Chemical constituents of thewhole plants of. J Nat Med, 2009, 63(3): 327–330.
[8] Lin Y, Shi R, Wang X, et al. Luteolin, a flavonoid with potential for cancer prevention and therapy. Curr Cancer Drug Targets, 2008, 8(7): 634–646.
[9] Shi R, Huang Q, Zhu X, et al. Luteolin sensitizes the anticancer effect of cisplatin via c-Jun NH2-terminal kinase-mediated p53 phosphorylation and stabilization. Mol Cancer Ther, 2007, 6(4): 1338–1347.
[10] Seelinger G, Merfort I, Schempp CM. Anti-oxidant anti-inflammatory and anti-allergic activities of luteolin. Planta Med, 2008, 74(14): 1667–1677.
[11] Han SL. Study on the effect of four chemical constituents against cancer of. Carcinog Teratog Mutag, 1995(2): 80–83 (in Chinese).韩书亮. 大苞雪莲四种成分抗癌作用研究. 癌变·畸变·突变, 1995(2): 80–83.
[12] Ma HP, Fan PC, Jing LL, et al. Anti-hypoxic activity at simulated high altitude was isolated in petroleum ether extract ofinvolucrate. J Ethnopharm, 2011, 137: 1510–1515.
[13] Martens S, Forkmann G, Matern U, et al. Cloning of parsley flavone synthase I. Phytochemistry, 2001, 58(1): 43–46.
[14] Martens S, Mithofer A. Flavones and flavone synthases. Phytochem, 2005, 66(20): 2399–2407.
[15] Gebhardt YH, Whit S, Steuber H, et al. Evolution of flavone synthase I from parsley flavanone 3-b-hydroxylase by site-directed mutagenesis. Plant Physiol, 2007, 144(3): 1442–1454.
[16] Fu WY, Li HH, Li L, et al. Extraction and purification of total flavonoids in suspension cultured cells ofJ Northwest A&F Univ: Nat Sci Ed, 2013, 14(8): 175–181 (in Chinese).付婉艺, 李厚华, 李玲, 等. 天山雪莲悬浮培养细胞总黄酮提取纯化工艺研究. 西北农林科技大学学报: 自然科学版, 2013, 41(8): 175–181.
[17] Qiu J, Gao FH, Shen GA, et al. Metabolic engineering of the phenylpropanoid pathway enhances the antioxidant capacity of. PLoS ONE, 2013, 8(8): e70665.
[18] Zhao D, Xing J, Li M, et al. Optimization of growth and jaceosidin production in callus and cell suspension cultures of. Plant Cell Tissue Organ Cult, 2001, 67(3): 227–234.
[19] Li L, Li HH, Wang YJ, et al. Pigments analysis ofcv.leaves. J Northeast For Univ, 2013, 41(7): 58–62 (in Chinese).李玲, 李厚华, 王亚杰, 等. 紫叶小檗叶片色素成分分析. 东北林业大学学报, 2013, 41(7): 58–62.
[20] Liu CY, Zhao AC, Li J, et al. Cloning and prokaryotic expression of chalcone isomerase gene from mulberry (). Scisilvae Sin, 2013, 49(2): 39–45 (in Chinese).刘长英, 赵爱春, 李军, 等. 桑树查尔酮异构酶基因的克隆与原核表达分析. 林业科学, 2013, 49(2): 39–45.
[21] Chinese Pharmacopoeia Commission. Pharmacopoeia of China. Beijing: Chemical Industry Press, 2005: 36–37 (in Chinese).国家药典委员会.中华人民共和国药典. 北京: 化学工业出版社. 2005: 36–37.
(本文责编陈宏宇)
Cloning of flavone synthase () gene and expression in three cell lines of
Bingjie Wang1, Houhua Li1, Yajie Wang1,2, Yan Gao1, Wanyi Fu3, and Xincui Wei1
1 College of Landscape Architecture and Art, Northwest A&F University, Yangling 712100, Shaanxi, China2 Baoji Haisheng Agriculture Co., Ltd, Baoji 721100, Shaanxi, China3 Agriculture and Biotechnology Institute, Zhejiang University, Hangzhou 310000, Zhejiang, China
is a rare traditional Chinese medicinal herb, of which luteolin is the main active medicinal compound for cancer prevention and treatment. A full-lengthgene, namely(GenBank Accession No. KF170286), was obtained from green cell line ofby RT-PCR and RACE-PCR. Sequence analysis indicated thatis 1 710 bp in full length, containing a 34 bp 5ʹ-untranslated region (5ʹ-UTR), a 125 bp 3ʹ- UTR, and a 1 551 bp open reading frame (ORF) encoding 516 amino acid residues. Amino acid sequence analysis indicated that SmFNSII belonged to subfamily CYP93B of plant cytochrome P450. Sequence alignment and phylogenetic analysis revealed that amino acid sequences of SmFNSII shared 87% homology with the protein in. Quantitative real-time PCR analysis indicated thatexpression is the highest in red cell line and the lowest in white cell line, corresponding to quantitative analysis of luteolin concentration. pET-, a prokaryotic expression recombinant plasmid, was constructed and transferred into, and the expressed protein band was the same size with predicted protein.cultivarswith high anti-inflammatory, anti-cancer activities and health care function would be cultivated through filtering cell lines and plants with high expression level ofgene and luteolin accumulation.
, flavone synthase FNSII, gene cloning, expression analysis, prokaryotic expression
January 29, 2015; Accepted: June 4, 2015
Houhua Li. Tel: +86-29-87080275; E-mail: lihouhua73@163.com
10.13345/j.cjb.150059
Supported by:Research Special (No. 201204308), Research Fund for the Doctoral Program of Higher Education of China (No. 20120204120006).
国家林业公益性行业科研专项 (No. 201204308),高等学校博士学科点专项科研基金 (No. 20120204120006) 资助。
2015-07-02
http://www.cnki.net/kcms/detail/11.1998.Q.20150702.1426.001.html

