表面展示表达植酸酶的重组酿酒酵母构建及酒精发酵
肖艳,陈献忠,沈微,杨海泉,樊游
表面展示表达植酸酶的重组酿酒酵母构建及酒精发酵
肖艳1,2,陈献忠1,2,沈微1,2,杨海泉1,2,樊游1,2
1 工业生物技术教育部重点实验室,江苏无锡 214122 2 江南大学生物工程学院生物资源与生物能源研究中心,江苏无锡 214122

肖艳, 陈献忠, 沈微, 等. 表面展示表达植酸酶的重组酿酒酵母构建及酒精发酵. 生物工程学报, 2015, 31(12): 1700–1710.Xiao Y, Chen XZ, Shen W, et al. Surface display of phytase on Saccharomyces cerevisiae for efficient bioethanol production from corn starch. Chin J Biotech, 2015, 31(12): 1700–1710.
以淀粉为原料的同步糖化发酵是目前乙醇生产的主要途径之一。然而原料中含有的植酸不仅影响酒精发酵效率,而且也会导致环境中难以被植物吸收的磷含量的增加,加剧环境污染。将来源于大肠杆菌的植酸酶基因与酵母编码α-凝集素C端编码序列连接并置于α-因子分泌信号肽下游,构建植酸酶表面展示表达重组载体pMGK-AG-并转化工业酿酒酵母,成功获得了在细胞表面锚定表达植酸酶的重组菌PHY。重组酵母的植酸酶表达水平达到6.4 U/g (菌体湿重),其最适温度为55 ℃,最适pH 4.0,在pH 3.5–4.5范围内具有较高的活性。以玉米粉为原料的同步糖化发酵实验表明,重组酵母PHY的生长速度高于出发菌株,同时酒精产量相较于出发菌株提高了3.7%。更为重要的是发酵后酒糟中植酸磷含量与对照相比降低了91%。构建的表面展示表达植酸酶的重组工业酿酒酵母能够有效降低植酸含量,提高了酒糟的利用价值,减少磷排放,对燃料酒精的环境友好生产具有重要的借鉴意义。
酿酒酵母,表面展示,植酸酶,燃料酒精,α-凝集素
燃料酒精是一种可再生的清洁能源,国内外生产燃料酒精的原料有玉米、甘薯、甘蔗、甜菜、高粱秸秆等,目前应用于工业生产的主要是玉米类淀粉质原料。利用淀粉质原料生产燃料酒精的方法主要有先糖化后发酵法、同步糖化发酵法和高浓度发酵法等,同步糖化发酵法具有发酵周期短[1]、工艺简单、能耗低、醪液酒精浓度高等优点,值得工业推广[2]。酒精糟液的处理是燃料酒精生产中的一个关键工序,糟液中含有糖分、蛋白质、纤维素、氨、磷、钾等营养成分,经浓缩处理后可用于生产动物饲料[3-4]。酒精糟液中的磷主要以植酸磷的形式存在,植酸磷是一种抗营养因子,不能被动物直接吸收利用,还会影响其他矿物元素的吸收[5],不能被吸收的植酸磷随动物粪便排出体外后,还会对环境造成污染[6]。
酿酒酵母表面展示表达系统能够将异源靶蛋白在信号肽的引导下向胞外分泌,并借助酵母细胞内的GPI锚定机制定位表达于酵母细胞表面[7]。酿酒酵母表面展示系统具有遗传操作方便、适宜表达真核蛋白等优点,是比较理想的展示系统[8],在全细胞催化、蛋白纯化、细胞吸附、抗体工程等领域广泛应用[9-10]。近几年,利用表面展示技术改良酿酒酵母,拓展底物利用范围提高酒精发酵性能方面取得了显著的进步。Shigechi等通过在酵母表面共展示米根霉葡萄糖糖淀粉酶和牛链球菌α-淀粉酶实现了利用不蒸煮粗玉米淀粉生产乙醇的新工艺[11]。Fujita等构建了共表达针尾曲霉的β-葡聚糖苷酶、里氏木霉的内切葡聚糖酶和纤维二糖水解酶的重组酵母,利用同步糖化发酵,将无定形纤维素转化为乙醇[12]。
植酸酶能够催化植酸及其盐类水解为肌醇与磷酸(盐),同时释放出与植酸(盐) 结合的其他营养物质,该酶能够提高饲料的营养价值,在动物饲料生产工业中具有重要的作用[13]。在酒精发酵生产中,添加植酸酶能够促进酵母的发育及代谢,提高酒精生产效率,同时降低酒糟中的植酸磷含量,提高其饲用价值,保护环境[14]。Fujita等在清酒酒曲中加入了表达植酸酶的米曲霉,用该酒曲进行的酒精发酵得到促进,最终酒精产量提高了0.5% (/)[15]。许宏贤等在高粱生料酒精发酵过程中添加植酸酶,清液和酒糟中的植酸含量明显降低,提高了酒糟作为饲料的营养价值[16]。Khullar等在干磨法酒精生产中添加植酸酶,酒精产量从16.6%提高到17.4% (/),植酸酶的添加还使酒精生产副产物酒糟蛋白饲料(DDGS) 有较高的蛋白质含量和较低的淀粉含量,分别从34.2%和8.14%变为36.5%和6.58%[17]。Mikulski等在淀粉水解前及水解后分别添加植酸酶,淀粉酶的水解作用得到促进,发酵初始糖浓度平均提高了14.9 g/L,酒精产量分别增加了1.0%和0.6% (/)[18]。
本文将大肠杆菌的植酸酶基因与酵母α-凝集素C端编码序列连接并置于α-分泌信号肽(Secretion signal) 下游,构建表面展示植酸酶的重组质粒并转化酿酒酵母,获得了在细胞表面锚定表达植酸酶的重组酵母PHY。该重组酵母在以玉米粉为原料的同步糖化发酵中,表现出优于出发菌株的发酵性能,更为重要的是发酵后酒糟中植酸磷含量与对照相比降低了91%。目前,我国年产玉米酒糟350万t左右,其中大部分用作畜禽饲料[19]。本文构建的表面展示表达植酸酶的重组酵母应用酒精工业生产,不仅能有效水解植酸磷,提高全价干酒糟的饲用价值,而且也会减少有机磷的排放。
1 材料与方法
1.1 菌株和质粒
大肠杆菌JM109用于质粒构建,工业酿酒酵母CICIMY0086用于酵母转化宿主,以上菌种均由江南大学中国高校工业微生物资源与信息中心保藏。pMD18-T载体购自TaKaRa公司,用于目的基因的克隆和测序;质粒pPIC9K由本实验室保藏,用于克隆酵母分泌信号肽;含有密码子优化后的植酸酶基因的重组质粒pKK322-和酵母表面展示载体pMGK-AG为实验室前期构建,用于目的基因在酿酒酵母表面的展示。
1.2 酶和试剂
核酸内切酶、T4 DNA连接酶、DNA聚合酶等分子克隆工具酶均为大连宝生物工程公司产品;G418购自生工生物工程(上海) 有限公司;PCR引物由上海生工生物工程技术服务有限公司合成;酶特异性底物果胶及植酸钠为Sigma公司产品;发酵用玉米粉为市售,淀粉含量为70%;耐高温α-淀粉酶及糖化酶为江苏锐阳生物科技有限公司产品;其他试剂均为国产分析纯。
1.3 培养基和培养条件
LB培养基:0.5%酵母粉,1%蛋白胨,1%氯化钠,37 ℃用于的培养。添加100 μg/mL的氨苄青霉素用于重组菌的筛选。
YPD培养基:1%酵母粉,2%蛋白胨,2%葡萄糖,30 ℃用于的培养。添加300 μg/mL的G418用于重组酵母的筛选。
种子培养基:2%葡萄糖,0.85%酵母粉,0.13%氯化铵,0.01%硫酸镁,0.006%氯化钙,30 ℃用于酿酒酵母发酵前的种子培养。
发酵培养基:按1∶3 (/) 的比例将玉米粉与去离子水混合,调pH至6.0,加入耐高温α淀粉酶(10 U/g)。加热料液至95 ℃,维持2 h。降至室温后调pH至4.5,添加去离子水以弥补水分损失。高压蒸汽灭菌,降温后加入糖化酶(130 U/g) 和尿素(终浓度0.05%)。
1.4 重组质粒的构建
重组质粒构建流程如图1所示。根据植酸酶基因序列设计一对引物1 (5ʹ-CAGAGTGA GCCTGAGTTGAAA-3ʹ) 和2 (5ʹ-CCGTTACTACAAGGAACAAGCTGG-3ʹ,下划线为RⅠ酶切位点),以重组质粒pKK322-为模板,PCR扩增得到不含自身信号肽的植酸酶基因。将扩增得到的基因用补平后与BⅠ酶切后的质粒pPIC9k连接,得到重组质粒pPIC9k-。以P1 (5ʹ-CCGCGA TGAGATTTCCTTCAA-3ʹ,下划线为RⅠ酶切位点) 和2为引物PCR扩增得到含信号肽的s基因,RⅠ酶切后用核酸酶S1处理得到平末端片段,同样方法处理表面展示载体pMGK-AG,T4 DNA连接酶16 ℃过夜连接,得到表达载体pMGK-AG-。
1.5 工业酿酒酵母的转化及转化子筛选
重组质粒用Ⅱ酶切线性化,电转化法转化工业酿酒酵母,转化液涂布含有300 μg/mL G418的YPD 平板,30 ℃培养48 h。随机挑取转化子提取染色体DNA,PCR扩增筛选阳性转化子。
1.6 酶活力测定方法
将筛选到的阳性转化子与出发菌株分别接种10 mL YPD培养基,30 ℃、200 r/min培养2 d,12 000 r/min离心30 s收集菌体,用乙酸-乙酸钠缓冲液(pH 5.0) 洗涤2次,重悬菌体,进行植酸酶酶活力测定。为进一步判断植酸酶的表达位置,分别取上清液和超声波破碎后的细胞重悬液进行酶活力测定。
植酸酶酶活测定采用钼蓝法,具体操作如下:将800 μL 6.25 mmol/L的植酸钠溶液37 ℃预热10 min,加入200 μL待测酶液,37 ℃反应30 min,立即加入1 mL 5%的三氯乙酸终止反应,加入 1 mL显色液(1.5%钼酸铵溶液,2.7%硫酸亚铁,4∶1比例混合,现用现配),室温下静置10 min,8 000 r/min离心5 min,测定其在700 nm处的吸光值[20]。酶活定义为:在37 ℃、pH 5.0条件下,每分钟从5.0 mmol/L植酸钠溶液中释放出1 μmol的无机磷所需的酶量定义为1个酶活力单位。
为评价重组植酸酶的最适pH,分别在pH 3.0、3.5、4.0、4.5、5.0、5.5.、6.0、6.5、7.0和7.5 (0.1 mol/L乙酸-乙酸钠作为pH缓冲液),pH 7.0、7.5、8.0、8.5和9.0 (50 mmol/L Tris-HC1作为pH缓冲液) 条件下,37 ℃反应30 min,然后用钼蓝法测定植酸酶酶活力。
1.7 重组工业酿酒酵母发酵实验
将筛选到的重组工业酿酒酵母与出发菌株分别接种10 mL YPD培养基,30 ℃、200 r/min培养12 h,1%接种量转接50 mL YPD培养基,每隔2 h取样,在波长600 nm下测吸光值,测定其生长曲线。

图1 重组质粒pPIC9k-phy和pMGK-AG-phy的构建
将重组工业酿酒酵母和出发菌株分别接种于20 mL种子培养基,30 ℃、200 r/min培养 12 h,以1%的接种量转接新的种子培养基,30 ℃、200 r/min培养18 h,作为发酵实验的种子液。发酵培养基装液量为135 mL,接种量为10%,30 ℃静置发酵,每隔8 h取样,发酵56 h。为保证数据可靠性,每组实验做3个平行。
为进一步验证植酸酶在酒精发酵中的作用,进行了外源添加植酸酶的工业酿酒酵母发酵实验,发酵方法同上。
用高效液相色谱分析发酵过程中葡萄糖的消耗和酒精的产生,色谱柱为Aminex HPX-87H 离子交换柱,流动相为10 mmol/L H2SO4,流速0.8 mL/min,柱温65 ℃[21];发酵初始的总糖采用酸水解法测定,DNS法测还原糖,以公式计算发酵效率:发酵效率=实测发酵酒精浓度/(初始总糖浓度×0.511)×100%。
实验所用发酵培养基中含有玉米粉,杂质较多,不宜直接测定生物量。核酸在细胞中的含量十分稳定,在代谢上也较为稳定,与菌体量具有良好的线性关系[22],故用菌体内的核酸含量表示其菌体量,测定方法如下:取1 mL发酵液离心水洗,在沉淀中加预冷的10%三氯乙酸1 mL,混匀,冰水浴中放置2 min,离心弃上清,沉淀中加冷的5%三氯乙酸1 mL,混匀,沸水浴中加热30 min,冷却离心,取上清0.1 mL稀释至5 mL,混匀后在波长260 nm处测吸光值,菌体核酸量(g/L)=×1.72[23]。植酸磷含量测定采用沉淀消解法,取1 g烘干后的发酵混合物,加入1.2%的盐酸50 mL,200 r/min振荡1 h,定性滤纸过滤,取10 mL滤液,加入1%的三氯化铁4 mL,沸水浴30 min,冷却后离心去上清,向沉淀物中加入5 mL浓硝酸和2 mL浓硫酸,加热消解至沉淀全部溶解,定容至100 mL;取定容后的消解液10 mL,加入0.8 mol/L浓硫酸4 mL、10 %钼酸铵0.4 mL、去离子水30 mL,摇匀后加入2%抗坏血酸0.5 mL,定容至50 mL,显色20 min,波长660 nm处测定吸光值[24]。
2 结果与讨论
2.1 重组质粒的构建
表面展示表达植酸酶的重组质粒构建流程见图1。首先,以质粒pKK322-为模板,1和2为引物,扩增得到大小为1 236 bp的来源于大肠杆菌并经密码子优化的植酸酶基因,将该片段与载体pPIC9k连接,转化大肠杆菌JM109,构建重组质粒pPIC9k-。用限制性内切酶Ⅰ进行酶切验证,得到大小为2 930 bp和7 588 bp的条带,酶切验证正确(图2A)。
以重组质粒pPIC9k-为模板,P1和2为引物扩增得到大小为1 508 bp的含信号肽的s基因,将该片段与表面展示载体pMGK-AG连接,转化大肠杆菌JM109,构建表达载体pMGK-AG-。用限制性内切酶d Ⅲ进行酶切验证,得到大小为1 056 bp、3 940 bp和5 729 bp的条带,酶切验证正确 (图2B)。
2.2 重组工业酿酒酵母的构建及酶活测定
重组质粒pMGK-AG-用Ⅱ酶切线性化后转化工业酿酒酵母,转化液涂布于添加了300 μg/mL G418的YPD固体平板,随机挑取转化子提取染色体DNA,以1和2为引物进行PCR验证。pMGK-AG-转化子在1 236 bp处出现条带,以出发菌株染色体DNA为模板PCR扩增未得到任何片段 (图2C)。
挑取阳性转化子与出发菌株分别接种于YPD培养基,培养16 h后,收集细胞,进行植酸酶酶活力测定。7#转化子的细胞悬液测得植酸酶酶活为6.4 U/g (菌体湿重),该菌株命名为PHY;出发菌株中未测得任何酶活,说明植酸酶基因整合在酵母染色体上并成功表达;7#转化子
细胞重悬液经超声波破碎后酶活为5.8 U/g,且转化子上清液中没有检测到酶活,说明植酸酶在酵母细胞表面锚定表达。
2.3 重组植酸酶的酶学性质分析
2.3.1 重组植酸酶的最适温度及温度稳定性
由图3A可知,重组酶的最适温度为55 ℃,温度低于55 ℃时,酶活随温度上升而上升,30 ℃时的酶活仅为55 ℃时的17%,当温度高于55 ℃时,酶活迅速下降,60 ℃及65 ℃时保留有60%的酶活。
将收集的重组细胞在30 ℃、40 ℃、45 ℃、50 ℃、55 ℃、60 ℃分别保温1–6 h,测定重组酶的温度稳定性,结果如图3B所示。样品在30 ℃时具有极好的稳定性,保温6 h,比酶活仍在98%以上;40 ℃时样品稳定性依然良好,保温6 h,比酶活在85%以上;酶活在45 ℃及50 ℃保温过程中逐渐下降,保温3 h,样品保留60%以上的酶活,保温6 h,比酶活分别为43%和28%;样品在55 ℃和60 ℃保温过程中酶活下降较快,保温1 h,比酶活分别降至45%、7%。

图2 重组质粒的酶切验证及酿酒酵母转化子的菌落PCR鉴定
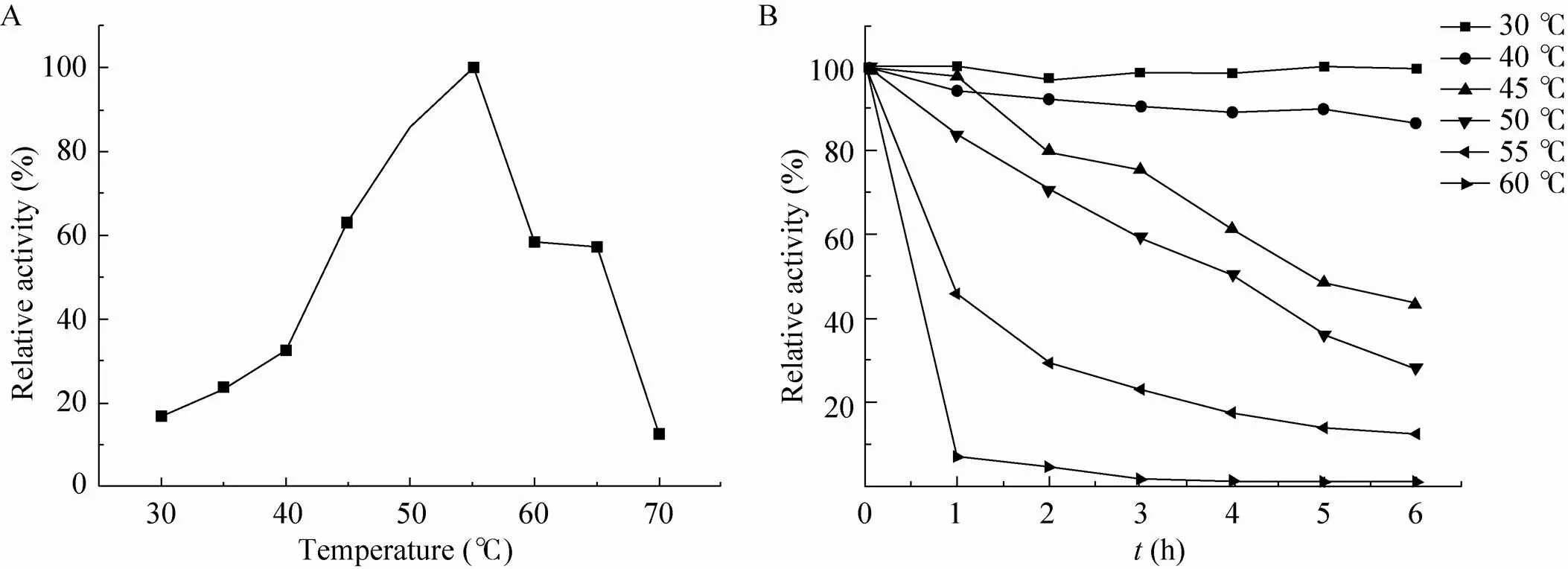
图3 表面展示植酸酶的最适温度(A) 和温度稳定性(B)
2.3.2 重组植酸酶的最适pH
由图4可知,表面展示的重组植酸酶在酸性条件下酶活较高,在pH 3.5–4.5之间酶活力较高,保持在80%以上,pH 4.0时酶活力达到最高。当pH低于3.5或高于4.5时酶活力迅速下降,当pH为碱性条件时酶活力丧失殆尽。酿酒酵母适宜在酸性环境中生长,酒精发酵的最适pH在4–5范围[25],重组酶最适pH分析结果表明该酶适合于酿酒酵母的酒精发酵环境。
2.4 重组工业酿酒酵母发酵实验
2.4.1 YPD培养基摇瓶发酵
将重组酵母PHY与出发菌株分别接种于YPD培养基,30 ℃、200 r/min条件下测定其生长曲线,菌体生长情况如图5所示,6–10 h为对数生长期,重组酵母PHY的生长速率略快于出发菌株,发酵12 h后达到稳定,出发菌株600最大在7.32左右,重组酵母PHY最大在7.38左右,说明重组酵母在YPD培养基中的菌体生长情况并没有显著变化。
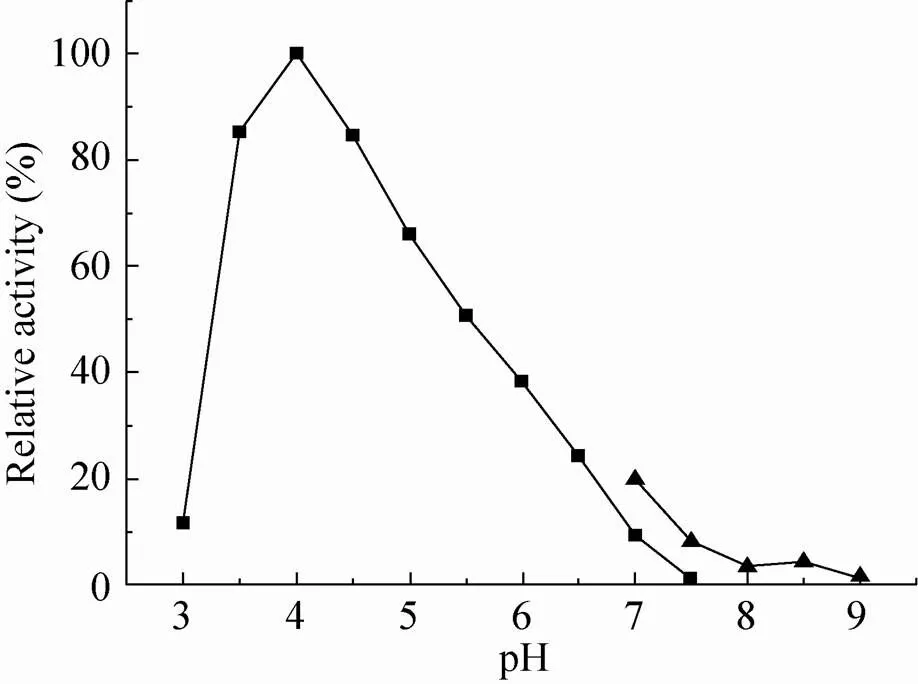
图4 表面展示植酸酶的最适pH

图5 出发菌株和重组酵母PHY在YPD培养基中发酵的生长曲线
2.4.2 重组酵母PHY和出发菌株在玉米粉培养基中的生长和发酵性能比较
如图6所示,发酵前期,核酸量快速增长,菌体生长迅速,发酵中后期随乙醇浓度的上升,菌体生长受到抑制,核酸量逐渐趋于稳定。重组酵母PHY及外源添加植酸酶的出发菌株发酵过程中的核酸量高于出发菌株,发酵40 h核酸量达到最大,出发菌株最大核酸量为0.72 g/L,重组酵母PHY最大核酸量为0.76 g/L,外源添加植酸酶的出发菌株最大生物量为0.74 g/L,重组酵母在玉米粉培养基中的核酸量高于出发菌株,说明其菌体生长情况优于出发菌株。
如图7所示,重组酵母PHY酒精生产速率与出发菌株相当,发酵48 h,酒精产量最高为112 g/L,与对照菌株相比,酒精产量(108 g/L)提高了3.7%,而外源添加植酸酶的发酵结果也表明酒精产量有一定程度提高。发酵初始的总糖浓度为245 g/L,重组酵母PHY及出发菌株的发酵效率分别为90.25%和85.5%;发酵前8 h,葡萄糖浓度有明显上升,是由于糖化酶持续水解淀粉糊精,生产葡萄糖,重组酵母PHY发酵过程中的葡萄糖消耗速率略快于出发菌株。外源添加植酸酶的出发菌株发酵情况与植酸酶重组酵母表现相似,酒精产量和葡萄糖消耗速率略快于出发菌株,但差距不大。
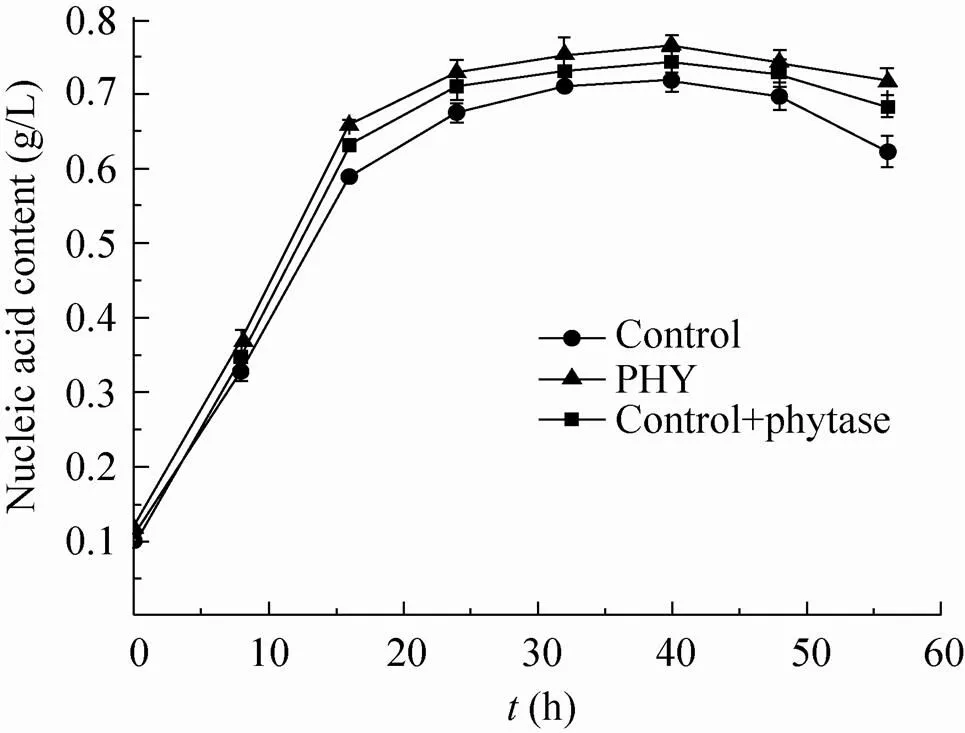
图6 出发菌株、重组酵母PHY及外源添加植酸酶的出发菌株在玉米粉培养基中发酵的核酸生物量
以植酸磷的形式存在于酒糟中的磷元素的生物可利用性较低,其植酸磷含量高低不仅显著影响着酒糟作为动物饲料的营养价值,而且还影响环境的磷排放量[26]。我们评价了重组酵母酒精发酵过程中植酸磷含量变化,结果如图8所示。发酵前期,出发菌株发酵液固形物中植酸磷含量有所升高是由于随发酵进行,发酵液中固形物比例减少,植酸磷得到浓缩。重组酵母PHY及外源添加植酸酶的出发菌株发酵液固形物中的植酸磷含量明显降低。出发菌株发酵结束后的干酒糟中植酸磷含量为0.68%,而重组酵母PHY发酵后干酒糟中的植酸磷含量仅0.06%,降低了91%,外源添加植酸酶的出发菌株发酵后干酒糟中的植酸磷含量也相应降低。
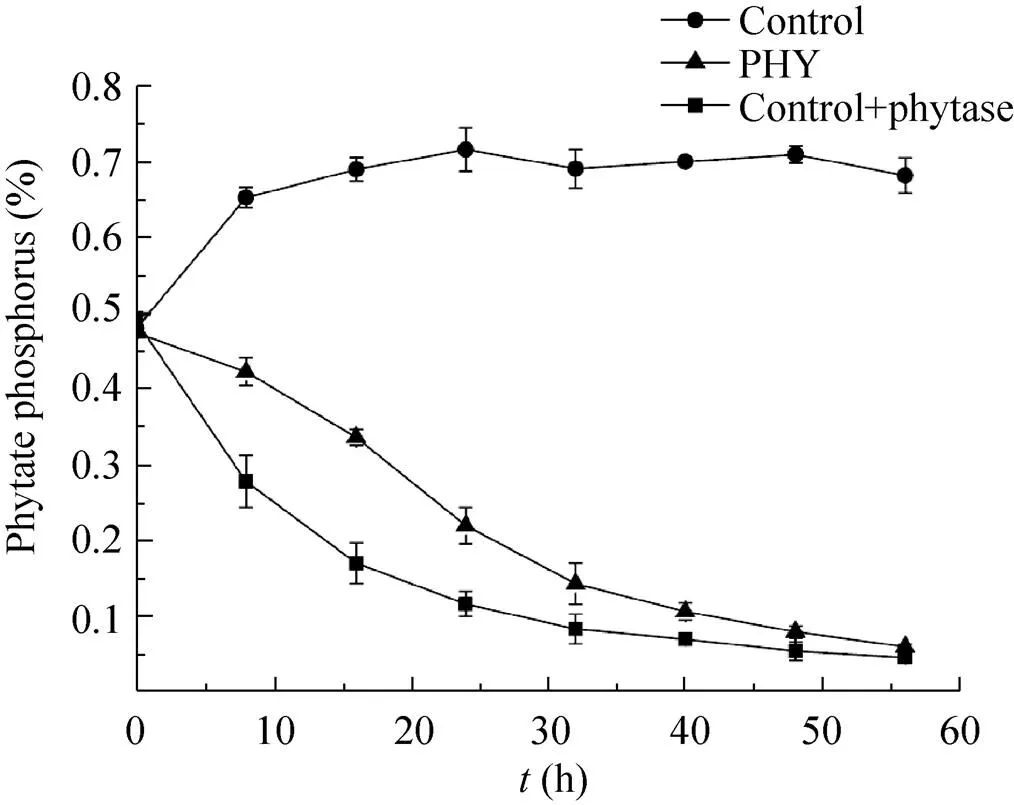
图8 出发菌株、重组酵母PHY及外源添加植酸酶的出发菌株在玉米粉培养基中发酵过程中固形物中的植酸磷含量的变化图
结果表明利用表面展示植酸酶的重组酿酒酵母酒精发酵显著降低了酒糟中的植酸和植酸磷含量,提高了酒糟的饲用价值,同时有利于减少有机磷的排放。但是重组植酸酶活性较低,而且重组酵母菌对酒精发酵性能的提升也很微弱。分析其原因,一方面可能是来源于细菌的植酸酶基因不适宜于酵母表达系统,或者启动子强度较弱导致重组酶的表达活力较低;另一方面,构建整合型表达植酸酶的重组质粒尽管提高了重组菌的稳定性,但一定程度上限制了植酸酶基因拷贝数,从而导致了较低的重组酶活。另外,深入分析植酸分解导致的培养基营养成分的改变以及优化相应发酵工艺也是提高酒精发酵性能的可能途径,值得进一步研究。
3 结论
本研究通过PCR技术克隆了大肠杆菌的植酸酶基因,并将其展示于工业酿酒酵母细胞表面。重组酵母PHY植酸酶酶活力达到6.4 U/g。表面展示的植酸酶在pH 3.5–4.5条件下酶活力较高,符合酿酒酵母发酵要求。重组酵母PHY在玉米粉培养基中静置发酵,酒精产量提高了3.7%,发酵过程中,重组酵母PHY发酵液固形物中植酸磷含量显著降低,发酵后干酒糟中植酸磷含量相比出发菌株降低了91%,为提高全价酒糟的利用价值奠定了基础,同时有利于减少环境中有机磷的排放。
[1] Montesinos T, Navarro JM. Production of alcohol from raw wheat flour by amyloglucosidase and. Enzyme Microb Technol, 2000, 27(6): 362–370.
[2] Liu Z, Wang JP, Zhang LF, et al. Production of ethanol by simultaneous saccharifiction and fermentation from cassava. Chin J Process Eng, 2005, 5(3): 353–356 (in Chinese). 刘振, 王金鹏, 张立峰, 等. 木薯干原料同步糖化发酵生产乙醇. 过程工程学报, 2005, 5(3): 353–356.
[3] Welker TL, Lim C, Barrows FT, et al. Use of distiller's dried grains with solubles (DDGS) in rainbow trout feeds. Anim Feed Sci Technol, 2014, 195: 47–57.
[4] Nade T, Uchida K, Omori K, et al. The effects of feeding a low level of distiller's dried grains with solubles ( DDGS) to yearling Holstein steers. Anim Sci J, 2013, 84(6): 476–482.
[5] Ray PP, Shang C, Pearson RE, et al. Disappearance of infused phytate from the large intestine of dairy heifers. J Dairy Sci, 2012, 95(10): 5927–5935.
[6] Mullaney EJ, Daly CB, Ullah AH. Advances in phytase research. Adv Appl Microbiol, 2000, 47: 157–199.
[7] Lee SY, Choi JH, Xu ZH. Microbial cell-surface display. Trends Biotechnol, 2003, 21(1): 45–52.
[8] Kondo A, Ueda M. Yeast cell-surface display-applications of molecular display. Appl Microbiol Biotechnol, 2004, 64(1): 28–40.
[9] Blaise L, Wehnert A, Steukers MPG, et al. Construction and diversification of yeast cell surface displayed libraries by yeast mating: application to the affinity maturation of Fab antibody fragments. Gene, 2004, 342(2): 211–218.
[10] Gai SA, Wittrup KD. Yeast surface display for protein engineering and characterization. Curr Opin Struct Biol, 2007, 17(4): 467–473.
[11] Shigechi H, Fujita Y, Koh J, et al. Energy-saving direct ethanol production from low-temperature- cooked corn starch using a cell-surface engineered yeast strain co-displaying glucoamylase and α-amylase. Biochem Eng J, 2004, 18(2): 149–153.
[12] Fujita Y, Takahashi S, Ueda M, et al. Direct and efficient production of ethanol from cellulosic material with a yeast strain displaying cellulolytic enzymes. Appl Environ Microbiol, 2002, 68(10): 5136–5141.
[13] Haefner S, Knietsch A, Scholten E, et al. Biotechnological production and applications of phytases. Appl Microbiol Biotechnol, 2005, 68(5): 588–597.
[14] Shetty JK, Paulson B, Pepsin M, et al. Phytase in fuel ethanol production offers economical and environmental benefits. Int Sugar J, 2008, 110(1311): 160–174.
[15] Fujita J, Fukuda H, Yamane YI, et al. Critical importance of phytase for yeast growth and alcohol fermentation in Japanesebrewing. Biotechnol Lett, 2001, 23(11): 867–871.
[16] Xu HX, Ran ZH, Duan G. Application of phytase in non-cooked fermentation of sorghum for ethanol production. Food Sci, 2010, 31(5): 248–251 (in Chinese). 许宏贤, 阮振华, 段钢. 高粱生料酒精发酵植酸酶的应用研究. 食品科学, 2010, 31(5): 248–251.
[17] Khullar E, Shetty JK, Rausch KD, et al. Use of phytases in ethanol production from E-Mill corn processing. Cereal Chem, 2011, 88(3): 223–227.
[18] Mikulski D, Kłosowski G, Rolbiecka A. Effect of phytase application during high gravity (HG) maize mashes preparation on the availability of starch and yield of the ethanol fermentation process. Appl Biochem Biotechnol, 2014, 174(4): 1455–1470.
[19] Li P. Determination and prediction of energy and amino acid digestibility in different processing corn distillers dried grains with solubles of China fed to growing pigs [D]. Beijing: China Agricultural University, 2014 (in Chinese). 李平. 国产不同生产工艺玉米DDGS生长猪能量与氨基酸消化率研究[D]. 北京: 中国农业大学, 2014.
[20] Sanikommu S, Pasupuleti M, Vadalkonda L. Comparison of phosphate estimating methods in the presence of phytic acid for the determination of phytase activity. Prep Biochem Biotechnol, 2014, 44(3): 231–241.
[21] Guo ZP. Metabolic engineering of an industrial ethanol producing yeast to improve its fermentation performance[D]. Wuxi: Jiangnan University, 2011 (in Chinese).郭忠鹏. 代谢工程改善工业酒精酵母发酵性能[D]. 无锡: 江南大学, 2011.
[22] Koliander B, Hampel W, Roehr M. Indirect estimation of biomass by rapid ribonucleic acid determination. Appl Microbiol Biotechnol, 1984, 19(4): 272–276.
[23] Prasetyo J, Zhu J, Kato T, et al. Efficient production of cellulase in the culture ofusing untreated waste paper sludge. Biotechnol Prog, 2011, 27(1): 104–110.
[24] Lorenz AJ, Scott MP, Lamkey KR. Quantitative determination of phytate and inorganic phosphorus for maize breeding. Crop Sci, 2006, 47(2): 600–606.
[25] Zhu GJ, Li HZ. Microbiology. Beijing: Science Press, 2009: 284–285 (in Chinese). 诸葛健, 李华钟. 微生物学. 北京: 科学出版社, 2009: 284–285.
[26] Liu KS. Chemical composition of distillers grains, a review. J Agric Food Chem, 2011, 59(5): 1508–1526.
(本文责编郝丽芳)
Surface display of phytase onfor efficient bioethanol production from corn starch
Yan Xiao1,2, Xianzhong Chen1,2, Wei Shen1,2, Haiquan Yang1,2, and You Fan1,2
1 Key Laboratory of Industrial Biotechnology, Ministry of Education, Jiangnan University, Wuxi 214122, Jiangsu, China2 Center of Bioresource & Bioenergy, School of Biotechnology, Jiangnan University, Wuxi 214122, Jiangsu, China
Production of bioethanol using starch as raw material has become a very prominent technology. However, phytate in the raw material not only decreases ethanol production efficiency, but also increases phosphorus discharge. In this study, to decrease phytate content in an ethanol fermentation process,was engineered for heterologous expression of phytase on the cell surface. Thegene encoding phytase gene was fused with the C-terminal-half region of α-agglutinin and then inserted downstream of the secretion signal gene, to produce a yeast surface-display expression vector pMGK-AG-, which was then transformed into. The recombinant yeast strain, PHY, successfully displayed phytase on the surface of cells producing 6.4 U/g wet cells and its properties were further characterized. The growth rate and ethanol production of the PHY strain were faster than the parentstrain in the fermentation medium by simultaneous saccharification and fermentation. Moreover, the phytate concentration decreased by 91% in dry vinasse compared to the control. In summary, we constructed recombinantstrain displaying phytase on the cell surface, which could effectively reduce the content of phytate, improve the utilization value of vinasse and reduce the discharge of phosphorus. The strain reported here represents a useful novel engineering platform for developing an environment-friendly system for bioethanol production from a corn substrate.
, surface display, phytase, bioethanol, α-agglutinin
January 19, 2015; Accepted:April 22, 2015
Xianzhong Chen. Tel/Fax: +86-510-85918122; E-mail: xzchen@jiangnan.edu.cn
10.13345/j.cjb.150032
Supported by:The Science and Technology Support Program of Jiangsu Province (No. BE2012618).
江苏省科技支撑计划社会发展项目 (No. BE2012618) 资助。

