重组阳离子抗肿瘤肽AIK的原核表达、纯化及活性测定
范芳芳,孙慧莹,徐晖,刘佳玮,张海员,李亦兰,宁雪莲,孙悦,白静,傅松滨,周春水
重组阳离子抗肿瘤肽AIK的原核表达、纯化及活性测定
范芳芳,孙慧莹,徐晖,刘佳玮,张海员,李亦兰,宁雪莲,孙悦,白静,傅松滨,周春水
哈尔滨医科大学医学遗传学教研室,黑龙江哈尔滨 150081

范芳芳, 孙慧莹, 徐晖, 等. 重组阳离子抗肿瘤肽AIK的原核表达、纯化及活性测定. 生物工程学报, 2015, 31(12): 1753–1763.Fan FF, Sun HY, Xu H, et al. Expression, purification of recombinant cationic peptide AIK in Escherichia coli and its antitumor activity. Chin J Biotech, 2015, 31(12): 1753–1763.
利用Gateway克隆技术构建重组抗瘤肽AIK的原核表达体系,建立表达及纯化重组AIK的最优条件,为深入研究和利用AIK奠定基础。首先,设计含AttB重组位点的引物,通过重叠PCR技术扩增出AttB-TEV-FLAG-AIK序列,利用BP重组反应将目的序列TEV-FLAG-AIK克隆到供体载体pDONR223中,构建入门载体,再通过LR重组反应,将目的序列转移到目的载体pDEST15中,构建GST-AIK融合蛋白原核表达质粒。随后,在BL21 (DE3) 工程菌中优化诱导融合蛋白表达的条件。以谷胱甘肽磁珠纯化GST-AIK融合蛋白,再以rTEV酶切除GST,获得FLAG-AIK重组蛋白。最后以MTS法检测FLAG-AIK对白血病细胞HL-60的细胞毒性。菌液PCR验证和测序分析表明成功构建了重组抗瘤肽AIK的入门质粒和原核表达质粒。在BL21 (DE3) 工程菌中实现了GST-AIK融合蛋白的高效可溶性表达。并测得在37 ℃下以0.1 mmol/L IPTG诱导工程菌(600=1.0) 4 h,重组蛋白表达量占菌体总蛋白的30% 以上。经GST亲和层析、rTEV酶切除GST标签及二次GST亲和层析获得纯度高于95%的FLAG-AIK蛋白。MTS法测得所制备的FLAG-AIK蛋白抑瘤活性与化学合成的AIK相当。总之,本课题应用Gateway克隆系统成功构建了抗瘤肽AIK的原核表达质粒,实现了GST-AIK融合蛋白的高效可溶性表达,经亲和层析获得了有生物活性的重组AIK多肽,为后续深入研究和大规模制备奠定了基础。
阳离子多肽,位点特异性重组,GST融合蛋白,诱导表达,亲和层析,抑瘤活性
伴随生物技术的迅猛发展,当前的药物不再局限于传统的小分子化合物,多肽类生物药物在疾病治疗领域扮演的角色越来越重要。目前全世界获批上市的多肽类药物已经超过50种,目前主要用于治疗癌症、心血管疾病、免疫代谢类疾病等。多肽类抗肿瘤药物由于分子量小 (一般小于50个氨基酸)、活性高、易于穿透吸收、免疫原性低、结构简单易于进行改造,对多药抗性的细胞系具有良好的抑制活性[1-4],在癌症的治疗领域越来越受到重视,而且筛选新型高活性抗瘤肽也成为肿瘤药物研发的热点之一[5-6]。
AIK是本课题组在筛选具有抗瘤活性的人工合成多肽过程中发现的一种能高效杀伤肿瘤细胞的多肽。AIK由25个氨基酸残基构成,其中含有7个赖氨酸和10个精氨酸,是一种典型的阳离子多肽[7]。本实验室前期研究证明AIK在体外对各种肿瘤细胞,特别是肺巨细胞癌细胞、白血病细胞、宫颈癌细胞,具有较强的抑制作用。而动物实验表明,AIK能显著抑制肝癌H22细胞小鼠皮下移植瘤的生长,且无明显不良反应。同时,AIK相对分子质量小,空间结构简单,易于进行结构改造,在肿瘤的靶向性药物研发上将具有重要的应用价值。
多肽可以通过化学合成,但是化学合成过程复杂,耗费高昂,将严重限制其作为药物在临床的使用。生物工程技术的迅猛发展,为多肽类药物的大规模制备提供了技术条件[8-9]。本课题组利用Gateway克隆系统构建了AIK的原核表达质粒,在大肠杆菌BL21 (DE3) 中诱导表达AIK融合蛋白,优化了诱导表达条件并分离纯化出具有生物活性的重组AIK多肽。总之,本研究建立了一种简易、经济的生物工程方法来大规模制备重组AIK,为后续AIK的功能研究和肿瘤治疗应用奠定了基础。
1 材料与方法
1.1 材料
质粒pDONR223和pDEST15购自Invitrogen公司。TOP10菌株为本室保存菌种。BL21 (DE3) 菌株由哈尔滨医科大学刘兴汉教授惠赠。dNTPS、DNA聚合酶、Pyrobest高保真DNA聚合酶购自TaKaRa公司。Gateway BP CLONASE Enzyme Mix及Gateway LR CLONASE Enzyme Mix购自Invitrogen公司。LB营养琼脂培养基及LB肉汤培养基购自北京奥博星生物技术有限责任公司。DNA片段纯化回收试剂盒 (QIAquick Gel Extraction Kit) 购自QIAGEN公司。质粒提取试剂盒购自北京全式金生物科技有限公司。琼脂糖凝胶购自GENE TECH公司 (上海)。异丙基-β-D-1-硫代半乳糖吡喃糖苷 (IPTG) 购自Sigma-Aldrich公司。2 kb DNA分子量标准购自New England Biolabs公司。蛋白分子量标准及rTEV 蛋白酶购自海基生物科技有限公司。氨苄青霉素及壮观霉素购自Roche公司。N-三 (羟甲基) 甲基甘氨酸 TRICINE及Pierce Glutathione Magnetic Beads购自Thermo公司。MTS检测试剂盒 (CellTiter96®Aqueous One Solution Reagent) 购自Promega公司。引物序列合成和DNA测序由英潍捷基 (上海) 贸易有限公司完成。
1.2 方法
1.2.1 位点特异性重组引物的设计与合成
根据抗肿瘤多肽AIK编码序列,设计并合成TEV-FLAG-AIK序列。根据Gateway克隆系统引物设计原则,设计并合成含AttB序列的引物。表1所示为引物序列和模板序列。
1.2.2 目的基因片段的获取
以上述合成的TEV-FLAG-AIK为模板,AttB1AIK-F和AttB2AIK-R为引物进行PCR扩增 (具体PCR反应过程如图1B所示)。PCR扩增产物经3%琼脂糖凝胶电泳检测,使用DNA胶回收试剂盒回收目的片段AttB-TEV-FLAG-AIK。
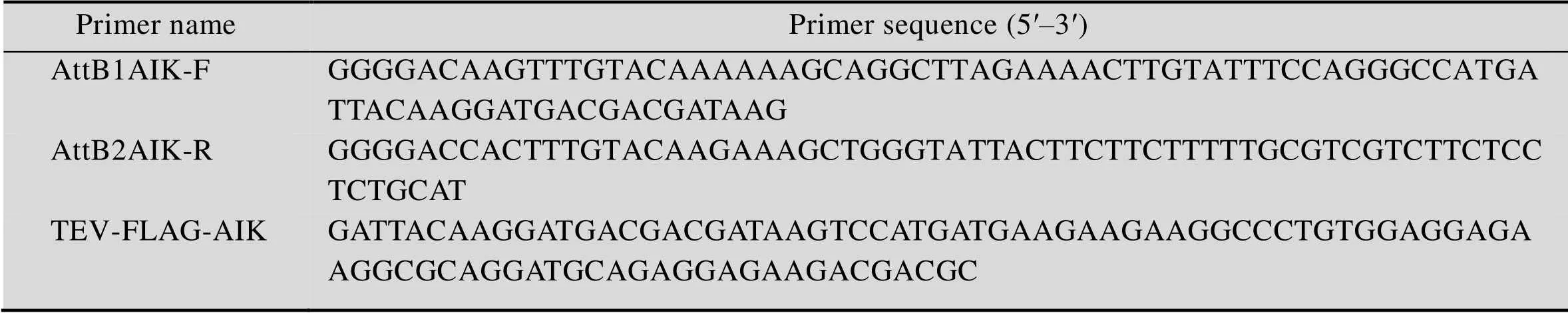
表1 重叠PCR引物序列
1.2.3 AIK入门质粒的构建与鉴定
将回收的目的片段与供体质粒pDONR223按照试剂盒说明书进行BP重组反应 (图2A),反应条件如下:AttB-TEV-FLAG-AIK (10 µL),PDONR223 (2 µL),TE缓冲液 (pH 8.0) (4 µL),BP clonase mix (4 µL)。25 ℃反应12 h。BP反应产物转化感受态Top 10,经壮观霉素抗性筛选,挑取单克隆菌落进行培养,菌液PCR鉴定并送Invitrogen公司测序。经测序验证后,将阳性质粒命名为pDONR223-AIK。
1.2.4 GST-AIK表达质粒的构建与鉴定
将入门质粒pDONR223-AIK与目的质粒pDEST15按照试剂盒说明书进行LR重组反应 (图2A),反应条件如下:pDONR223-AIK (4 µL),pDEST15 (2 µL),TE缓冲液 (pH 8.0) (10 µL),LR clonase mix (4 µL)。25 ℃反应12 h。LR反应产物转化感受态Top10 (在热休克并冰浴后采用无抗生素LB培养基在30 ℃、220 r/min振荡培养2 h)。经氨苄青霉素抗性筛选 (设置细菌培养箱温度为30 ℃),挑取单克隆菌落进行培养,菌液PCR鉴定并送Invitrogen公司测序。经测序验证后,将阳性质粒命名为pDEST15-AIK。
1.2.5 IPTG诱导工程菌表达GST-AIK融合蛋白
将重组表达质粒pDEST15-AIK转化至感受态BL21 (DE3)。次日从平板上随机挑取单菌落,接种于5 mL含氨苄青霉素100 µg/mL的LB液体培养基中,37 ℃、220 r/min振荡培养15 h。将菌液以1∶100的比例转接至30 mL含氨苄青霉素100 µg/mL的LB液体培养基中,37 ℃、220 r/min振荡培养至600为0.6时,取2 mL菌液作为诱导前对照,剩余菌液中加入终浓度为0.5 mmol/L的IPTG,37 ℃、220 r/min继续振荡培养。以此时为0 h,并于2、4、6、8 h分别取出2 mL菌液。将各个时刻取出的菌液10 000 r/min离心1 min,收集菌体,加入 200 µL PBS重悬后,冰浴超声裂解细菌 (超声功率200 W,1 min/次,共3次)。超声后4 ℃、12 000 r/min离心20 min,收集上清并加入50 µL 5×SDS-PAGE上样缓冲液,收集沉淀加入200 µL PBS重悬后加入50 µL 5×SDS-PAGE上样缓冲液。取样进行SDS-PAGE及考马斯亮蓝染色,用灰度扫描 (Li-COR) 分析目的蛋白表达情况。
1.2.6 融合蛋白诱导表达条件的优化
将pDEST15-AIK/BL21 (DE3) 接种于80 mL含氨苄青霉素的LB液体培养基中,37 ℃、220 r/min振荡培养,当600达0.6时,将菌液分为4份并分别加入IPTG至终浓度为0.1、0.3、0.5、 0.7 mmol/L,继续培养。4 h后分别取菌液2 mL,收集菌体,超声裂菌,取上清进行检测。同样的,将pDEST15-AIK/BL21 (DE3) 接种于100 mL含氨苄青霉素的LB液体培养基中,37 ℃、220 r/min振荡培养,当600达0.4时,取20 mL菌液并加入IPTG至终浓度为0.1 mmol/L,继续培养4 h。在600值分别为0.6、0.8、1.0时,采取相同措施。
1.2.7 GST-AIK 融合蛋白的亲和层析
将pDEST15-AIK/BL21 (DE3) 按照优化的诱导表达条件扩大培养至1 L,收集菌体。加入15 mL PBS重悬菌体,冰浴超声裂菌。4 ℃、 12 000 r/min离心20 min,收集上清液。上清液中加入500 µL谷胱甘肽磁珠,4 ℃摇转6 h。磁力架吸附磁珠,弃掉液体,用含0.5% Triton-X-100的结合/洗脱缓冲液洗磁珠3次。
1.2.8 GST-AIK 融合蛋白的rTEV 酶切及其产物纯化
将上述磁珠与20×rTEV缓冲液 (187.5 µL),0.1 mol/L DTT (37.5 µL),rTEV protease (45 µL),ddH2O (3.75 mL) 混合,4 ℃过夜酶切。酶切完成后,磁力架吸附磁珠,去除GST标签。收集液体并移入经预处理的Sep-Pak C18反向离子交换柱 (Waters) 纯化脱盐,40%乙腈洗脱,并冷冻干燥 (Thermo公司),进行Trince-SDS-PAGE (加尿素)[10],考马斯亮蓝染色,灰度扫描 (Li-COR) 分析FLAG-AIK的纯度。
1.2.9 重组AIK活性的鉴定
采用MTS法测定AIK对白血病HL-60细胞的抗肿瘤活性,具体实施方法参见试剂盒说明书。设空白对照组 (只加培养基)、细胞对照组 (只加细胞和培养基,不加AIK) 以及2个实验组。其中一个实验组加入化学合成AIK,浓度为200 µg/mL。另一个实验组加入相同浓度重组AIK。细胞培养箱内培养24 h后测定孔内光密度 ()值,肿瘤细胞生长抑制率 (%)= (1–实验组平均值/对照组平均值)×100%。数据表示为,检验判定差异显著性,<0.05表示差异有统计学意义。
2 结果
2.1 AIK入门载体与GST-AIK原核表达载体的构建及鉴定
利用重叠PCR反应,我们合成了片段长度为187 bp的AttB-TEV-FLAG-AIK 融合基因 (图1A)。对BP重组反应得到的单克隆菌株采用引物AttB1AIK-F和AttB2AIK-R进行PCR验证,PCR产物电泳条带位于100–250 bp之间,与预期产物分子量大小相符 (图2B)。同时,对LR重组反应产物得到的单克隆菌株采用pDEST15的通用测序引物PGEX5和T7Ter进行PCR验证,PCR产物电泳条带位于250–500 bp之间,也与预期产物分子量大小相符 (图2C)。将PCR产物电泳呈阳性的质粒送测序,测序结果表明重组质粒碱基序列正确,表明GST-AIK原核表达载体pDEST15-AIK已成功构建。
2.2 GST-AIK融合蛋白的原核表达
GST蛋白的分子量是26 kDa,AttB-TEV- FLAG-AIK序列对应54个氨基酸残基,编码的蛋白分子量约为6.95 kDa,所以GST-AIK融合蛋白的理论分子量约为33 kDa。0.5 mmol/L IPTG诱导工程菌pDEST15-AIK/BL21 (DE3),在25–35 kDa之间出现一条明显的条带,该条带所示的蛋白分子量与理论值相符,而未加IPTG诱导时无相应条带 (图3A),提示成功地表达了GST-AIK融合蛋白。对菌体超声破碎后的上清和沉淀分别进行SDS-PAGE分析,发现GST-AIK融合蛋白主要存在于上清中 (图3A),提示重组蛋白GST-AIK在BL21 (DE3) 中为可溶性表达。
2.3 GST-AIK诱导表达条件的优化
对起始密度600为0.6时的工程菌pDEST15- AIK/BL21(DE3) 以0.5 mmol/L IPTG诱导不同时间,进行SDS-PAGE检测,发现在2–8 h之间重组蛋白的表达量无明显增加 (图3B)。以不同浓度IPTG诱导工程菌4 h,发现以0.1 mmol/L IPTG所诱导表达的融合蛋白表达量与高浓度诱导组无明显差别 (图3C)。这一结果表明0.1 mmol/L IPTG已经能够很好地诱导重组蛋白的表达。同样,对不同起始密度工程菌以0.1 mmol/LIPTG诱导4 h后,进行SDS-PAGE检测,发现在600值为1.0时开始诱导,融合蛋白表达量与其他组相比明显增多,凝胶灰度扫描显示重组蛋白可占菌体总蛋白的30%以上 (图3D),提示在IPTG诱导浓度及诱导时间固定的情况下,工程菌的诱导起始密度对重组GST-AIK蛋白的表达量影响最大。
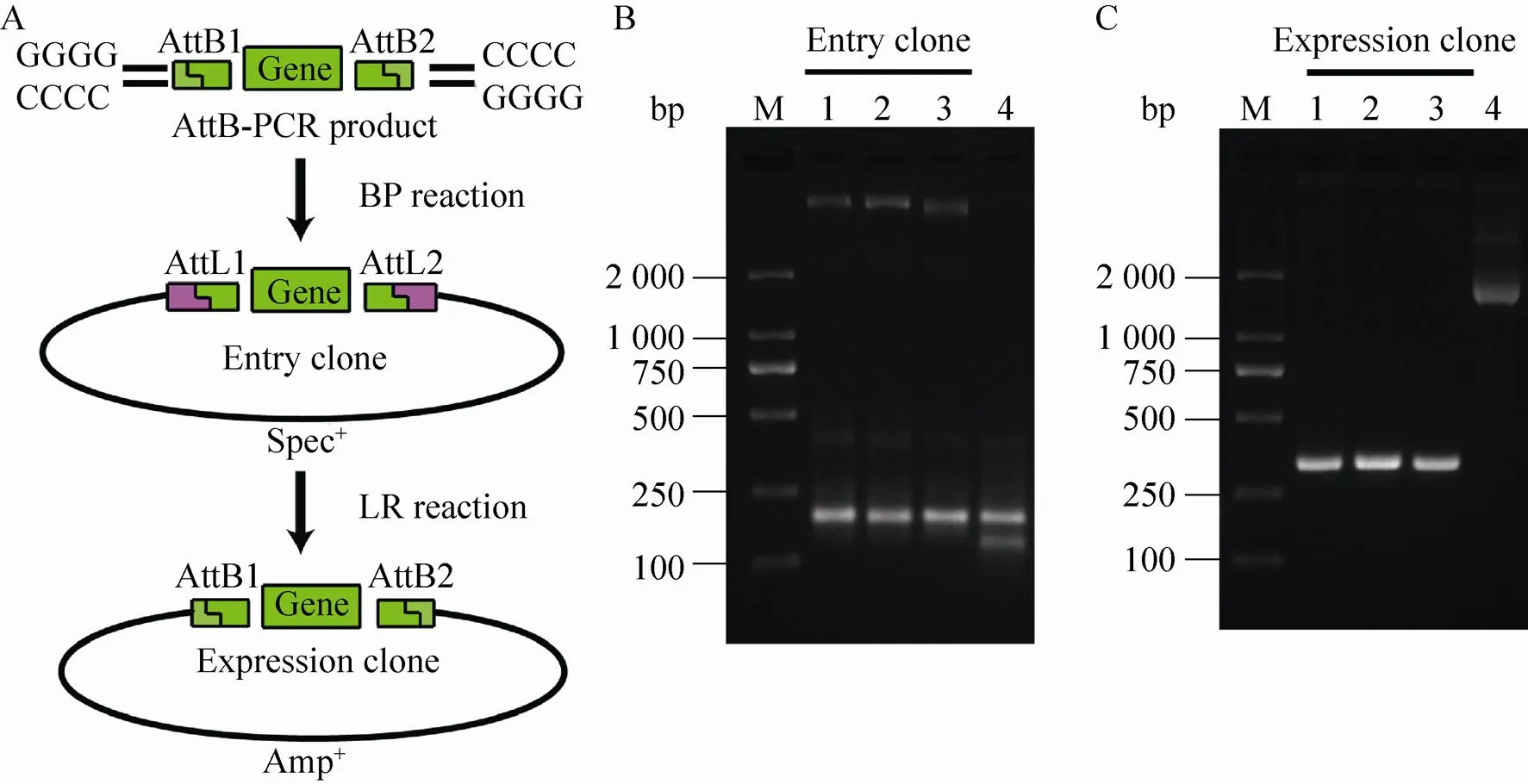
图2 Gateway克隆技术构建重组AIK入门及表达质粒及其菌落PCR鉴定
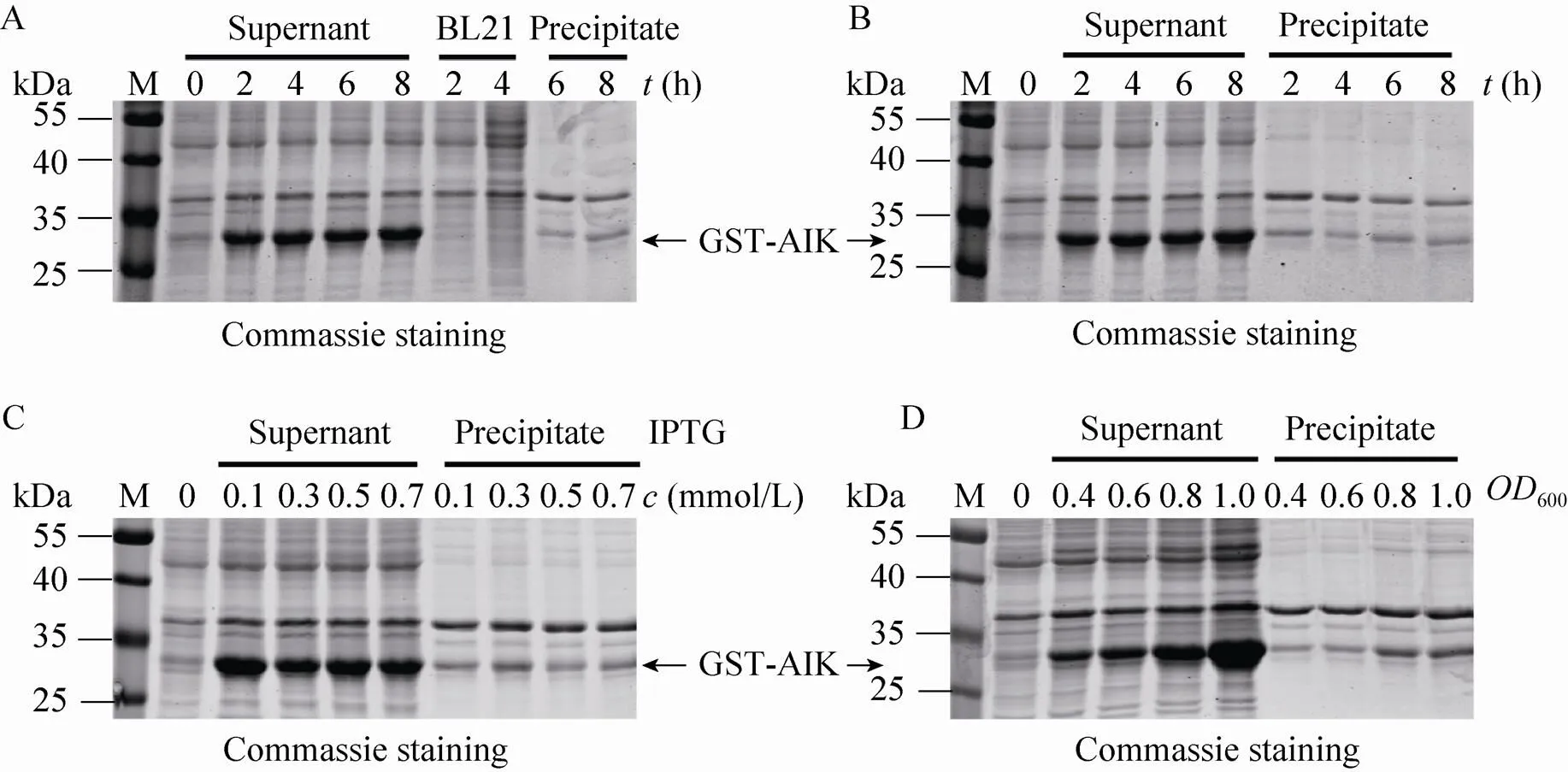
图3 重组GST-AIK蛋白在工程菌中诱导表达条件的优化
2.4 GST-AIK融合蛋白的亲和层析、rTEV酶切及重组AIK的纯化
对谷胱甘肽磁珠纯化的产物进行Trince-SDS-PAGE分析,发现磁珠亲和层析后在35 kDa附近出现一条清晰的条带,且无明显杂蛋白条带 (图4)。这表明磁珠亲和层析方法纯化效果理想,GST-AIK融合蛋白被富集纯化。rTEV酶切后,在25 kDa附近与10–15 kDa之间分别出现一条清晰的蛋白条带,且无其他杂带出现 (图4)。这一结果表明,rTEV酶切成功切除GST蛋白标签,且酶切效率较高。向rTEV酶切后的混合物中,加入新的谷胱甘肽磁珠,以彻底去除GST蛋白残留,对所剩液体进行SDS-PAGE检测,发现只在10–15 kDa之间出现一条清晰的条带 (图4),表明成功去除GST蛋白标签,获得了高纯度的FLAG-AIK重组蛋白,凝胶灰度扫描提示其纯度大于95%。
2.5 重组AIK的生物活性测定
将化学合成AIK与纯化后的重组FLAG-AIK分别以200 µg/mL处理HL-60细胞24 h后,MTS结果显示化学合成AIK组与重组FALG-AIK组的细胞生长抑制率分别为(62.33±4.75)%和(54.45±7.65)%,两处理组之间的差异无统计学意义>0.05 (图5),说明纯化的重组AIK基本保留了它原有的抗瘤活性。
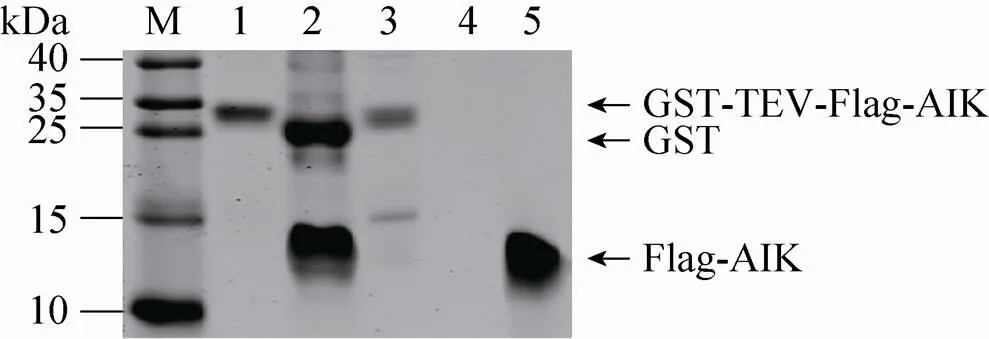
图4 Tricine SDS-PAGE检测不同纯化阶段产物
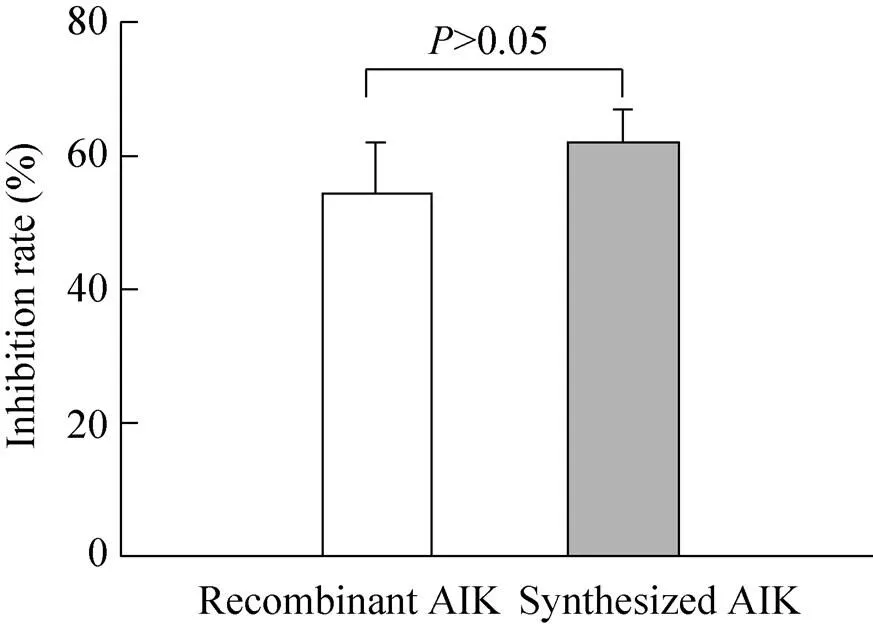
图5 纯化的重组AIK具有抗肿瘤活性
3 讨论
目前,国内外研发的小分子抗瘤肽主要来源于天然产物 (如来源于哺乳动物细胞的LTX-302[11]、来源于植物的Cr-ACP1[12]、来源于海洋生物的Kahalalide F[13]) 和人工多肽 (如来源于肽库的TMTP1[14]和化学合成的TZT-1027[15])。从制备上看,抗瘤肽主要通过从动植物体内直接提取纯化、化学合成和基因工程大规模制备。化学合成过程复杂,消耗高昂,不利于大规模制备。而基因工程技术不仅可以大量获得从天然来源中难以得到的生物活性肽,也可以加工改造现有多肽的结构,提高其生物活性。除此之外,基因工程技术的蛋白表达量高,技术成熟,方法简便、经济,是目前重组蛋白大规模生产的主要手段。
重组蛋白表达的第一步工作是克隆目的多肽基因。Gateway克隆系统[16]是一种基于λ噬菌体位点特异性重组特性的克隆方法,不需要使用限制性内切酶和连接酶,仅由BP反应及LR反应两部分即可完成任一基因的克隆和表达载体的构建。该系统最大的特点是能够一次性将人类基因表达文库从一种表达系统穿梭到另一表达系统中,为以蛋白表达为基础的高通量筛选提供有效方法[17-20]。利用该系统我们成功构建了GST-AIK融合蛋白的原核表达质粒。该质粒的成功构建不仅为重组AIK在大肠杆菌中的表达奠定了基础,而且能继续通过Gateway克隆系统实现AIK基因在各种原核或真核表达载体间的转移,为AIK的功能研究提供了便利条件。
由于AIK仅含有25个氨基酸,我们采用GST融合蛋白的形式表达,既有利于后续的分离纯化,又可以防止小分子肽AIK被宿主菌体内的蛋白酶降解,保护了表达蛋白的生物活性。以往研究表明,工程菌的诱导温度、诱导时间、IPTG诱导浓度及工程菌的诱导起始密度均可影响重组蛋白的产量及在菌体中的存在形式。因此,优化融合蛋白的表达条件十分必要。为了避免包涵体的形成,影响后续的纯化及重组蛋白的生物活性,多数重组蛋白诱导表达都是在较低温度下进行的[21-22]。本研究发现,在37 ℃下对工程菌进行诱导,重组蛋白GST-AIK主要以可溶形式存在,因此在接下来的诱导过程中诱导温度均采用37 ℃。有些重组蛋白如人源RNase L,在大肠杆菌中诱导表达时,会对宿主菌产生毒性,抑制大肠杆菌的生长繁殖[23-24]。我们发现IPTG诱导工程菌2 h与8 h时的GST-AIK表达量没有明显差别,这一现象可能是由于重组蛋白GST-AIK的过度表达对宿主菌产生毒性。因此,后续试验中均采用较短时间 (4 h) 诱导重组蛋白GST-AIK的表达。我们又比较了IPTG浓度对诱导蛋白表达量的影响,发现在所检测的IPTG 浓度范围内,GST-AIK的表达量没有明显增加。因此,0.1 mmol/L IPTG已经能够很好地诱导重组蛋白的表达。同时,较低的IPTG诱导浓度也节省了重组蛋白生产过程中的经济成本。最终,我们发现工程菌的诱导时机是影响重组蛋白表达量的最重要因素。当工程菌起始密度达到1.0 (600) 时加入0.1 mmol/L IPTG诱导4 h,即可使融合蛋白的产量占菌体总蛋白的30%以上,而且,表达的融合蛋白90%以上是以可溶形式存在(图3D)。
原核表达系统的一个缺点就是容易污染宿主蛋白,而这些宿主蛋白是对人或动物有害的内毒素,因此原核表达系统对重组蛋白的纯化技术要求比较高。大量研究证实,亲和层析技术是分离纯化重组蛋白质的最佳方法。如果将一些亲和性标签构建到重组融合蛋白中,能便于用亲和层析来纯化重组蛋白。因此,本课题设计的融合蛋白由三部分组成:GST标签蛋白、FLAG标签多肽及紧跟其后的AIK多肽,在两个标签之间还包含一个TEV蛋白酶的酶切位点 (图1)。首先,在大肠杆菌BL21内表达融合蛋白GST-AIK,菌体裂解后上清液中的融合蛋白GST-AIK将通过谷胱甘肽-S-转移酶 (GST)与谷胱甘肽 (GSH) 磁珠表面偶联的谷胱甘肽特异性结合,进行第一次亲和层析。将磁珠上的非特异性结合蛋白洗脱后,加入rTEV蛋白酶,含有TEV蛋白酶酶切位点的融合蛋白就能被特异性剪切和洗脱下来。最后将含有重组AIK混合物的洗脱液利用谷胱甘肽磁珠再次进行亲和层析,以去除GST和GST-AIK。经过两步亲和层析,最大限度地去除了非特异性结合蛋白。
然而,在对纯化的重组AIK进行凝胶电泳检测的过程中,我们发现其凝胶表观分子量在10–15 kDa之间 (图4),大于其理论分子量 (约3.5 kDa)。在SDS-PAGE中,大部分蛋白的凝胶表观分子量与其理论分子量是相符的,但是也经常会出现两者有一定差别的现象。这一现象通常与该蛋白的氨基酸组成、构象或者翻译后修饰 (如磷酸化、泛素化、糖基化) 等有关。有报道[25]称His-tag中因连续的6个组氨酸而带有较强的正电荷,会改变蛋白在SDS-PAGE中的泳动行为,降低蛋白的泳动速率,最终导致凝胶表观分子量的变大。据此推测,重组AIK在凝胶电泳中出现在大于其理论分子量的位置是因为AIK中的7个赖氨酸和10个精氨酸均带有较强的正电荷。
纯化的重组蛋白是否能保留其应有的生物活性是基因工程大规模生产时必须要考虑的因素。MTS实验表明以200 µg/mL重组AIK处理白血病细胞HL-60,24 h后其细胞抑制率与相同浓度化学合成AIK相当 (图5),说明我们从大肠杆菌中纯化的重组AIK保持了它应有的生物活性。
总之,本研究通过Gateway克隆技术建立了抗瘤肽AIK的原核表达系统,优化了表达条件,建立了一种简易、经济的生物工程方法来大规模制备重组AIK,为AIK的后续功能研究和肿瘤治疗应用奠定了基础。
[1] Zhang R, Lao XZ, Zheng H. Research progress on small-molecule antitumor peptides. Amino Acids Biotic Resour, 2012, 34(4): 42–46 (in Chinese).张冉, 劳兴珍, 郑珩. 抗肿瘤小分子多肽的研究进展. 氨基酸和生物资源, 2012, 34(4): 42–46.
[2] Zhao R, Meng QY, Deng X, et al. Research progress on peptides as antitumor agent. Strait Pharmac J, 2012, 24(10): 4–8 (in Chinese).赵锐, 孟庆义, 邓欣, 等. 多肽抗肿瘤化合物的研究进展. 海峡药学, 2012, 24(10): 4–8.
[3] Oyston PCF, Fox MA, Richards SJ, et al. Novel peptide therapeutics for treatment of infections. J Med Microbiol, 2009, 58(Pt 8): 977–987.
[4] Wu DD, Gao YF, Qi YM, et al. Peptide-based cancer therapy: opportunity and challenge. Cancer Lett, 2014, 351(1): 13–22.
[5] Alberici L, Roth L, Sugahara KN, et al.design of a tumor-penetrating peptide. Cancer Res, 2013, 73(2): 804–812.
[6] Zahid M, Lu X, Mi Z, et al. 4-Cationic and tissue-specific protein transduction domains: identification, characterization, and therapeutic application. Adv Genet, 2010, 69: 83–95.
[7] Fan FF, Xu H, Sun HY, et al. Antitumor activity of a novel synthetic cationic peptide AIK: a preliminary observation. Chin J Cancer Biother, 2014, 21(6): 617–623 (in Chinese). 范芳芳, 徐晖, 孙慧莹, 等.新人工阳离子多肽AIK抗肿瘤活性的初步研究. 中国肿瘤生物治疗杂志, 2014, 21(6): 617–623.
[8] Lee JY, Kang SK, Li HS, et al. Production of recombinant human growth hormone conjugated with a transcytotic peptide infor effective oral protein delivery. Mol Biotechnol, 2015, 57(5): 430–438.
[9] Rosano GL, Ceccarelli EA. Recombinant protein expression in: advances and challenges. Front Microbiol, 2014, 5: 172.
[10] Schägger H. Tricine-SDS-PAGE. Nat Protoc, 2006, 1(1): 16–22.
[11] Berge G, Eliassen LT, Camilio KA, et al. Therapeutic vaccination against a murine lymphoma by intratumoral injection of a cationic anticancer peptide. Cancer Immunol Immunother, 2010, 59(8): 1285–1294.
[12] Mandal SM, Migliolo L, Das S, et al. Identification and characterization of a bactericidal and proapoptotic peptide fromseeds with DNA binding properties. J Cell Biochem, 2012, 113(1): 184–193.
[13] Martin-Algarra S, Espinosa E, Rubió J, et al. Phase II study of weekly Kahalalide F in patients with advanced malignant melanoma. Eur Cancer, 2009, 45(5): 732–735.
[14] Yang WH, Luo DF, Wang SX, et al. TMTP1, a novel tumor-homing peptide specifically targeting metastasis. Clin Cancer Res, 2008, 14(17): 5494–5502.
[15] Riely GJ, Gadgeel S, Rothman I, et al. A phase 2 study of TZT-1027, administered weekly to patients with advanced non-small cell lung cancer following treatment with platinum-based chemotherapy. Lung Cancer, 2007, 55(2): 181–185.
[16] Hartley JL, Temple GF, Brasch MA. DNA cloning usingsite-specific recombination. Genome Res, 2000, 10(11): 1788–1795.
[17] Lamesch P, Li N, Milstein S, et al. hORFeome v3.1: a resource of human open reading frames representing over 10 000 human genes. Genomics, 2007, 89(3): 307–315.
[18] Emanuele MJH, Elia AE, Xu QK, et al. Global identification of modular cullin-RING ligase substrates. Cell, 2011, 147(2): 459–474.
[19] Walhout AJM, Temple GF, Brasch MA, et al. GATEWAY recombinational cloning: application to the cloning of large numbers of open reading frames or ORFeomes. Methods Enzymol, 2000, 328: 575–592.
[20]interactome mapping consortium evidence for network evolution in aninteractome map. Science, 2011, 333(6042): 601–607.
[21] Yu H, Ma Q, Lin J, et al. Expression and purification of GST-FHL2 fusion protein. Genet Mol Res, 2013, 12(4): 6372–6378.
[22] Rabhi-Essafi I, Sadok A, Khalaf N, et al. A strategy for high-level expression of soluble and functional human interferon α as a GST-fusion protein in. Protein Eng Des Sel, 2007, 20(5): 201–209.
[23] Gupta A, Rath PC. Expression, purification and characterization of the interferon-inducible, antiviral and tumour-suppressor protein, human RNase L. J Biosci, 2012, 37(1): 103–113.
[24] Pandey M, Rath PC. Expression of interferon-inducible recombinant human RNase L causes RNA degradation and inhibition of cell growth in. Biochem Biophys Res Commun, 2004, 317(2): 586–597.
[25] Tang WH, Zhang JL, Wang ZY, et al. The cause of deviation made in determining the molecular weight of His-tag fusion proteins by SDS-PAGE. Acta Phytophysiol Sin, 2000, 26(1): 64–68 (in Chinese).唐威华, 张景六, 王宗阳, 等. SDS-PAGE法测定His-tag 融合蛋白分子量产生偏差的原因. 植物生理学报, 2000, 26(1): 64–68.
(本文责编 郝丽芳)
Expression, purification of recombinant cationic peptide AIK inand its antitumor activity
Fangfang Fan, Huiying Sun, Hui Xu, Jiawei Liu, Haiyuan Zhang, Yilan Li, Xuelian Ning, Yue Sun, Jing Bai, Songbin Fu, and Chunshui Zhou
Laboratory of Medical Genetics, Harbin Medical University, Harbin 150081, Heilongjiang, China
AIK is a novel cationic peptide with potential antitumor activity. In order to construct the AIK expression vector by Gateway technology, and establish an optimal expression and purification method for recombinant AIK, a set of primers containing AttB sites were designed and used to create the AttB-TEV-FLAG-AIK fusion gene by overlapping PCR. The resulting fusion gene was cloned into the donor vector pDONR223 by attB and attP mediated recombination (BP reaction), then, transferred into the destination vector pDEST15 by attL and attR mediated recombination (LR reaction). All the cloning was verified by both colony PCR and DNA sequencing. The BL21transformed by the GST-AIK expression plasmid was used to express the GST-AIK fusion protein with IPTG induction and the induction conditions were optimized. GST-AIK fusion protein was purified by glutathione magnetic beads, followed by rTEV cleavage to remove GST tag and MTS assay to test the growth inhibition activity of the recombinant AIK on human leukemia HL-60 cells. We found that a high level of soluble expression of GST-AIK protein (more than 30% out of the total bacterial proteins) was achieved upon 0.1 mmol/L ITPG induction for 4 h at 37 °C in the transformed BL21with starting600at 1.0. Through GST affinity purification and rTEV cleavage, the purity of the resulting recombinant AIK was greater than 95%. And the MTS assays on HL-60 cells confirmed that the recombinant AIK retains an antitumor activity at a level similar to the chemically synthesized AIK. Taken together, we have established a method for expression and purification of recombinant AIK with a potent activity against tumor cells, which will be beneficial for the large-scale production and application of recombinant AIK in the future.
cationic peptide, site-specific recombination, GST fusion protein, inducible expression, affinity purification, antitumor activity
February 4, 2015; Accepted:April 7, 2015
Chunshui Zhou. Tel: +86-451-86674798; E-mail: Zhoucs@ems.hrbmu.edu.cn
10.13345/j.cjb.150072
Supported by:National Natural Science Foundation of China (No. 81272582).
国家自然科学基金 (No. 81272582) 资助。
2015-06-08
http://www.cnki.net/kcms/detail/11.1998.Q.20150608.1414.001.html

