比较不同血清型AAV携带HBV基因组建立乙肝小鼠模型效果
朱欣瑶,周庆璋,田文洪,刘春国,,董小岩,吴小兵,,喻长远
比较不同血清型AAV携带HBV基因组建立乙肝小鼠模型效果
朱欣瑶1,周庆璋2,3,田文洪2,刘春国1,3,董小岩3,吴小兵1,3,喻长远1
1 北京化工大学生命科学与技术学院,北京 102600 2 吉林大学生命科学学院,吉林长春 130012 3 北京五加和分子医学研究所,北京 100176

朱欣瑶, 周庆璋, 田文洪, 等. 比较不同血清型AAV携带HBV基因组建立乙肝小鼠模型效果. 生物工程学报, 2015, 31(12): 1764–1772.Zhu XY, Zhou QZ, Tian WH, et al. Comparison of HBV persistent infection mice models by different serotypes of AAVs carrying HBV genomes. Chin J Biotech, 2015, 31(12): 1764–1772.
近年来,用8型腺相关病毒携带1.3拷贝HBV (Hepatitis B virus) 基因组建立的HBV持续感染小鼠模型受到越来越多的关注。本研究比较了除AAV8之外的其他4种血清型重组腺相关病毒 (Recombinant adeno-associated virus,rAAV) 建立乙肝小鼠模型效果。首先,将携带1.3拷贝ayw亚型HBV基因组的1型、2型、5型、8型、9型腺相关病毒分别以1×1011vg/只(Viral genome,vg) 的剂量尾静脉注射C57BL/6J小鼠;利用 ELISA 方法监测小鼠血清中HBeAg和HBsAg表达水平;用定量PCR方法检测小鼠血清和肝脏中 HBV DNA 拷贝数;用免疫组化方法检测小鼠肝脏中HBcAg的表达;用HE染色检测小鼠肝脏病理变化。结果显示,在持续8周中,5组小鼠血清中都检测到HBeAg和HBsAg的表达,血清和肝脏中均检测到HBV DNA的存在。HBeAg、HBsAg、HBV DNA表达水平高低依次为AAV8>AAV9>AAV1>AAV5>AAV2。5组小鼠用免疫组化方法都检测到肝脏中HBcAg表达,HE染色病理检测均观察到不同程度的肝损伤。本研究扩大了能用于建立乙肝小鼠持续感染模型可选择的AAV载体种类,发现虽然AAV1、2、5、9的建模效果不如AAV8,但它们都可以介导建立持续感染的乙肝小鼠模型,建模效果依次为AAV8>AAV9>AAV1>AAV5>AAV2。其中AAV9介导的建模效果与AAV8载体最为接近,可以替代AAV8载体用于有效地建立HBV持续感染的小鼠模型。
动物模型,乙型肝炎病毒,AAV,持续感染
乙型病毒性肝炎是由乙肝病毒(Hepatitis B virus,HBV) 引起的、以肝脏炎性病变为主并可引起多器官功能障碍的传染病。世界范围内曾感染过HBV的人数约为20亿,慢性HBV感染者有3.5亿,每年约有100万人死于HBV感染所致的肝衰竭、肝硬化和肝癌(Hepatocellular carcinama,HCC)[1]。建立HBV感染的动物模型,对于探索乙肝感染发病机制、研究和筛选乙肝药物、寻找有效的防治方法,具有重要的意义。
HBV转基因小鼠模型一直是研究乙肝致病、致癌机制及抗HBV药物研究的重要工具[2-6]。但是,这种模型存在明显缺陷。其一,由于HBV基因组DNA是整合于模型鼠染色体中的,而不是存在于染色体外的cccDNA (Covalently closed circular DNA) 形式[7],与HBV病毒在人体肝脏的感染状况和复制模式有明显差异;其二,模型动物之间HBV抗原表达水平和血液中的HBV病毒载量的个体差异较大。因此有必要建立更好的HBV感染动物模型。
2010年董小岩研究组利用携带1.3拷贝HBV基因组的8型腺相关病毒(rAAV8-1.3HBV) 成功建立了一种持续感染的HBV小鼠模型,并广泛应用于各种研究中[8-11]。该模型不仅成模效率高,HBV感染维持时间长,而且具有可在肝细胞中形成类似HBV cccDNA结构的特点,为HBV持续感染机制与抗病毒药物筛选等研究提供了新的动物模型。
AAV8可用于建立持续感染的HBV小鼠模型,但未曾有报道除AAV8以外其他血清型AAV载体是否也能建立HBV小鼠模型,以及建模的效果。为此,本研究制备rAAV1-1.3HBV、rAAV2-1.3HBV、rAAV5-1.3HBV、rAAV8-1.3HBV、rAAV9-1.3HBV等5种病毒携带1.3个拷贝HBV基因组的不同血清型AAV病毒,通过尾静脉注射至免疫功能正常的C57BL/6J小鼠,研究除AAV8外其他血清型AAV载体是否能够建立HBV小鼠模型,若能建立HBV小鼠模型,则进一步比较各组小鼠建模的效果。
1 材料与方法
1.1 材料
rAAV1-1.3HBV、rAAV2-1.3HBV、rAAV5- 1.3HBV、rAAV8-1.3HBV与rAAV9-1.3HBV均由北京五加和分子医学研究所有限公司制备和提供;4−6周龄雄性C57BL/6J小鼠购自北京华阜康生物科技股份有限公司;DMEM培养基购自北京清大天一生物技术有限公司;胎牛血清、Lipofectamine®2000购自Invitrogen公司;血清 HBeAg、HBsAg检测试剂盒购自北京万泰生物药业股份有限公司;HBeAg、HBsAg标准品购自北京康彻思坦生物技术有限公司;乙肝病毒核酸扩增荧光定量检测试剂盒(PCR-荧光探针法) 购自上海科华生物工程股份有限公司;组织基因组DNA提取试剂盒购自天根生化科技(北京) 有限公司;鼠抗HBcAg、鼠抗HBsAg、酶标羊抗小鼠/兔IgG、DAB显色剂购自北京中杉金桥生物技术有限公司。
1.2 动物实验
采用定量PCR法测定rAAV1-1.3HBV、rAAV2-1.3HBV、rAAV5-1.3HBV、rAAV8-1.3HBV与rAAV9-1.3HBV等5种重组病毒的基因组滴度,通过尾静脉注射至C57BL/6J小鼠,注射剂量为 1×1011vg/只,对照小鼠注射相同体积的PBS (小鼠随机分为6组,每组3只)。在注射病毒第2、4、8周后,对每只小鼠分别进行尾静脉采血,分离血清。8周后采用眼球取血法取全血,用颈椎脱臼法处死动物取肝脏,肝脏分为两部分,一部分液氮速冻保存在–80 ℃,一部分保存在10%福尔马林中。所有实验操作程序均经过实验动物使用管理委员会批准。
1.3 血清中HBeAg、HBsAg检测
小鼠取血后室温放置2 h,4 ℃过夜,第二天3 000 r/min离心10 min取血清。将注射病毒后第2、4、8周各组小鼠血清稀释一定倍数,按照 HBeAg、HBsAg诊断试剂盒(酶联免疫法) 说明书操作,测定450。根据血清标准品作标准曲线,定量测定血清中HBeAg和HBsAg的表达。
1.4 定量PCR法检测HBV DNA拷贝数
提取肝脏和血清全基因组DNA,使用乙肝病毒核酸扩增荧光定量检测试剂盒确定肝脏组织和血清中的HBV DNA拷贝数。
1.5 免疫组化检测HBcAg
采用组织芯片(TMAs) 列阵进行免疫组化检测,通过设计组织芯片,HE切片镜下划片,制备组织芯片空白蜡块模、比照切片组织蜡块取点、植入取出组织芯、包埋组织芯片蜡块、组织芯片切片、按照常规方法进行病毒抗原 HBcAg 的免疫组化检测。用阿拉伯数字表示细胞HBcAg阳性表达强度,0为无表达,1为低表达,2为中等程度表达,3为高表达。每组注射病毒小鼠选取一张代表性免疫组化切片,观察5个视野(Bars=2 µm) 中细胞HBcAg表达情况,计算HBcAg阳性细胞数(表达强度不小于1) 占总细胞数的比例。
1.6 肝脏组织病理学分析
从小鼠体内取新鲜肝脏组织,10%甲醛固定,石蜡包埋,常规方法制备组织病理切片,HE染色,观察rAAV1-1.3HBV、rAAV2-1.3HBV、rAAV5-1.3HBV、rAAV8-1.3HBV、rAAV9-1.3HBV与PBS组小鼠肝脏组织病理改变并拍照分析。
1.7 统计学分析
应用SPSS软件对检测数据进行统计分析,采用Wilcoxon秩和检验,<0.05具有统计学意义。
2 结果与分析
2.1 比较注射不同病毒小鼠中HBeAg和HBsAg表达
携带HBV基因组的不同血清型AAV载体分别注射至小鼠体内,不同时间点采血检测小鼠血清中HBeAg和HBsAg的表达情况。结果显示,注射病毒2、4、8周后,各组小鼠血清中均检测到HBeAg和HBsAg的表达,且持续8周都为阳性,而对照PBS组则均为阴性(图1)。各组小鼠(除PBS组) 血清中的HBeAg和HBsAg表达与时间呈正相关,AAV8组增长较快,AAV1、2、5、9组增长平缓;且各组HBeAg和HBsAg表达均在8周后达到检测中的最大值。注射病毒8周后AAV1、2、5、8、9组小鼠血清中HBeAg的检测值(均值) 分别为182.6、8.5、91.8、573.6、333.8 NCU/mL;HBsAg的检测值(均值) 分别为461.8、40.3、395.7、 9 725.3、4 928.1 IU/mL。比较相同时间点(注射病毒后2,4,8周) AAV1、2、5、9组与AAV8组小鼠模型中HBeAg 和HBsAg表达情况,发现AAV8组的HBeAg和HBsAg的表达效果高于其他4组,差异具有统计学意义(<0.05)。根据实验结果,5组小鼠HBeAg和HBsAg由高到低排序为AAV8、AAV9、AAV1、AAV5、AAV2。
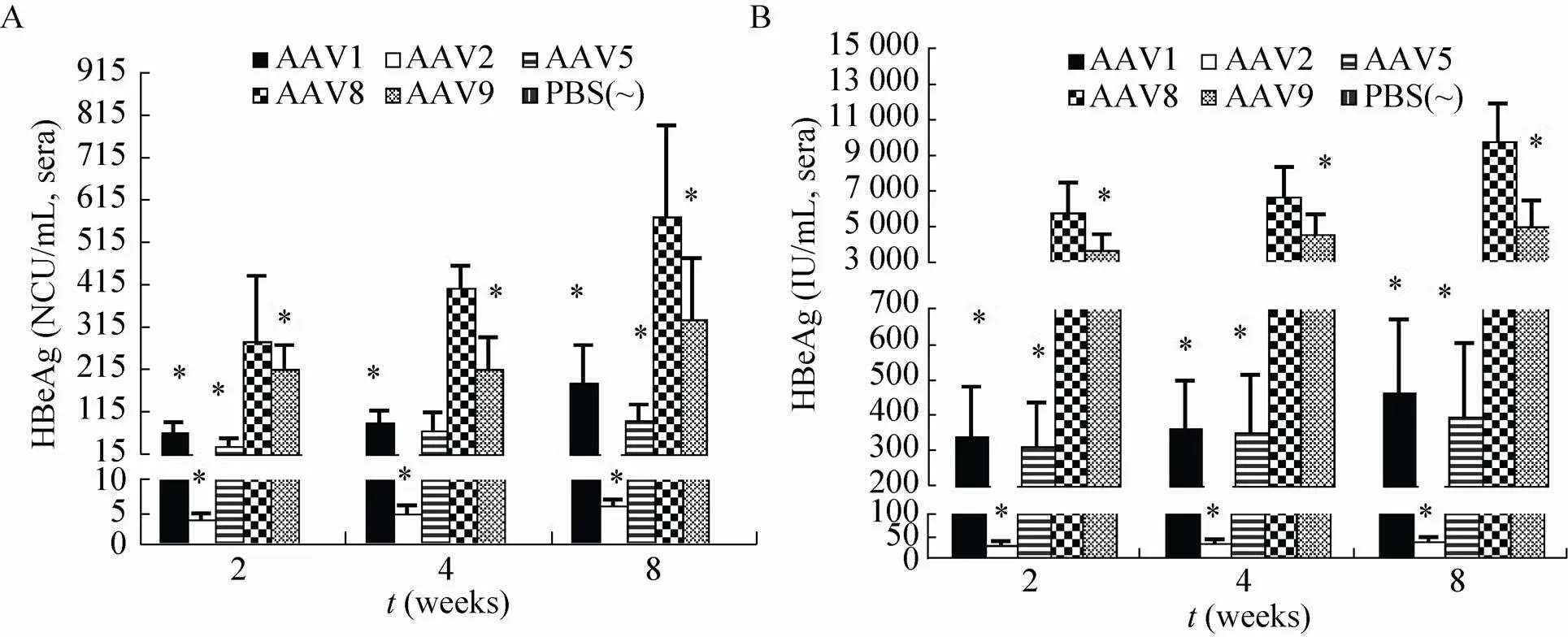
图1 小鼠血清中HBeAg和HBsAg表达情况
2.2 小鼠血清和肝脏中HBV DNA拷贝数
提取肝脏和血清中的基因组DNA,测定血清和肝脏中的HBV DNA 拷贝数,结果如图2所示。AAV1、2、5、8、9组小鼠血清中HBV DNA拷贝数(均值) 分别为2.5×103、1.2×103、1.4×103、1.5×106和6.7×104copies/mL;肝脏中分别为3.3×107、1.2×107、2.0×107、4.0×108和7.6×107copies/g肝组织。在血清和肝脏HBV DNA检测中,PBS、AAV1、2、5、9组与AAV8组差异均具有统计学意义,AAV8 组小鼠血清及肝脏HBV DNA表达高于其他组。其中小鼠肝脏HBV DNA拷贝数均大于血清中HBV DNA拷贝数。血清和肝脏HBV DNA拷贝数由高到低排序为AAV8、AAV9、AAV1、AAV5和AAV2。
2.3 肝脏中HBcAg的表达
对小鼠肝脏进行HBcAg免疫组化,选取各组代表性结果,显示注射病毒组小鼠肝脏中均能检测到HBcAg高表达细胞,PBS组为阴性(图3)。但HBcAg表达阳性细胞数所占比例存在差异,AAV1组约为40.0%,AAV2组约为34.9%,AAV5组约为10.1%,AAV8组约为70.9%,AAV9组约为62.9% (表1)。AAV8组最高,其他组均低于AAV8组。
2.4 小鼠肝脏病理分析
8周后处死各组小鼠,取肝脏组织,HE染色进行病理切片分析,结果如图4所示。病理结果表明,注射病毒的5组小鼠均有肝细胞肿胀、变性、坏死(细胞核固缩和胞浆脓染) 和炎细胞浸润的现象。但5组小鼠肝细胞病变程度有所差异,其中AAV8和AAV1组都可见肝细胞高度肿胀、局灶性坏死;AAV9和AAV5组可见肝细胞中度肿胀, 小灶性坏死;AAV2组肝细胞轻度肿胀,偶见肝细胞坏死。

图2 小鼠血清及肝脏中HBV DNA拷贝数
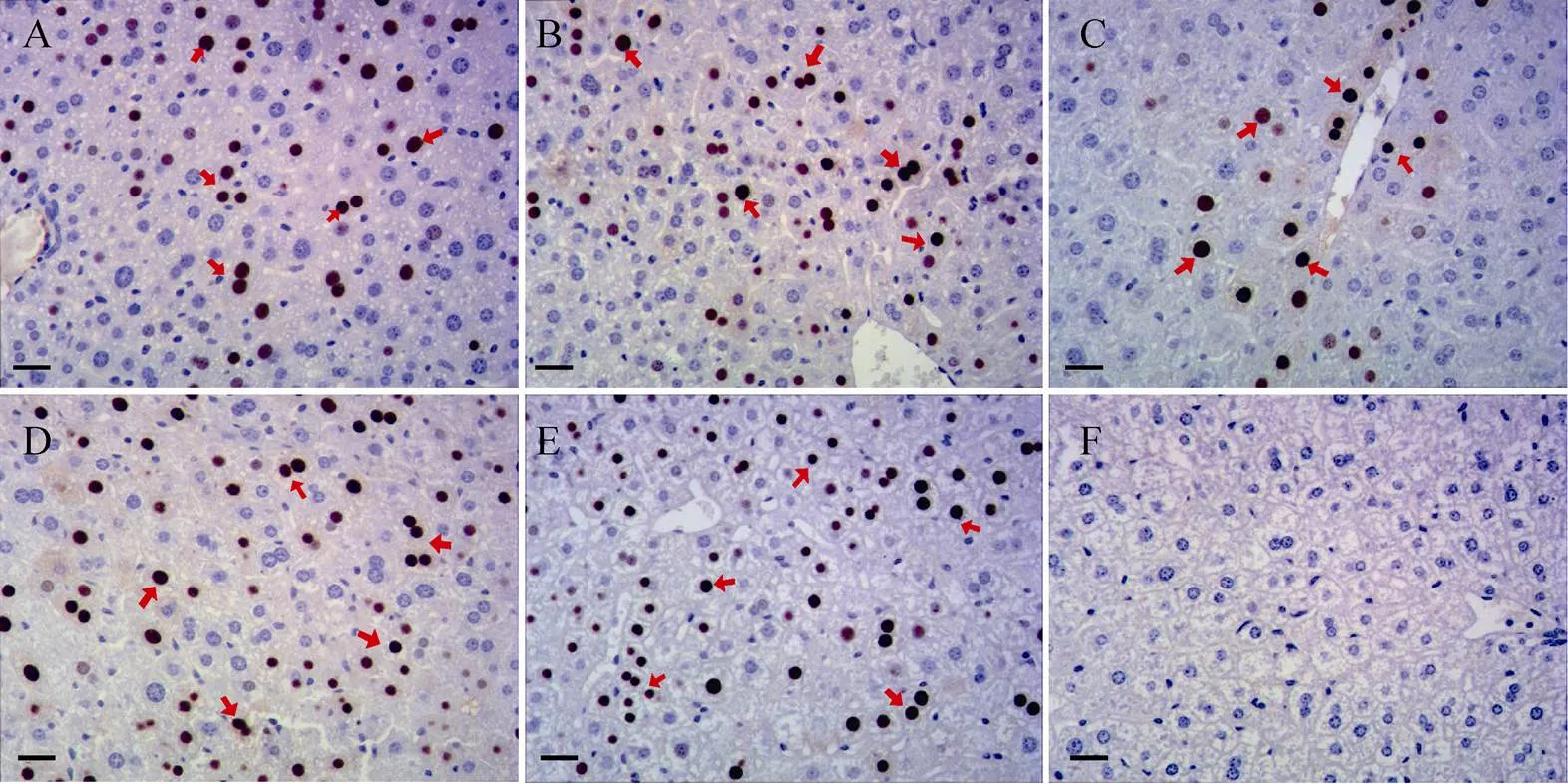
图3 免疫组化检测肝脏组织中HBcAg的表达

表1 注射病毒小鼠肝脏中HBcAg阳性细胞数占总细胞数百分比

图4 小鼠肝脏病理分析
3 讨论
2010年,董小岩等[8]制备了携带1.3拷贝HBV基因组的重组8型腺相关病毒(rAAV8-1.3HBV),经尾静脉注射至具有正常免疫功能C57BL/6小鼠,检测到小鼠持续表达HBeAg、HBsAg 10周以上,且发现肝细胞中形成类似HBV cccDNA的结构,成功获得持续感染HBV的小鼠模型。此后,rAAV8-1.3HBV建立的持续感染的乙肝小鼠模型得到越来越多的应用。王刚等[9]研究发现除C57BL/6小鼠外,使用rAAV8-1.3HBV也可造成BALB/c小鼠HBV持续感染。王国婧等[10]利用rAAV8-1.3HBV建立的HBV持续感染小鼠模型评价核苷酸类似物抗病毒药物的抗病毒效果。Yang等[11]使用该模型研究免疫耐受诱导的HBV感染。
利用AAV8的高嗜肝性已成功建立HBV持续感染小鼠模型,但未曾有报道除AAV8外其他血清型AAV载体是否也能建立HBV小鼠模型,以及建模的效果。因此本研究探索了AAV1、2、5、9等4种血清型AAV载体携带HBV基因组静脉注射小鼠能否建立HBV持续感染模型并比较建模效果。
本研究发现,注射1、2、5、8、9等5种不同AAV 载体血清型重组病毒的小鼠实验组,血清中HBeAg和HBsAg持续表达8周以上,并且在8周处死动物时采取的血清和肝脏样品中,均可以检测到HBV DNA。这表明,用携带HBV基因组的AAV载体制备乙肝持续感染模型并不是8型AAV载体所特有的,用其他血清型的AAV载体也能获得HBeAg和HBsAg的持续表达,并在血清和肝脏中检测到HBV DNA。
然而,从血清HBeAg和HBsAg表达水平以及血清和肝脏中HBV DNA水平来看,不同血清型AAV载体由高到低排序均为AAV8>AAV9>AAV1>AAV5>AAV2。表明携带HBV基因组的不同血清型AAV载体静脉注射小鼠的建模效果有明显差异。这种差异可能主要是由于不同AAV载体具有不同的组织嗜性。首先,静脉注射的AAV病毒都会随血流汇聚至肝脏,因此都具有一定的肝聚集效应。其次,不同血清型的AAV病毒对肝细胞的转导效率决定了其导入HBV DNA和表达的效率。AAV8在目前应用的AAV载体中嗜肝性最强,携带目的基因的载体在动物体内可以形成稳定的肝脏转染[12-17],这可能是注射rAAV8-1.3HBV的小鼠表达HBeAg、HBsAg以及产生HBV 病毒效果最好的原因。Zincarelli等[18]观察到携带荧光素酶基因的AAV9载体在小鼠肝、心、脾、肺、肾的分布情况,发现目的基因在肝脏表达最好,但其效果仅略强于心脏,说明AAV9载体对肝脏有比较好的嗜性。AAV1对肌肉组织有很强的特异性[19-20],AAV5载体感染宿主细胞或组织的范围较广泛[21-22]。AAV2是最早发现的AAV病毒,AAV2载体除了在视网膜外,在体内其他组织的表达都比其他血清型差[22]。
本研究发现注射5种病毒的小鼠肝脏中均能检测到HBcAg的表达,但其排序为AAV8>AAV9>AAV1>AAV2>AAV5,这与HBeAg、HBsAg以及HBV DNA表达略有不同,其中AAV5的表达最差,具体原因有待于进一步研究。对于肝脏的病理情况,本实验结果显示注射病毒的5组小鼠均有不同程度的病理改变,AAV8和AAV1组都可见肝细胞高度肿胀、局灶性坏死;AAV9和AAV5组可见肝细胞中度肿胀、小灶性坏死;AAV2组肝细胞轻度肿胀,偶见肝细胞坏死。推测病变可能由HBV感染导致,但也不排除小鼠自身对rAAV的免疫反应。
本研究的实验结果提示使用rAAV1- 1.3HBV、rAAV2-1.3HBV、rAAV5-1.3HBV、rAAV8-1.3HBV、rAAV9-1.3HBV均可建立持续感染的乙肝小鼠模型,其建模效果依次为AAV8>AAV9>AAV1>AAV5>AAV2。此外,AAV9载体的建模效果仅次于具有嗜肝性的AAV8载体,可以作为新的血清型在建立持续感染的乙肝小鼠模型中进一步推广应用。总之,AAV1、2、5、8、9载体为使用rAAV-1.3HBV建立乙肝小鼠模型提供了更多的载体选择种类,为进一步探索HBV致病机制、病毒与宿主相互作用研究以及药物与疫苗评价奠定了基础。
[1] Chinese Society of Hepatology and Chinese Society of Infectious Diseases, Chinese Medical Association. The guideline of prevention and treatment for chronic hepatitis B (2010 version). Chin J Hepatol, 2011, 19(1): 13–24 (in Chinese).中华医学会肝病学分会, 中华医学会感染病学分会. 慢性乙型肝炎防治指南(2010年版). 中华肝脏病杂志, 2011, 19(1): 13–24.
[2] Guidotti LG, Ando K, Hobbs MV, et al. Cytotoxic T lymphocytes inhibit hepatitis B virus gene expression by a noncytolytic mechanism in transgenic mice. Proc Natl Acad Sci USA, 1994, 91(9): 3764–3768.
[3] Guidotti LG, Ishikawa T, Hobbs MV, et al. Intra-cellular inactivation of the hepatitis B virus by cytotoxic T lymphocytes. Immunity, 1996, 4(1): 25–36.
[4] Kimura K, Kakimi K, Wieland S, et al. Activated intrahepatic antigen-presenting cells inhibit hepatitis B virus replication in the liver of transgenic mice. J Immunol, 2002, 169(9): 5188–5195.
[5] Isogawa M, Robek MD, Furuichi Y, et al. Toll-like receptor signaling inhibits hepatitis B virus replication. J Virol, 2005, 79(11): 7269–7272.
[6] Ohashi K, Marion PL, Nakai H, et a1. Sustained survival of human hepatocytesin mice:a model forinfection with human hepatitis B and hepatitis delta viruses. Nat Med, 2000, 6(3): 327–331.
[7] Liu DB, Tong YG. Advance in the mouse model of hepatitis B virus infection. World Chin J Digest, 2008, 16(34): 3859–3864 (in Chinese).刘大斌, 童贻刚. HBV的小鼠模型研究进展. 世界华人消化杂志, 2008, 16(34): 3859–3864.
[8] Dong XY, Yu CJ, Wang G, et al. Establishment of hepatitis B virus (HBV) chronic infection mouse model bytransduction with a recombinant adeno-associated virus 8 carrying 1.3 copies of HBV genome (rAAV8-1.3HBV). Chin J Virol, 2010, 26(6): 425–431 (in Chinese).董小岩, 尉迟捷, 王刚, 等. 高嗜肝性8型重组腺相关病毒体内转导法制备乙型肝炎病毒持续感染小鼠模型. 病毒学报, 2010, 26(6): 425–431.
[9] Wang G, Dong XY, Tian WH, et al. Study on the differences of two mouse models of Hepatitis B virus injection by transduction with rAAV8-1.3HBV. Chin J Virol, 2012, 28(5): 541–547 (in Chinese).王刚,董小岩,田文洪, 等. 用rAAV8-1.3HBV制备两种品系小鼠乙型肝炎病毒感染模型的比较研究. 病毒学报, 2012, 28(5): 541–547.
[10] Wang GJ, Wang G, Dong XY, et al. Assessment of anti-HBV effects of nucleotide analogues on mouse model of chronic HBVinfection mediated by recombinant adeno-associated virus 8. Chin J Biotech, 2013, 29(1): 95–106 (in Chinese).王国婧, 王刚, 董小岩, 等. 用重组8型腺相关病毒载体介导的乙型肝炎病毒持续感染小鼠模型评价核苷类似物的抗病毒效果. 生物工程学报, 2013, 29(1): 95–106.
[11] Yang D, Liu L, Zhu D, et al. A mouse model for HBV immuno-tolerance and immunotherapy. Cell Mol Immunol, 2014, 11(1): 1–8.
[12] Wang G, Wu XB. Characteristics of adeno-associated virus 8 vectors and its application in gene therapy. Chin J Virol, 2011, 27(1): 91–95.王刚, 吴小兵. 8型腺相关病毒载体的特性以及其在基因治疗中的应用. 病毒学报, 2011, 27(1): 91–95.
[13] Nakai H, Fuess S, Storm TA, et al. Unrestricted hepatocyte transduction with adeno-associated virus serotype 8 vectors in mice. J Virol, 2005, 79(1): 214–224.
[14] Wang L, Calcedo R, Nichols TC, et al. Sustained correction of disease in native and AAV2-pretreated hemophilia B dogs: AAV2/8-mediated, liver-directed gene therapy. Blood, 2005, 105(8): 3079–3086.
[15] Wang Z, Zhu T, Qiao C, et al. Adeno-associated virus serotype 8 efficiently delivers genes to muscle and heart. Nat Biotechnol, 2005, 23(3): 321–328.
[16] Wang Z, Zhu T, Rehman KK, et al. Widespread and stable pancreatic gene transfer by adeno-associated virus vectors via different routes. Diabetes, 2006, 55(4): 875–884.
[17] Vulchanova L, Schuster DJ, Belur LR, et al. Differential adeno-associated virus mediated gene transfer to sensory neurons following intrathecal delivery by direct lumbar puncture. Mol Pain, 2010, 6: 31.
[18] Zincarelli C, Soltys S, Rengo G, et al. Analysis of AAV serotypes 1-9 mediated gene expression and tropism in mice after systemic injection. Mol Ther, 2008, 16(6): 1073–1080.
[19] Chao H, Liu Y, Rabinowitz J, et al. Several log increase in therapentic transgene delivery by distinet adeno-associated viral cerotype vectors. Mol Ther, 2000, 2(6): 619–623.
[20] Ghosh A, Yue Y, Duan D. Viral serotype and the transgene sequence influence overlapping adeno-associated viral (AAV) vector mediated gene transfer in skeletal muscle. J Gene Med, 2006, 8(3): 298–305.
[21] Chen RY, Chen SF, Zhou D, et al. Advances on research of AAV-2 vector in gene therapy.Chin Bull Life Sci, 2013, 25(6): 595–600 (in Chinese).陈如意, 陈素峰, 周丹, 等. 2型腺相关病毒作为基因治疗载体的研究进展. 生命科学, 2013, 25(6): 595–600.
[22] Gao K, Wang JZ. Expression of different serotypes of adeno-associated virus vectors: an update.2007, 14(4): 388–392 (in Chinese).高凯, 王军志. 不同血清型腺相关病毒载体组织表达差异的研究进展. 中国肿瘤生物治疗杂志, 2007, 14(4): 388–392.
(本文责编 陈宏宇)
Comparison of HBV persistent infection mice models by different serotypes of AAVs carrying HBV genomes
Xinyao Zhu1, Qingzhang Zhou2,3, Wenhong Tian2, Chunguo Liu1,3, Xiaoyan Dong3, Xiaobing Wu1,3, and Changyuan Yu1
1 College of Life Science and Technology, Beijing University of Chemical Technology, Beijing 102600, China 2 School of Life Sciences, Jilin University, Changchun 130012, Jilin, China 3 Beijing Five Plus Molecular Medicine Institute, Beijing 100176, China
In recent years, Hepatitis B virus (HBV) persistent infection mouse model with recombinant adeno-associated virus 8 carrying 1.3 copies of HBV genome (rAAV8-1.3HBV) is concerned. We studied and compared the efficacy among HBV persistent infection mice models by other serotypes except AAV8. First, we prepared and purified five viruses: rAAV1-1.3HBV, rAAV2-1.3HBV, rAAV5-1.3HBV, rAAV8-1.3HBV and rAAV9-1.3HBV. Then we injected each virus into 3 C57BL/6J mice with the dose of 1×1011vg (Viral genome, vg) per mouse. We detected HBsAg and HBeAg in sera by enzyme-linked immunosorbent assay (ELISA) at different time points post injection. We killed mice 8 weeks post injection and took blood and livers for assay. We detected copies of HBV DNA by real-time quantitative PCR in sera and livers. Meantime, we detected HBcAg in the livers of mice by immunohistochemistry and further performed pathology analysis of these livers. The five groups of mice, HBeAg and HBsAg expression sustained 8 weeks in serological detection and HBV DNA was both detected in sera and livers at the time of 8 weeks post injection. HBeAg, HBsAg, HBV DNA copies expression levels in descending order were AAV8>AAV9>AAV1>AAV5>AAV2. HBcAg expression was detected in livers as well. Varied degrees of liver damage were shown in five groups of mice. This study provides more alternative AAV vector species to establish a persistent infection with hepatitis B model.
mouse model, hepatitis B virus, AAV, persistent infection
January 28, 2015; Accepted: May 8, 2015
Changyuan Yu. Tel: +86-10-64451781; Fax: +86-10-64416428; E-mail: yucy@mail.buct.edu.cn
Xiaobing Wu. Tel: +86-10-67877739; E-mail: wuxb0168@vip.sina.com
10.13345/j.cjb.150055
Supported by:National High Technology Research and Development Program of China (863 Program) (No. 2012AA020810), National Natural Science Foundation of China (No. 81273631).
国家高技术研究发展计划(863计划) (No. 2012AA020810),国家自然科学基金(No. 81273631) 资助。

