热化疗对ARH-77细胞体外增敏作用的实验研究*
赵文飞 魏红梅 于华 马晓燕 赵文文 霍云华 陆月香 张克勤(.青岛市中心(肿瘤)医院肿瘤综合二科,山东青岛6604; .总装备部奥林佳苑干休所,北京000;.南方医科大学第五附属医院肿瘤科,广东广州50900)
热化疗对ARH-77细胞体外增敏作用的实验研究*
赵文飞1魏红梅1于华1马晓燕1赵文文1霍云华2陆月香3张克勤3
(1.青岛市中心(肿瘤)医院肿瘤综合二科,山东青岛266042; 2.总装备部奥林佳苑干休所,北京1001023;3.南方医科大学第五附属医院肿瘤科,广东广州510900)
目的观察热疗联合阿霉素对人多发性骨髓瘤细胞株ARH-77细胞内的药物浓度变化及凋亡的影响。方法MTT法确定阿霉素的工作浓度,以该浓度进行化疗或与热疗的联合,选择温度40℃、41℃及42℃,体外作用于ARH-77细胞。作用前及48 h采用台盼蓝拒染法检测肿瘤细胞的存活率;MTT法检测肿瘤细胞增殖的抑制作用;流式细胞仪检测肿瘤细胞的凋亡及细胞内药物浓度的变化。观察热疗联合阿霉素的抗肿瘤效果。结果作用48h IC50的药物浓度作为实验的工作浓度。热化疗组对ARH-77细胞有明显的抑制作用(P<0.01),随着温度的增高而增强;热化疗组细胞内的药物浓度明显增加(P<0.01)。结论热疗联合阿霉素能增加ARH-77细胞内的药物浓度,提高肿瘤细胞的凋亡率。
热化疗;阿霉素;ARH-77;增敏作用;凋亡
多发性骨髓瘤(multiple myeloma,MM)是骨髓内浆细胞异常增生的一种恶性肿瘤,多见于中老年人,未经治疗的中位生存期6个月,早期无症状。全身化疗是其主要治疗方法,最近,治疗方法有了新的思路和进展,涌现了一批新药,如反应停及蛋白酶体抑制剂万珂的出现和干细胞移植治疗方法的不断完善,使MM的缓解率有了很大提高。MM应用化疗治疗取得缓解后,易复发,且大部分病人对化疗药物产生了多药耐药,寻求新的治疗方法非常重要。
本研究使用人源多发性骨髓瘤细胞株,观察了阿霉素(adriamycin,ADM)与热疗联合对ARH-77体外增敏作用的影响,为临床热化疗联合应用逆转耐药提供实验基础。
1 材料与方法
1.1 细胞株人源多发性骨髓瘤细胞株ARH-77购于湖南大学湘雅医学院细胞中心,由我科实验室传代保存。
1.2 试验分组试验设对照组(单纯培养)、化疗组、热疗组和热化疗组,其中,热疗和热化疗组各分别设40℃、41℃及42℃3个温度,共设8组。
1.3 热疗方法电热恒温水浴箱中加热60 min,温度变化±0.2℃。
1.3.1 药物工作浓度的确定阿霉素设1、2、4、8、16μg/m l5个浓度组,每组设3个复孔,以MTT法测定细胞增殖抑制率,以48 h IC50的药物浓度作为试验的工作浓度。IC50的数值按IC50计算软件获得。
1.3.2 处理方法取对数生长期的ARH-77细胞,用RPMI-1640培养液配成细胞密度为5×104/ m l的单细胞悬液,接种于50 ml的培养瓶中,阿霉素按照上述工作浓度分别加入化疗组及热化疗组,对照组及化疗组放在培养箱中继续培养;热疗组及热化疗组即刻放入电热恒温水浴箱中按照不同温度加温60 min,然后放回培养箱中继续培养,48 h时检测各项指标。
1.4 台盼蓝拒染法检测细胞存活率48 h后取各组细胞悬液稀释至细胞数约为106/m l,分别吸出0.9 ml均匀细胞液移入EP管中,再加0.1 ml 0.4%的台盼蓝溶液,显微镜下计数。计算公式:细胞存活率(%)=[活细胞总数/(活细胞总数+死细胞总数)]×100%。试验重复3次。
1.5 MTT法测定细胞增殖48 h收集各组的ARH-77细胞接种到8个96孔板中,每孔200μl (103个细胞),每孔加入MTT 20μl,继续培养4 h,2000 r/min,离心5 min,离心半径是17.5 cm,吸去培养液,每孔加入150μl DMSO,在微型震荡上震荡5 min,然后将培养板置于全自动酶标仪上,选490 nm为测定波长,测定各孔的OD值,计算细胞增殖抑制率。实验重复3次。
细胞增殖抑制率=(对照组OD均值-实验组OD均值)/对照组OD均值×100%
1.6 流式细胞仪测定细胞内药物浓度采用流式细胞仪技术检测细胞内阿霉素浓度[1]。试验温度为42℃,取分组处理的对数生长期的ARH-77细胞接种于50 ml的培养瓶中,每瓶细胞数为5×105,冷PBS(4℃,pH7.4)洗涤2次,再重悬于冷PBS中,4℃下保存至上样行流式细胞仪检测。检测激发波长为488 nm,接受波长为575 nm。试验重复3次。
1.7 流式细胞仪检测细胞凋亡48 h后收集各组的ARH-77细胞,每瓶细胞数为2×105,去上清后加入300μl DNA染液(内含碘化丙啶100μg/ml和RNA酶20 u/ml),轻摇细胞悬液后于室温避光保存30 min。每管加入400μl缓冲液混合后上流式细胞仪检测细胞凋亡情况,试验重复3次。
1.8 热疗和化疗联合作用的观察根据Veleriote法[2]判定热化疗联合的相互作用类型。协同作用:[C]<[E];相加作用:[C]=[E];次加作用:[E]<[C]<[H]或[E]<[C]<[D];干扰作用:[D]<[C]<[H]。其中:[H]为热疗组的细胞存活率,[D]为化疗组的细胞存活率,[C]为热化疗组的细胞存活率,[E]为热化疗联合的预估细胞存活率,[E]=[H]×[D]/100。
1.9 统计学处理应用SPSS 18.0软件进行数据处理,结果采用均数±标准差表示,采用单向方差分析(One-way ANOVA),均数两两比较采用LSD法,方差不齐的组间比较采用Tamhane’s T2法。
2 结果
2.1 阿霉素工作浓度的确定MTT实验测得1、2、4、8及16μg/m l不同浓度的ADM作用ARH-77细胞48 h的抑制率分别为(17.9±2.9%)、(25.7± 3.6%)、(37.2±4.1%)、(43.8±5.3%)及(66.3±4.5 %)。ADM对ARH-77细胞的IC50为8.16μg/ m l,并以此药物浓度进行各项试验。
2.2 热疗联合阿霉素对细胞存活率的影响试验前细胞存活率均为100%。ARH-77细胞株在40℃、41℃及42℃三个温度下各组存活率之间差异有统计学意义。组间多重比较采用LSD法,在三个温度下细胞存活率以及各组与对照组比较,热化疗组与热疗组、化疗组相比的情况详见表1。
2.3 细胞的抑制率单纯40℃、41℃及42℃热疗60 min在48h对ARH-77细胞均有抑制作用(P<0.01);单纯ADM组对ARH-77细胞也有一定的抑制作用;3种温度的热化疗组的细胞抑制率均较热疗组和化疗组显著增高(P<0.01);42℃的热化疗与40℃的热化疗之间的抑制率有显著性差异(P< 0.01),42℃与41℃、41℃与40℃的热化疗组之间的抑制率的差异无统计学意义(P>0.05)。详见表1。
2.4 加热对细胞内阿霉素药物浓度的影响利用流式细胞仪检测细胞内阿霉素荧光强度的改变。ARH-77结果如下:对照组(0.19±0.01)、化疗组(4.2±0.3)和热化疗组(7.9±0.1),热化疗组与化疗组、对照组相比均有统计学意义(P<0.01)。
2.5 流式细胞仪检测凋亡在40℃、41℃及42℃温度下,48h ARH-77细胞的凋亡情况发现,热疗组及热化疗组细胞凋亡率较对照组有明显升高(P<0.01);化疗组与对照组相比差异无统计学意义(P>0.05)。热化疗组的细胞凋亡率较单纯热疗及单纯化疗的凋亡率均明显升高(P<0.01)。上述结果均随温度的增加而增强。详见表1。
表1 热疗联合化疗对ARH-77细胞存活率、抑制率及凋亡率的分析(%
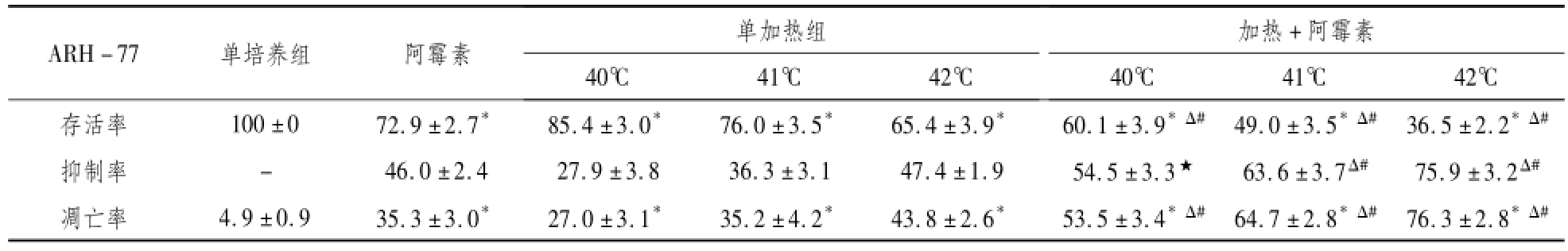
表1 热疗联合化疗对ARH-77细胞存活率、抑制率及凋亡率的分析(%
注:*P<0.01,与对照组相比;ΔP<0.01,★P<0.05,与阿霉素组相比;#P<0.01,★P<0.01,与相同温度的单加热组相比。
ARH-77单培养组阿霉素单加热组加热+阿霉素40℃41℃42℃存活率100±0 72.9±2.7*85.4±3.0*76.0±3.5*65.4±3.9*60.1±3.9*Δ#49.0±3.5*Δ#36.5±2.2*Δ#40℃41℃42℃抑制率-46.0±2.4 27.9±3.8 36.3±3.1 47.4±1.9 54.5±3.3★63.6±3.7Δ#75.9±3.2Δ#凋亡率4.9±0.9 35.3±3.0*27.0±3.1*35.2±4.2*43.8±2.6*53.5±3.4*Δ#64.7±2.8*Δ#76.3±2.8*Δ#
2.6 热疗和化疗联合作用的观察根据Veleriote法判定热疗与化疗联合的相互作用类型,详见表2。
表2 Veleriote法判断热疗与阿霉素联合对ARH-77细胞的影响(细胞存活率均值,%)
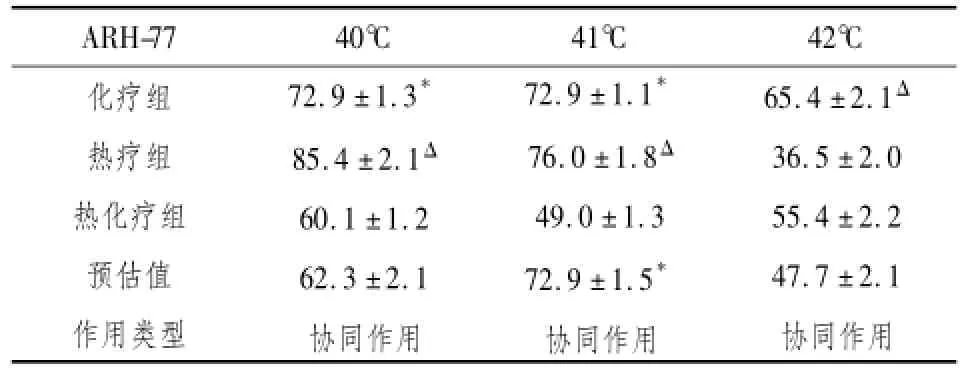
表2 Veleriote法判断热疗与阿霉素联合对ARH-77细胞的影响(细胞存活率均值,%)
注:*P<0.01,与热化疗组相比;ΔP<0.01,与热化疗组相比。
协同作用ARH-77 40℃41℃42℃化疗组热疗组热化疗组预估值作用类型72.9±1.3*85.4±2.1Δ60.1±1.2 62.3±2.1协同作用72.9±1.1*76.0±1.8Δ49.0±1.3 72.9±1.5*协同作用65.4±2.1Δ36.5±2.0 55.4±2.2 47.7±2.1
3 讨论
目前造血系统的恶性肿瘤,发病率高,预后差,在儿童及35岁以下的成人中居第一位。其传统治疗包括化疗、放疗、生物制剂和骨髓移植等治疗。虽然取得较大的疗效,但对复发难治及耐药的恶性血液病,目前缺乏有效的治疗方法。化疗是综合治疗的重要组成部分,如何提高肿瘤细胞对化疗药物的敏感性,提高化疗的总体效率是治疗中亟待解决的问题。目前热疗被誉为肿瘤治疗学中继手术、放疗、化疗、免疫治疗后的第5种治疗肿瘤的新手段。
3.1 热疗增加化疗敏感性的作用机制热疗结合化疗杀伤癌细胞的机理比较复杂,可能与以下几点有关[3-4]。(1)高温对生物膜有影响:高热破坏细胞膜的稳定性,使细胞膜的通透性增加,易于药物进入癌细胞内并维持胞浆内较高的药物浓度,增强化学反应,加重DNA损伤,影响损伤DNA的修复[5]。(2)高热可使细胞膜乏氧:无氧酵解增加,导致癌细胞的pH值降低,某些药物在酸性环境下活性增强,杀伤力提高[6]。(3)热疗可以减少或防止癌细胞产生耐药性:有实验证明耐药细胞加热后对化疗敏感性又明显提高。(4)热疗使化疗具有定向性:由于肿瘤组织血液供应的特点,瘤体中心血供差,多为乏氧细胞,对放疗、化疗不敏感,而周边部血供丰富,对化疗敏感,从而达到原药物浓度达不到的效果。近年来,热疗和化疗联合应用在基础和临床方面的研究取得了可喜成果。大量研究证明,热疗可以有效增加肿瘤细胞对化疗药物的敏感性,两者具有协同作用[7-8]。有研究证明,加热42℃、2h可使某些化疗药物细胞毒性增强10~100倍,常温下细胞毒性较弱的化疗药物在加热后杀伤能力成倍增加[9]。
3.2 ADM对热疗的影响ADM是肿瘤细胞有丝分裂S期非特异性阻滞药物,主要作用机制是在DNA复制过程中诱导TOPOII抑制剂—DNA断裂物复合物的形成,引起细胞死亡或停滞于S期,G2期[10]。由于ADM使大量细胞处于S期,S期对热最敏感[11],因此先化后热对肿瘤细胞的杀伤作用增强。ADM对热疗具有增敏作用,有研究表明,加热前后细胞内阿霉素浓度有一定变化[12]。张洪新等[13]试验结果亦显示:加热后,肿瘤细胞内阿霉素荧光强度均较加热前提高显著,说明加热是通过增加肿瘤细胞内阿霉素药物浓度来提高其对化疗敏感性的。
在我们的实验中,从本实验可以看出,化疗组及热疗组对K562细胞的生长均有不同程度的抑制作用,各热化疗组的抑制率与对照组、热疗组及化疗组相比差异均有统计学意义(P<0.01),作用强度随温度升高而增强;流式细胞仪检测细胞凋亡表明:加热可以使肿瘤凋亡率增加,热化疗组与其他各组相比有显著差异(P<0.01),并随温度增加凋亡率增加。42℃加热后,K562细胞内ADM荧光强度均较加热前显著提高,提示加热可能是通过增加肿瘤细胞内ADM的药物浓度来提高其细胞毒作用的。目前对于热化疗的作用机制有了一定的研究,但有关热化疗对多药耐药影响的报道不多,热化疗逆转肿瘤细胞多药耐药性的分子生物学机制研究也不够深入.并从分子水平阐述了热化疗降低肿瘤细胞耐药性的可能机制,热疗是否也通过其他途径产生抗肿瘤耐药作用日前正在研究之中。为热化疗的临床应用提供了进一步的理论依据。
[1]郑国强,刘叙仪,韩复生,等.阿霉素耐药性研究与流式细胞分析[J].中国肺癌杂志,2002,5(1):28-30.
[2]Avendano C,Menendez JC.Inhibitors ofmultidrug resistance to antitumor agents(MDR)[J].Curr Med Chem,2002,9(2):159-193.
[3]刘宝瑞,钱晓萍.肿瘤热化疗的基础与临床研究进展[J].国外医学·肿瘤学分册,2004,31(1):34-37.
[4]刘宝瑞,杨觅.恶性肿瘤的热化疗与热靶化疗[J].实用临床医药志,2005,9(5):1-4.
[5]张洪新,王执民,郭卫平,等.阿霉素化疗与热化疗对兔VX-2细胞体外作用的比较[J].癌症,1999,18(3):276-278.
[6]张洪新,刘燕,王执民,等.阿霉素加热化疗对人肝癌细胞耐药模型-7721/Adm多药耐药性的影响[J].中华物理医学与康复杂志,2000,22(6):366-369.
[7]张洪新,刘燕,王执民,等.高温与阿霉素对兔VX-2细胞的协同作用[J].基础医学与临床,2000,20(3):276-279.
[8]葛少华,刘宝瑞,钱晓萍.羟基喜树碱与热疗联合对胃癌细胞系体外增殖抑制作用的研究[J].实用临床医药杂志,2005,9(5): 9-13.
[9]张洪新,王执民,郭卫平,等.温热与化疗对兔VX-2细胞毒作用的研究[J].中华物理医学与康复杂志.1999,21(6):121.
[10]Tewey KM,Rowe TC,Yang L,et al.Adriamycin-induced DNA damage mediated by mammalian DNA topoisomerase II[J].Scince,1984,226(4673):466-468.
[11]ValdagniR.International consensusmeeting on hyperthermia:Final report[J].Int JHyperthermia,1990,6(5):839-877.
[12]Nishikawa K,Asaumi J,Kawasaki S,et al.Influence of cepharanthin and hyperthermia on the intracellular accumulatin of adriamycin and Fluo3,an indicator of Ca2+[J].Anticancer Res,1998,18(3A):1649-1654.
[13]张洪新,刘燕,王执民,等.加热对人肝癌细胞7721/Adm耐药株阿霉素的增敏作用[J].基础医学与临床,2001,21(5),432 -434.
Thermotherapy enhanced sensitivity ofm ultip lem yelom a cell line ARH-77 to chem otherapy in vitro
ZHAOWen-fei1WEIHong-mei1YU Hua1MAXiao-yan1ZHAOWen-wen1HUO Yun-hua2LU Yue-xiang3ZHANGKe-qin3
(1.Dept.of Oncology,Qingdao Central Hospital,Qingdao 266042;2.Cadre Relaxation Club of the General Armaments Department,Beijing 100101;3.Dept.of Oncology,Fifth Affiliated Hospital of Southern Medical University,Guangzhou 510900,China)
Objective:To observe the effectof thermotherapy on the intracellular adriamycin concentration and apoptosis of ARH-77 cells in vitro.Methods:The working concentration of adriamycin against ARH-77 was determined by MTT assay.ARH-77 cells were subjected to thermotherapy(at40℃,41℃,42℃)and chemotherapy with adriamycin alone or in conjunction,and the cell survival rates were determ ined at48h after the treatment.The cell growth inhibition effect of the treatmentwas evaluated with MTT assay,and the apoptosis rates of ARH-77 and alteration of intracellular adriamycin concentration were determ ined by flow cytometric analyses.Results:The IC50 of adriamycin was defined as the working concentration in the experiment.The thermotherapy at 40,41 and 42℃for 60 min in conjunction with chemotherapy significantly inhibited the growth of ARH-77 cells(P<0.01).The results of flow cytometric analyses showed that thermotherapy and adriamycin chemotherapy,used either alone or in conjunction,obviously increased the apoptosis rates of ARH-77 cells (P<0.01)and thermotherapy remarkably increased the intracellular concentration of adriamycin.Conclusion:Adriamycin chemotherapy combined thermotherapy for 60min can increase the intracellular concentration of adriamycin and the apoptosis rates of ARH-77 cells.
thermochemotherapy;adriamycin;ARH-77 cells;sensitization;apoptosis
R73-3
A
1004-7115(2015)09-0967-04
10.3969/j.issn.1004-7115.2015.09.001
2015-04-08)
CSCO-先声抗肿瘤血管靶向治疗科研基金(Y-S2014-016,省级)。
赵文飞(1982-),医师,硕士,主要从事肿瘤内科的治疗工作。
张克勤(1964-),男,博士,副主任医师,主要从事热化疗治疗恶性肿瘤的基础和临床研究及恶性肿瘤的生物治疗。E-mail: gczhkq@163.com。

