运动对雌性SD 大鼠卵巢和血清中超氧化物歧化酶的影响
刘 龙
(郑州大学体育学院,河南郑州 450044)
超氧化物歧化酶(super oxide dismutase,SOD)作为细胞中的一种抗氧化酶,在生物体清除氧自由基方面发挥着重要作用。氧自由基在生物体内如果堆积过多,会造成细胞膜上脂质发生过氧化,脂质过氧化会导致细胞膜的正常结构和功能遭到破坏,并进一步会导致蛋白质的交联和变性,导致生物体内许多酶类和激素失去活性。氧自由基堆积过多还会破坏核酸的正常结构。最终使机体代谢出现异常,出现一种退行性的变化,从而导致了衰老现象的发生[1-3]。SOD可以有效清除机体内的有害自由基,及时修复受损伤的细胞和蛋白质,对减缓机体衰老起着很重要的调控作用[4]。研究表明,衰老大鼠睾丸组织中包含SOD在内的一些抗氧化酶活性均显著降低[5]。睾丸组织中含有的SOD含量下降,还会导致细胞内的抗氧化作用和氧化作用之间的平衡出现失调,并最终导致自由基的堆积,加速衰老[6]。适度运动可以通过各种体制提高机体内的SOD含量,从而清除体内的自由基,延缓衰老的发生[7],运动通过影响外周血和生殖系统器官内SOD的含量对有机体的新陈代谢起着重要的调控作用。
现今关于运动与衰老的试验研究也有一定的报道,但大都侧重于男性生殖系统与衰老的研究,有关适度运动对外周血和女性生殖系统器官组织中SOD的影响及其与衰老的研究至今未见报道。本研究运用免疫组化SP法检测了雌性大鼠卵巢中SOD的表达并进一步检测了大鼠血清中SOD的浓度,为进一步探讨运动与SOD的调控衰老提供了形态学依据。
1 材料与方法
1.1 材料
健康青春期雌性SD大鼠,体重240g~250g为河南省实验动物中心产品;兔抗鼠SOD多克隆抗体为南京建成生物所产品。
1.2 方法
1.2.1 实验动物及分组 将SD大鼠常规饲养管理,1周后用于试验。并随机分为对照组、20、40、60、80min运动组,共5个试验组。运动形式为游泳,对照组大鼠不运动,试验组大鼠每天分别运动20、40、60、80min。每日进行1次运动,每周运动5d,试验时间为20周。
1.2.2 取材及切片 各试验组训练20周后40mL/L的水合氯霉醛腹腔麻醉处死实验动物,颈动脉取血,制备血清备用。同时取各试验组大鼠卵巢,并迅速置于4℃质量分数为40mL/L的多聚甲醛磷酸缓冲液固定12h~24h后。对固定的卵巢做石蜡切片进行免疫组化染色,切片片厚5μm,取其中的2套。第1套行进行免疫组化SP法染色;第2套用PBS代替一抗,作为对照。
1.2.3 主要试剂及免疫组化操作程序 一抗为兔抗鼠SOD多克隆抗体(1∶100稀释,为武汉博士德生物工程有限公司产品),切片脱蜡复水,按抗体要求和试剂盒操作说明进行免疫组化操作。最后用梯度乙醇脱水干燥后,二甲苯透明,中性树胶封片。阴性对照切片染色按照免疫组织化学SP法的染色步骤进行处理,只是把步骤中加入的兔抗大鼠SOD抗体用PBS液代替,其余步骤完全相同,阴性对照用0.01mol/L的PBS缓冲液代替一抗,用DAB显色,然后贴片,进行梯度酒精脱水,用二甲苯透明后置于显微镜下观察。
1.2.4 结果判断及统计学处理 SOD测定时,设空白管(不加亚硝酸钠和标本)、标准管(加入20μmol/L的亚硝酸钠)和测定管,往测定管内加0.3mL的待测血清。各管混匀放置10min后,3 500r/min~4 000r/min离心10min,然后取上清液0.8mL,37℃恒温水浴40min,加入显色剂混匀,10min以后倒入1cm的光径比色杯中,用蒸馏水调零,用酶标仪于波长550nm处比色。并按公式[SOD活力NU/mL(亚硝酸盐单位/mL)=(A对照管-A测定管)÷A对照管÷50%×稀释液倍数],计算SOD活力[8]。免疫组化反应中有蓝色颗粒者为阳性,切片中阴性表达的细胞质不显色。图片分析时随机选取10个相同部位不同切片的高倍镜视野(400×),用江苏捷达高清晰的图像分析系统分析,并计算出每一个视野的阳性强度均值(阳性强度均值用平均吸光度表示)和阳性面积,然后计算出相对的表达量μ2均值(μ2=光镜倍数×阳性强度均值×阳性面积/260 000)[8],公式中260 000表示像素。最终计量资料应用均值±标准差(¯x±SD)表示,统计学应用SPSS11.5统计软件进行统计分析,用t检验法比较出各组大鼠卵巢中SOD的表达,P<0.05表示差异显著;P<0.01表示差异极显著。
2 结果
2.1 SOD浓度测定结果
与对照组相比,20min运动训练组与0min运动组相比无显著性差异,80min运动训练组大鼠血清中SOD浓度较低而差异显著(P<0.05);40min和60min运动组大鼠血清中SOD的浓度与对照组相比较高而差异显著(P<0.05)同时,40min运动训练组与60min运动训练组之间差异不显著(P>0.05),但二者分别与20min运动训练组和80min运动训练组之间有显著性差异(P<0.05)(表1)。
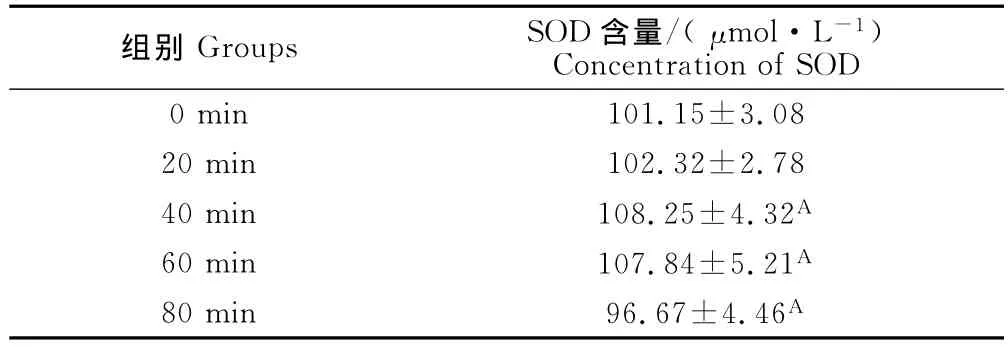
表1 运动对大鼠血清中SOD浓度的影响Table 1 Effect of exercise on SOD concentration in the serum of rats
2.2 SOD在不同运动组大鼠卵巢中的表达结果
在对照组大鼠卵巢黄体的颗粒性黄体细胞中SOD免疫反应阳性产物为蓝色强阳性表达,阳性胞体内深蓝色的阳性表达产物融合为团状,阳性颗粒染成一片,阳性细胞体间的轮廓清晰,阳性细胞中阳性产物定位在胞膜和部分胞质,胞核不着色呈现空泡状(图1A)。40min和60min运动组大鼠的颗粒性黄体细胞中SOD免疫反应阳性产物呈现蓝黑色的强阳性表达,阳性细胞多为聚集或分散存在,阳性细胞呈不规则的圆形、卵圆形以及梭形等(图1C和图1D)。在20min和80min运动组大鼠的卵巢粒性黄体细胞中SOD免疫反应阳性产物均呈蓝色的弱阳性表达,阳性表达的细胞体轮廓模糊不清,用高倍镜才可以看到阳性细胞中含有少量的浅蓝色阳性颗粒。阳性表达的细胞体多为不规则的圆形和卵圆形(图1B和图1E,表2)。

表2 SOD在不同实验组大鼠卵巢中的表达Table 2 The expression of SOD in the ovary of exprimental rats

图1 SOD在不同运动组大鼠卵巢中的表达Fig.1 The expression of SOD in the ovaries of different groups of rats
3 讨论
SOD作为生物体内的重要抗氧化酶,可清除细胞代谢过程中所产生的氧自由基,并可以降低氧自由基对细胞造成的损害,从而与机体的衰老机制的调控密切相关[9-10]。运动本身可以对机体造成一种刺激,这种刺激会导致机体的功能和内环境发生不同程度的应激,运动时间长短不同,对应激反应的强弱也有一定的差异。本试验结果表明,大鼠短时间运动20min后,其血液中SOD的浓度与0min运动组相比略有增高而差异不显着,说明,短时间运动不能达到机体的应激反应阈值,对机体衰老也不会产生影响。但是随着大鼠运动时间开始增加,每日的运动时间增加到40min,甚至增加到60min,大鼠血清中SOD浓度与对照组相比含量增高而有显著性差异(P<0.05)这一研究结果提示,适当的运动可以促使有机体产生一些有利的应激反应,使细胞内产生大量的SOD,提高了细胞对氧自由基的清除作用,从而对机体起到了抗衰老的作用[11]。当大鼠每日运动时长增加到80min,血液中SOD浓度与0min运动组相比却没有随着运动时间的延长而浓度增高,而是出现了明显的降低(P<0.05),提示,长时间运动会使机体应激过度而处于比较疲惫状态,使得机体失去代偿状态的大量细胞不能产生相应浓度的SOD,并导致细胞内大量氧化物堆积而不能及时清除,不但不能对衰老起到延缓作用,还会对机体产生一定程度的损伤作用。
运动本身是一种强烈的刺激性活动,会造成机体的耗氧和耗能增加,而产生一定的自由基。SOD在清除氧自由基过程中会大量消耗,有机体则可以通过正反馈调节机制增强细胞SOD的表达。在本研究中,20min运动组卵巢黄体中SOD的表达与对照组之间无显着性的差异(P>0.05)。提示,随着大鼠运动时间的增加,机体相应的会提高SOD的表达以应对其不断的消耗,但由于运动时间较短,体内产生的氧自由基数量较少,短时间不能达到反馈调节阈值,因此,SOD的水平没有增加。随着运动时间的进一步增加,当增加到40min和60min时,细胞在耗氧和耗能过程中会产生大量氧自由基,细胞内储存的SOD会消耗殆尽。为平衡机体代谢,细胞会做出相应的调节[12],以提高SOD的表达,增加细胞SOD的含量,减少氧自由基的损伤[13-14]。但是,随着运动时间的进一步增加,当运动时间增加到80min时,运动训练组大鼠较对照组卵巢黄体中SOD水平有所降低而差异显着(P<0.05)。长时间运动会导致细胞内SOD水平消耗过多,或者是由于清除氧自由基会消耗大量SOD,使其在体内的含量降低。
综上所述,当机体受到运动刺激时,细胞内会迅速产生大量氧自由基,消耗了细胞内储存的SOD。随着运动时间的延长,细胞耗氧耗能增加,最终导致胞内储存的SOD消耗殆尽,细胞开始出现一系列适应性反应,以增加细胞内SOD的水平,减少氧自由基对机体的损伤,随着运动时间的进一步延长,有机体开始处于过度疲惫状态,机体内失去代偿状态的大量细胞不能产生足够的SOD,使机体内SOD水平下降,最终导致细胞内的过氧化物堆积和细胞损伤。
[1]Itoh M,Oh-ishi S,Hatao H,et al.Effects of dietary calcium restriction and acute exercise on the antioxidant enzyme system and oxidative stress in rat diaphragm[J].Am J Physiol Regul Integr Comp Physiol,2004,287:33-38.
[2]Mitsuoka H,Unnon N,Sakurai T.Pathophysiological role of endothelins in pulmonary microcirculatory disorders due to intestinal ischemia and reperfusion[J].J Surg Res,1999,87(2):143-151.
[3]卞龙艳,蒋 丹,林 芳.运动对成年小鼠肌肉氧自由基和自噬水平的影响[J].苏州大学学报:医学版,2012,32(4):510-513.
[4]Ye N,Liu S,Lin Y,et al.Protective effects of intraperitoneal injection of TAT-SOD against focal cerebral ischemia/reperfusion injury in rats[J].Life Sci,2011,89(23/24):868-874.
[5]公铁红,付淑华,牛嗣云,等.衰老大鼠睾丸组织SOD、MDA和血清睾酮含量的变化[J].承德医学院学报,2012,29(1):14-16.
[6]蔡崇岳,章振保,田生平.衰老雄性大鼠睾丸组织抗氧化酶与血清睾丸酮水平、凋亡蛋白酶-3基因表达的研究[J].汕头大学医学院学报,2006,19(3):154-157.
[7]李芳晖,杨海平,王景贵,等.去乙酰化酶1介导衰老相关疾病的发病机制及其与运动的关系[J].中国运动医学杂志,2012,31(11):1014-1020.
[8]胡昌东,归绥琪.自然流产患者滋养细胞肝素表皮生长因子的表达和意义[J].上海医学,2004,27(7):491-494.
[9]项红军,赵佐庆,李纪鹏,等.大鼠小肠缺血再灌注后血中NO,SOD浓度及肺中Bax,Bcl-2表达的改变[J].第四军医大学学报,2002,23(21):1974-1977.
[10]Flint A C,Kame H,Navi B B,et al.Statin use during ischemic stroke hospitalization is strongly associated with improved poststroke surviva[J].Stroke,2012,43(1):147-154.
[11]Hollander J,Fiebig R,Ookawara T,et al.et al.Superoxide dismutase gene expression is activated by a single bout of exercise in rat skeletal muscle[J].Eur J Physiol,2001,442(3):426-434.
[12]Ji L L,Dillon D,Wu E.Alteration of antioxidant enzymes with aging in rat skeletal muscle and liver[J].Am J Physiol,1990,258(4):918-923.
[13]Hatao H,Oh-ishi S,Itoh M,et al.Effects of acute exercise on lung antioxidant enzymes in young and old rats[J].Mech Ageing Dev,2006,127(4):384-390.
[14]AmeLIE Rebillard,Luz Lefeuvre-Offila,Jordan Gueritat,et al.Prostate cancer physical:Adaptive response to oxidative stress[J].Free Radical Biol Med,2013,60:115-124.

